10.5: Productos Endo y Exo
- Page ID
- 79267
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La reacción de Diels Alder es probablemente la cicloadición más común. Permite la construcción de anillos de seis miembros, que son muy comunes en pequeñas moléculas biológicas que frecuentemente son dianas sintéticas.
A menudo, ya hay anillos en las moléculas sometidas a reacción, y se está agregando uno nuevo. Cuando dos estructuras cíclicas se combinan en una reacción de Diels Alder, se forma un tercer anillo entre las originales. Hay diferentes formas en que los dos anillos originales se pueden combinar, lo que lleva a diferentes resultados estereoquímicos. Estos dos resultados se llaman adición “exo” y “endo”.
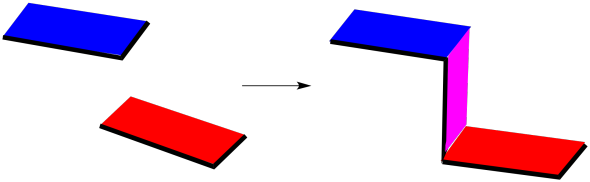
Una adición exo se ve algo así, esquemáticamente. Las dos moléculas se acercan con mínimo overal entre sus caras; combinan bordes. El producto exo que resulta tiene una especie de forma de Z.
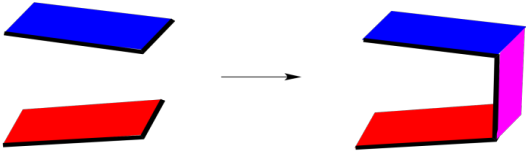
Una adición endo se parece más a esto, esquemáticamente. Dos moléculas cíclicas se acercan entre sí para que haya una superposición máxima entre sus caras. El producto endo que resulta tiene una especie de forma de C.
Veamos estos dos modos de adición con moléculas reales. Aquí estamos agregando furano, el dieno, al anhídrido maleico, el dienófilo. Los dos reactivos pueden acercarse entre sí de tal manera que uno parece estar arrastrándose detrás del otro, y en este caso parecen estar orientados en la misma dirección, en lo que respecta a la orientación de los átomos de oxígeno. Este enfoque conduce al producto exo zig-zag. En el otro caso, las dos moléculas pueden estar directamente una encima de la otra; una molécula parece estar plegada debajo de la otra. Este enfoque conduce al producto endo rizado.
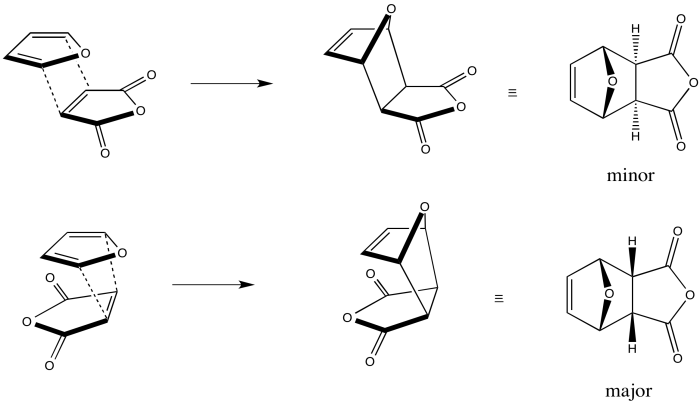
De hecho, como muestra el diagrama, el producto endo suele ser el preferido. A menudo, el margen es sustancial; se puede ver 90% endo producto o mayor en algunos casos, aunque la relación a veces es mucho menor.
La razón de esta diferencia tiene algo que ver con una interacción entre el sistema π deslocalizado del dieno y los grupos sustituyentes unidos al dienófilo. Varios investigadores atribuyen la preferencia a una “interacción orbital molecular secundaria” entre el dieno y el dienófilo, mientras que otros describen la interacción como una interacción de dispersión de Londres, en la que las débiles atracciones intermoleculares estabilizan el estado de transición en una geometría.
Los productos endo y exo son realmente dos diastereómeros diferentes. Si lo piensas bien, puedes ver que cuando dos anillos se fusionan para hacer un tercero, se pueden crear cuatro nuevos estereocentros.
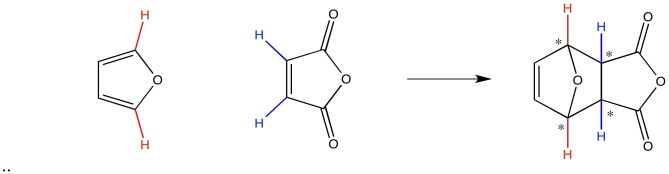
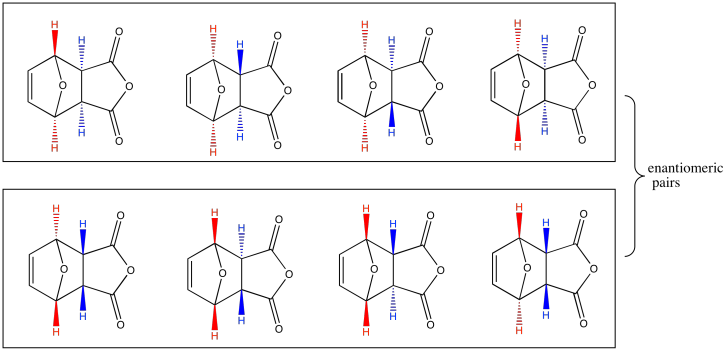
Dado que cada centro quiral podría tener dos configuraciones posibles, existen dieciséis posibles estereoisómeros que podrían resultar en la reacción mostrada anteriormente. Eso son muchas estructuras. Apenas ocho de ellos se muestran a continuación. Obsérvese que ocurren en pares de enantiómeros. Sin embargo, la mayoría de esos diastereómeros realmente no ocurren.

Extraer los otros estereisómeros del producto formado a partir de la reacción entre furano y anhídrido maleico.
- Responder
-
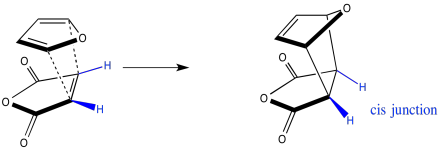
Si miramos la molécula de esta manera, con los hidrógenos resaltados en los extremos del dieno y el dienófilo, puede ser más fácil ver las relaciones estereocmicales en los productos exo y endo. En el producto exo, el par de hidrógenos en el dieno termina cis al par de hidrógenos en el dienófilo cuando los anillos se fusionan. En el producto endo, lo contrario es cierto: el par de hidrógenos en el dieno salen trans al par de hidrógenos en el dienófilo cuando los anillos se fusionan.

Tenga en cuenta que los hidrógenos en los extremos del dieno salen cis entre sí, también. Serían cis entre sí en el ring, y esa relación no cambia en el transcurso de la reacción.
Lo mismo ocurre con los hidrógenos en el dienófilo.
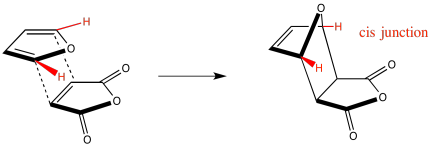
Sería muy difícil que los dos hidrógenos cis en un anillo se conviertan en trans en el producto, porque requeriría que un anillo reaccione a través de dos caras diferentes al mismo tiempo. Sería difícil conseguir un anillo torcido alrededor para hacer eso. Como resultado, podemos ignorar la mayoría de los diastereoisómeros que podrían resultar de una reacción de Diels Alder en papel, y enfocarnos en los productos endo y exo.

Por supuesto, las reacciones de Diels Alder entre anillos como estos siempre tienen el potencial de producir pares de enantiómeros. Debido a que dos enantiómeros son iguales en energía entre sí, no hay preferencia inherente por formar uno sobre el otro. En otras palabras, en realidad habría dos productos endo, y serían enantiómeros el uno del otro. También habría dos productos exo, y esos serían anantiómeros el uno del otro, también.
Se dispone de métodos para influir exclusivamente en la formación de un enantiómero. Estos métodos implican el uso de catalizadores quirales. Estos catalizadores pueden contener metales ácidos de Lewis o pueden contener alguna combinación de donantes y aceptores de enlaces de hidrógeno. En cualquier caso, el papel del catalizador es atar los reactivos juntos para que experimenten la reacción. Si el catalizador es en sí mismo quiral, los reactivos a menudo encajarán entre sí de una manera más fácil que otra, de manera que se prefiere la formación de un enantiómero.
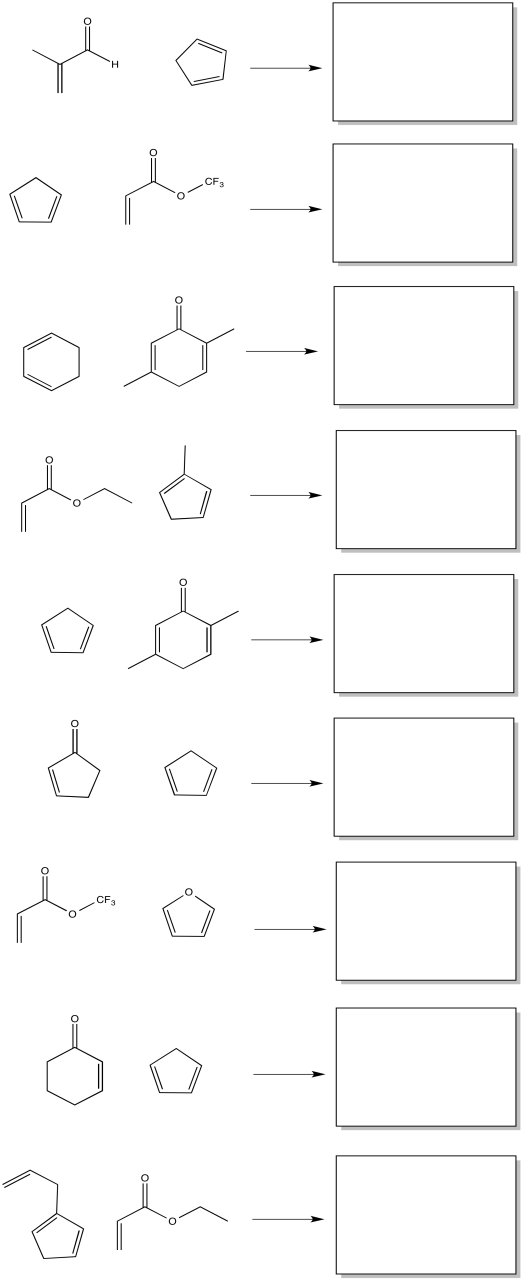
Mostrar los productos de las siguientes reacciones, incluyendo la estereoquímica preferida.