22.10: Agentes Quelantes
- Page ID
- 76141
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Aunque hasta ahora hemos limitado nuestra discusión a ligandos simples como Cl —, NH 3 o H 2 O, moléculas mucho más grandes y complicadas también pueden donar pares de electrones a iones metálicos. Un ejemplo importante e interesante de esto son los agentes quelantes, ligandos que son capaces de formar dos o más enlaces covalentes coordinados con un ion metálico. Uno de los más comunes es el 1,2-diaminoetano (generalmente llamado etilendiamina y abreviado en.)
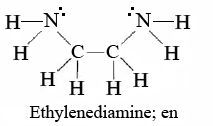
Cuando ambos nitrógenos se coordinan con un ion metálico, se forma un anillo estable de cinco miembros. La palabra quelante, derivada del griego chele, “garra”, describe la forma en forma de pinza en la que tal ligando puede agarrar un ion metálico.
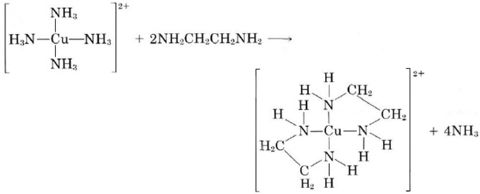
Un agente quelante que forma varios enlaces a un metal sin forzar indebidamente su propia estructura suele ser capaz de reemplazar un ligando similar más simple. Por ejemplo, aunque ambos forman enlaces covalentes coordinados a través de grupos, la etilendiamina puede reemplazar fácilmente el amoníaco de la mayoría de los complejos:
grupos, la etilendiamina puede reemplazar fácilmente el amoníaco de la mayoría de los complejos:
Para los metales que presentan un número de coordinación de 6, un ligando especialmente potente es e etileno d iamineta t ra a ion cetato (abreviado EDTA):
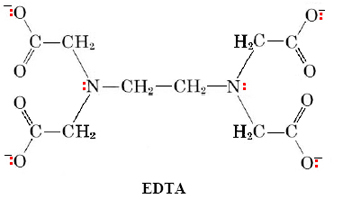
Los seis pares de electrones marcados en color son capaces de coordinarse con un ion metálico, en cuyo caso el ion EDTA se envuelve completamente alrededor del metal y es muy difícil de desalojar. El EDTA se usa para tratar la intoxicación por plomo y mercurio debido a su capacidad para quelar estos metales y ayudar a su eliminación del cuerpo.
Los complejos de quelatos suelen ser importantes en los sistemas vivos. La coordinación del hierro en proteínas como la mioglobina o la hemoglobina involucra cuatro nitrógeno del grupo hemo y uno de una cadena lateral de histidina. Dado que el hierro normalmente tiene un número de coordinación de 6, esto deja un sitio abierto, al que se puede unir el oxígeno. La presencia de monóxido de carbono, un ligando más fuerte que el oxígeno, provoca el desplazamiento del oxígeno de la hemoglobina. Esto evita el transporte de oxígeno de los pulmones al cerebro, causando somnolencia, pérdida de conciencia e incluso la muerte tras una larga exposición al monóxido de carbono. En consecuencia, operar un automóvil en un garaje cerrado, una estufa en una tienda de campaña o quemar cualquier combustible fósil de manera incompleta en un espacio cerrado puede ser peligroso para la salud.
Otra aplicación importante de los quelatos es el transporte de iones metálicos a través de las membranas. El interior de una membrana biológica contiene las colas hidrofóbicas no polares de moléculas lipídicas. Esto hace bastante difícil que especies iónicas como K + y Na + viajen de un lado de una membrana al otro. Una forma en la que se puede eludir esta barrera es mediante moléculas portadoras, llamadas ionóforos. Los ionóforos son capaces de quelar un ion, pero también tienen un exterior hidrófobo.
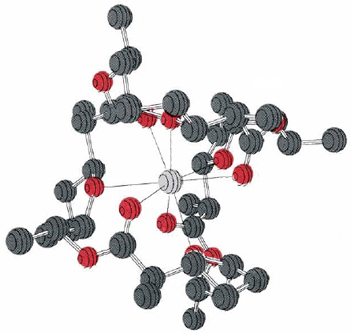
Uno de esos ionóforos es el antibiótico nonactina, una molécula orgánica de tamaño mediano con la fórmula
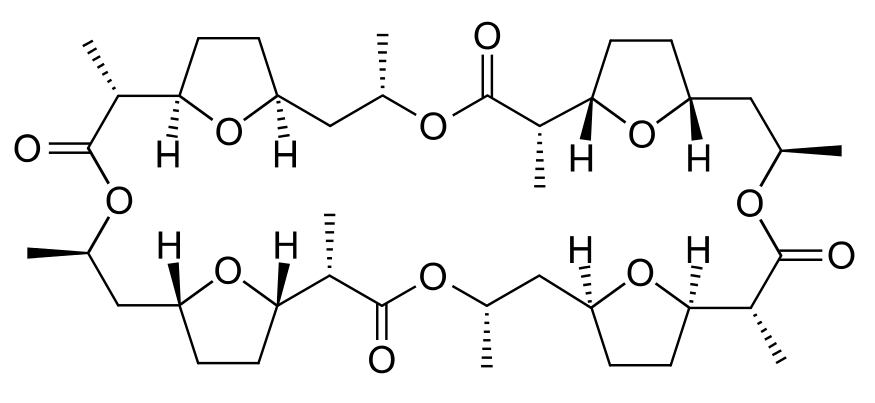
Esta molécula es capaz de transportar iones K + pero no iones Na +. Al parecer, el ion Na + es demasiado pequeño para encajar entre las ocho O coordinantes, mientras que el ion K + puede (Figura 1). Aparte de estas O, la mayor parte de la molécula de nonactina es una cadena hidrocarbonada. Por lo tanto, una vez que K + está quelatado, la parte externa del complejo es bastante hidrofóbica. Puede pasar fácilmente por el interior de una membrana, liberando K + en el otro lado. El efecto tóxico de la nonactina y varios antibióticos relacionados es el resultado de su capacidad para transportar iones de metales alcalinos a regiones de una célula donde no deberían estar. Esto descompone los gradientes de iones que la célula ha creado para realizar tareas y almacenar energía. En consecuencia, la célula desperdicia energía bombeando K + y otros iones nuevamente.