4.1: Introducción
- Page ID
- 77613
Y así, nada de lo que a nuestro mundo aparece,
Perece completamente, para la naturaleza siempre
Construye una cosa de la ruina de otra;
Sufriendo nada aún por nacer
Pero por la muerte de otro.
Lucrecio (95-55 a.C.)
Introducción
La pregunta principal que se hizo en el Capítulo 2 fue “Si un determinado conjunto de sustancias reaccionará para dar un producto deseado, ¿cuánto de cada sustancia se necesita?” Nuestros supuestos básicos eran que la materia no puede ser creada o destruida arbitrariamente, y que los átomos que entran en una reacción deben volver a salir como productos.
En este capítulo hacemos una segunda pregunta: “¿Se producirá una reacción, eventualmente?” ¿Hay una tendencia o un impulso para que se produzca una reacción dada, y si esperamos lo suficiente encontraremos que los reactivos se han convertido espontáneamente en productos? Esta pregunta lleva a las ideas de espontaneidad y de equilibrio químico. Una tercera pregunta: “¿Se producirá una reacción en un tiempo razonablemente corto?” involucra cinética química, la cual será discutida en el Capítulo 22. Por el momento, estaremos satisfechos si podemos predecir en qué dirección irá una reacción química por sí misma, ignorando el factor tiempo.
Reacciones espontáneas
Se dice que una reacción química que ocurrirá por sí sola, dado el tiempo suficiente, es espontánea. Al aire libre, y bajo las condiciones en el interior de un motor de automóvil, la combustión de la gasolina es espontánea:
C7H16 + 11 O2 → 7CO2 + 8 H2O
(La reacción es exotérmica o emisora de calor. El cambio de entalpía, que se definió en el Capítulo 2, es grande y negativo: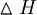 = -4812 k J mol -1 de heptano a 298 K. El calor emitido hace que los gases producto se expandan, y es la presión de estos gases en expansión la que impulsa el automóvil.) Por el contrario, la reacción inversa en las mismas condiciones no es espontánea:
= -4812 k J mol -1 de heptano a 298 K. El calor emitido hace que los gases producto se expandan, y es la presión de estos gases en expansión la que impulsa el automóvil.) Por el contrario, la reacción inversa en las mismas condiciones no es espontánea:
7CO2 + 8H2OC7H16 + 11 O2
Nadie plantea seriamente que la gasolina pueda obtenerse espontáneamente a partir de una mezcla de vapor de agua y dióxido de carbono.
Las explosiones son ejemplos de reacciones rápidas y espontáneas, pero una reacción no necesita ser tan rápida como una explosión para ser espontánea. Es importante entender claramente la diferencia entre rapidez y espontaneidad. Si mezcla oxígeno e hidrógeno gases a temperatura ambiente, permanecerán juntos sin reacción apreciable durante años. Sin embargo, la reacción para producir agua es genuinamente espontánea:
2H2 + O2 → 2H2O
Sabemos que esto es cierto porque podemos desencadenar la reacción con un fósforo, o catalizador de platino metálico finamente dividido.
La frase anterior sugiere por qué un químico está interesado en si una reacción es espontánea, es decir, si tiene una tendencia natural a ocurrir. Si una reacción química deseable es espontánea pero lenta, puede ser posible acelerar el proceso. Aumentar la temperatura a menudo hará el truco, o un catalizador puede funcionar. Discutiremos las funciones de un catalizador en detalle en el Capítulo 22. Pero en resumen, podemos decir ahora que un catalizador es una sustancia que ayuda a una reacción naturalmente espontánea a ir más rápido al proporcionar un camino más fácil para ello. La gasolina se quemará rápidamente en el aire a una temperatura suficientemente alta. El papel de una bujía en un motor de automóvil es proporcionar esta temperatura inicial. El calor producido por la reacción mantiene la alta temperatura necesaria para mantenerlo en marcha después. La gasolina se combinará con el oxígeno a temperatura ambiente si se utiliza el catalizador adecuado, ya que la reacción es naturalmente espontánea pero lenta. Pero ningún catalizador jamás hará que el dióxido de carbono y el agua se recombinen para producir gasolina y oxígeno a temperatura ambiente y presiones moderadas, y sería un químico tonto que pasara tiempo tratando de encontrar tal catalizador. En definitiva, una comprensión de las reacciones espontáneas y no espontáneas ayuda a un químico a ver los límites de lo que es posible. Si una reacción es posible pero actualmente no realizable, puede valer la pena buscar formas de llevarla a cabo. Si el proceso es inherentemente imposible, entonces es el momento de estudiar otra cosa.
Equilibrio y la Constante de Equilibrio
La velocidad con la que tiene lugar una reacción depende normalmente de la mayor cantidad de concentraciones de las sustancias reaccionantes. Esto es de sentido común, ya que la mayoría de las reacciones ocurren cuando las moléculas chocan, y cuantas más moléculas haya por unidad de volumen, más a menudo se producirán colisiones.
La fijación industrial del nitrógeno atmosférico es muy importante en la fabricación de fertilizantes agrícolas (y explosivos). Uno de los pasos en la fijación de nitrógeno, en presencia de un catalizador, es
N2 + O2 → 2NO (4-1)
Si esta reacción tuviera lugar por simple colisión de una molécula de N 2 y una molécula de O 2, entonces esperaríamos que la velocidad de colisión (y de ahí la velocidad de reacción) sea proporcional a las concentraciones de N 2 y O 2:
Rate of NO production![\textstyle\propto \!\, [N_2][O_2]](https://upload.wikimedia.org/math/e/c/c/ecc56b5fd446904b3808388f689e307b.png)
o
R1 = k1[N2][O2] (4-2)
La constante de proporcionalidad k 1 se denomina constante de velocidad de reacción directa, y los términos entre corchetes [N 2] [O 2] representan concentraciones en moles por litro. Esta constante de velocidad, que discutiremos con más detalle en el Capítulo 22, suele variar con la temperatura. La mayoría de las reacciones van más rápido a temperaturas más altas, por lo que k 1 es mayor a temperaturas mayores. Pero k 1 no depende de las concentraciones de gases de nitrógeno y oxígeno presentes. Toda la dependencia de la concentración de la velocidad general de reacción directa, R1, está contenida en los términos [N 2] y [O 2]. Si esta reacción comenzara rápidamente en un tanque sellado con altas concentraciones iniciales de ambos gases, entonces a medida que se consumieran más N 2 y O 2, la reacción hacia adelante se volvería progresivamente más lenta. La velocidad de reacción disminuiría debido a que la frecuencia de colisión de moléculas disminuiría a medida que quedaban menos moléculas de N 2 y O 2 en el tanque.
La reacción inversa también puede ocurrir. Si esta reacción se produjo por la colisión de dos moléculas de NO para hacer una molécula de cada gas de partida,
2NO → N2 + O2 (4-3)
entonces la velocidad de reacción nuevamente sería proporcional a la concentración de cada una de las moléculas colisionantes. Dado que estas moléculas son del mismo compuesto, NO, la tasa sería proporcional al cuadrado de la concentración de NO:
Rate of NO removal[NO][NO]
o
R2 = k2[NO]2 (4-4)
donde R2 es la velocidad de reacción inversa general y k 2 es la constante de velocidad de reacción rev~rse-reacción. Si hay poco NO presente cuando comienza el experimento, esta reacción ocurrirá a una velocidad insignificante. Pero a medida que más NO se acumule por la reacción hacia adelante, más rápido será descompuesto por la reacción inversa.
De esta manera a medida que disminuye la tasa de avance, R 1, aumenta la tasa inversa, R 2. Eventualmente se llegará al punto en el que las reacciones hacia adelante y hacia atrás equilibran exactamente (4-5):
-
-
R 1 = R 2 [N 2] [O 2] k 1 = k 2 [NO] 2
-
Esta es la condición de equilibrio. Si hubiera estado monitoreando las concentraciones de los tres gases, N 2 O 2, y NO, habría encontrado que la composición de la mezcla reaccionante había alcanzado un estado de equilibrio y posteriormente dejó de cambiar con el tiempo. Esto no quiere decir que las reacciones individuales se hubieran detenido, sólo que estaban procediendo a tasas iguales; es decir, habían llegado a, y posteriormente mantenido, una condición de equilibrio o equilibrio.

La condición de equilibrio se puede ilustrar imaginando dos grandes peceras, conectadas por un canal (Figura 4-1). Un tanque inicialmente contiene 10 peces de colores, y el otro contiene 10 guppies. Si ves a los peces nadando sin rumbo el tiempo suficiente, eventualmente encontrarás que aproximadamente 5 de cada tipo de peces están presentes en cada tanque. Cada pez tiene la misma posibilidad de enturbiarse a través del canal hacia el otro tanque. Pero mientras haya más peces de colores en el tanque izquierdo (Figura 4-la), hay una mayor probabilidad de que un pez dorado nade de izquierda a derecha que al revés. De igual manera, siempre y cuando el número de guppies en el tanque derecho supere al de la izquierda, habrá un flujo neto de guppies hacia la izquierda, aunque no haya nada en el tanque izquierdo para hacer que los guppies lo prefieran. Así, la velocidad de flujo de guppies es proporcional a la concentración de guppies presentes. Se puede hacer una declaración similar para el pez dorado.
En equilibrio (Figura 4-1b), en promedio habrá 5 guppies y 5 peces de colores en cada tanque. Pero no siempre serán los mismos 5 de cada pez. Si 1 guppy vaga desde el tanque izquierdo hacia la derecha, entonces él o un guppy diferente puede vagar hacia atrás un poco más tarde. Así en equilibrio encontramos que los peces no han dejado de nadar, sólo que a lo largo de un periodo de tiempo el número total de guppies y peces de colores en cada tanque se mantiene constante. Si llenáramos cada tanque con 9 peces de colores y luego lanzáramos 1 guppy, veríamos que, en su natación sin rumbo, pasaría la mitad de su tiempo en una cuba y la mitad en la otra (Figura 4-1 c).
En la reacción de NO que consideramos, habrá una concentración constante de moléculas de NO en equilibrio, pero no siempre serán las mismas moléculas de NO. Las moléculas individuales de NO reaccionarán para volver a formar N 2 y O 2, y otras moléculas reaccionantes producirán más NO. Al igual que con los peces de colores, solo sobre una base de recuento de cabezas o concentración han cesado los cambios en el equilibrio.
La condición de equilibrio para la reacción productora de NO, ecuación 4-1, se puede reescribir de una forma más útil:
(4-6)
en el que la relación de constantes de velocidad directa e inversa se expresa como una constante simple, la constante de equilibrio, K eq. Esta constante de equilibrio variará a medida que varíe la temperatura, pero es independiente de las concentraciones de los reactivos y productos. Nos dice la relación de productos a reactivos en equilibrio, y es una cantidad extremadamente útil para determinar si una reacción deseada tendrá lugar espontáneamente.
Forma General de la Constante de Equilibrio
Derivamos la expresión constante de equilibrio para la reacción de NO asumiendo que conocíamos la forma en que los pasos hacia adelante y hacia atrás ocurrieron a nivel molecular. Si la reacción de NO procediera por simple colisión de dos moléculas, la derivación sería perfectamente correcta. El mecanismo real de esta reacción es más complicado. Pero es importante, y afortunado para los químicos, que no tengamos que conocer el mecanismo de reacción para escribir la constante de equilibrio adecuada. La expresión constante de equilibrio siempre se puede escribir a partir de la ecuación química balanceada, sin otra información, incluso cuando las expresiones de velocidad hacia adelante e inversa son más complicadas de lo que sugeriría la ecuación equilibrada. (Esto lo demostraremos en el Capítulo 16.) En nuestro ejemplo NO, la reacción hacia adelante en realidad tiene lugar por una serie de complicados pasos en cadena. La reacción inversa tiene lugar por un conjunto complementario de reacciones, de manera que estas complicaciones se cancelan entre sí en la relación final de concentraciones que nos da la constante de equilibrio. Los detalles del mecanismo son “invisibles” para la expresión constante de equilibrio e irrelevantes para los cálculos de equilibrio.
Una reacción química general se puede escribir como
aA + bBcC + dD (4-7)
En esta expresión, A y B representan los reactivos; C y D, los productos. Las letras a, b, c y d representan el número de moles de cada sustancia involucrada en la reacción equilibrada, y las flechas dobles indican un estado de equilibrio. Aunque solo se muestran dos reactivos y dos productos en la reacción general, el principio es extensible a cualquier número. La expresión correcta de equilibrio constante para esta reacción es
(4-8)
Es la relación entre las concentraciones de producto y las concentraciones de reactivos, con cada término de concentración elevado a una potencia dada por el número de moles de esa sustancia que aparecen en la ecuación química equilibrada. Debido a que se basa en las cantidades de reactivos y productos presentes en equilibrio, la ecuación 4-8 se llama la ley de acción de masas.
|
Dar la expresión constante de equilibrio para la reacción
|
|
Solución La constante de equilibrio viene dada por |
Dado que las cuatro sustancias tienen un coeficiente de 1 en la ecuación equilibrada, sus concentraciones se elevan a la primera potencia en la expresión constante de equilibrio.
|
¿Cuál es la expresión constante de equilibrio para la formación de agua a partir de gases de hidrógeno y oxígeno? La reacción es
|
|
Solución |
Dado que dos moles de hidrógeno y agua están involucrados en la ecuación química, sus concentraciones son cuadradas en la expresión de K eq.
|
Dar la expresión constante de equilibrio para la disociación (ruptura) del agua en hidrógeno y oxígeno. La reacción es
|
|
Solución |
Aquí surge un importante punto general. Esta reacción es la inversa de la del Ejemplo 2, y la expresión constante de equilibrio es la inversa, o recíproca, de la anterior. Si se invierte una reacción química equilibrada, entonces se debe invertir la expresión constante de equilibrio, ya que lo que antes fueron reactivos ahora son productos, y viceversa.
|
La disociación del agua puede escribirse tan correctamente como
¿Cuál es entonces la expresión constante de equilibrio? |
|
Solución |
Observe que cuando la reacción del Ejemplo 3 se divide por 2, dando como resultado la reacción del Ejemplo 4, la constante de equilibrio es la raíz cuadrada del valor antiguo, o la antigua K eq a la media potencia. De igual manera, si la reacción se duplica, la K eq debe ser cuadrada. En general, es perfectamente apropiado multiplicar todos los coeficientes de una reacción química equilibrada por cualquier número positivo o negativo, n, y la ecuación permanecerá equilibrada. (Multiplicar todos los coeficientes de una ecuación por -1 es formalmente lo mismo que escribir la ecuación a la inversa. Escribe una ecuación simple y demuéstrate a ti mismo que esto es así.) Pero si todos los coeficientes de una ecuación se multiplican por n, entonces la nueva expresión constante de equilibrio es la antigua elevada a la enésima potencia. De ahí que al trabajar con constantes de equilibrio, se deben tener claramente en cuenta las reacciones químicas correspondientes.
|
La reacción para la formación o la descomposición del amoníaco se puede escribir de varias maneras:
(Cada una de estas expresiones podría ser apropiada, dependiendo de si se estaba enfocando en el nitrógeno, el amoníaco, el hidrógeno o la disociación del amoníaco). ¿Cuáles son las expresiones de equilibrio constante para cada formulación y cómo se relacionan las constantes de equilibrio? |
|
Solución
|
Observe que no hay nada malo con los poderes fraccionarios en la expresión de equilibrio constante.
Uso de constantes de equilibrio
Las constantes de equilibrio tienen dos propósitos principales:
-
- 1. Para ayudarnos a decir si una reacción será espontánea en determinadas condiciones.
- 2. Para permitirnos calcular la concentración de reactivos y productos que estarán presentes una vez alcanzado el equilibrio.
Podemos ilustrar cómo se pueden utilizar las constantes de equilibrio para lograr estos fines, y también el hecho de que una constante de equilibrio es efectivamente constante, con datos reales de una de las reacciones más estudiadas de todas, la entre hidrógeno y yodo para producir yoduro de hidrógeno:
H2(g) + I2(g)2HI(g) (4-9)

Si mezclamos hidrógeno y yodo en un matraz sellado y observamos la reacción, el desvanecimiento gradual del color púrpura del vapor de yodo nos dice que se está consumiendo yodo. Esta reacción fue estudiada primero por el químico alemán Max Bodenstein en 1893. El Cuadro 4-1 contiene los datos de los experimentos de Bodenstein. Los datos experimentales se encuentran en las tres primeras columnas. En la cuarta columna, hemos calculado la relación simple de concentraciones de producto y reactivo, [HI]/[H 2] [I 2], para ver si es constante. Claramente no lo es, pues a medida que disminuye la concentración de hidrógeno y se incrementa la concentración de yodo, esta relación varía de 2.60 a menos de 1. La ley de acción masiva (Sección 4-3) dicta que la expresión constante de equilibrio debe contener el cuadrado de la concentración de HI, ya que la reacción involucra 2 moles de HI por cada mol de H 2 e I 2, La quinta columna muestra que la relación [HI] 2/[H 2] [I2] es constante dentro de una desviación media de aproximadamente 3%. * Por lo tanto, esta relación es la expresión adecuada de equilibrio constante, y el valor promedio de K eq para estas seis series es 50.53.
La constante de equilibrio se puede utilizar para determinar si una reacción en condiciones especificadas irá espontáneamente en la dirección hacia adelante o hacia atrás. La relación de concentración de producto a concentración de reactivo, idéntica a la constante de equilibrio en forma pero no necesariamente en condiciones de equilibrio, se denomina cociente de reacción, Q:
Q =(not necessarily at equilibrium) (4-10)
Si hay demasiadas moléculas reaccionantes presentes para que exista el equilibrio, entonces los términos de concentración en el denominador harán que el cociente de reacción, Q, sea menor que K eq. La reacción avanzará espontáneamente para hacer más producto. Sin embargo, si se establece un experimento de manera que el cociente de reacción sea mayor que K eq, entonces hay demasiadas moléculas de producto presentes para el equilibrio y la reacción inversa procederá espontáneamente. Por lo tanto, una comparación de la relación de concentración real o cociente de reacción con la constante de equilibrio nos permite predecir en qué dirección irá una reacción espontáneamente bajo el conjunto de circunstancias dadas:
Q < Keq (forward reaction spontaneous)
Q > Keq (reverse reaction spontaneous) (4-11)
Q = Keq (reactants and products at equilibrium)
- Estos son los números originales de Bodenstein. Los datos modernos pueden ser mucho más precisos, con
menos desviación en K eq. La desviación media es el promedio de las desviaciones de K eq calculado individual a partir del promedio K eq.
| Si se colocan 1.0 X 10 -2 moles cada uno de los gases de hidrógeno y yodo en un matraz de I litro a 448°C con 2.0 X 10-3 moles de HI, ¿se producirán más HI? |
|
Solución El cociente de reacción en estas condiciones es
Esto es menor que el valor de equilibrio de 50.53 en la Tabla 4-1, lo que nos dice que los reactivos en exceso están presentes. De ahí que no se alcanzará el equilibrio hasta que se haya formado más HI. |
| Si solo se hubiera usado 1.0 X 10 -3 moles cada uno de H 2 e I 2, junto con 2.0 X 10 -3 mol de HI, ¿se habría producido más HI espontáneamente? |
|
Solución Se puede verificar que el cociente de reacción es Q = 4.0. Debido a que esto es menor que K eq, la reacción directa sigue siendo espontánea. |
| Si se cambian las condiciones del Ejemplo 7 para que la concentración de HI se incremente a 2.0 X 10 -2 mol litro -1, ¿qué sucede con la reacción? |
|
Solución El cociente de reacción ahora es Q = 400. Esto es mayor que Keq- Ahora hay demasiadas moléculas de producto y muy pocas moléculas reaccionantes para que exista el equilibrio. Así, la reacción inversa ocurre más rápidamente que la reacción directa. El equilibrio se alcanza únicamente convirtiendo parte del HI en H2 y 12, por lo que la reacción inversa es espontánea. |
| Si se cambian las condiciones del Ejemplo 7 para que la concentración de HI sea 7.1 X 10 -3 mol litro -1, ¿en qué dirección es espontánea la reacción? |
|
Solución En estas condiciones,
Dado que Q es igual a K eq dentro de los límites de precisión de los datos, el sistema como se describe está en equilibrio, y ni la reacción hacia adelante ni la reacción hacia atrás son espontáneas. (Ambas reacciones siguen teniendo lugar a nivel molecular, claro, pero están equilibradas por lo que sus efectos netos se cancelan). |
El segundo uso para las constantes de equilibrio es calcular las concentraciones de reactivos y productos que estarán presentes en el equilibrio.
| Si un matraz de 1 litro contiene 1.0 X 10 -3 moles cada uno de H 2 e I 2 a 448°C, ¿qué cantidad de HI está presente cuando la mezcla de gases está en equilibrio? |
|
Solución La expresión de K eq se trata como una ecuación algebraica ordinaria y se resuelve para la concentración de HI:
Se puede verificar que en el Ejemplo 7 la concentración de HI fue menor que este valor de equilibrio; en el Ejemplo 8 fue mayor; y en el Ejemplo 9 fue solo este valor. |
| Una décima parte de mol, 0.10 moles, de yoduro de hidrógeno se coloca en un matraz de 5.0 litros vacío a 448°C. Cuando el contenido haya llegado al equilibrio, ¿cuánto hidrógeno y yodo habrá en el matraz? | ||||||||||||
|
Solución A partir de la estequiometría de la reacción, las concentraciones de H 2 y I 2 deben ser las mismas. Por cada mol de H 2 e I 2 formados, deben descomponerse 2 moles de HI. Dejar y igualar el número de moles de H 2 o I 2 por litro presentes en equilibrio. La concentración inicial de HI antes de que se haya producido cualquier disociación es
Comience escribiendo una ecuación equilibrada para la reacción, luego haga una tabla de concentraciones al inicio y al equilibrio:
La concentración de HI de 0.020 mol litro -1 se ha disminuido en 2 y por cada y moles de H 2 y I 2 que se forman. La expresión constante de equilibrio es
Inmediatamente vemos que podemos tomar un atajo tomando la raíz cuadrada de ambos lados:
Para 5 litros, 5
|
En muchos casos se debe resolver una ecuación cuadrática.
| Si 0.00500 moles de gas hidrógeno y 0.0100 moles de gas yodo se colocan en un tanque de 5.00 litros a 448°C, ¿cuánto HI estará presente en equilibrio? | |||||||||||||||||||||||||||
|
Solución Las concentraciones iniciales de H 2 e I 2 son
Esta vez, deja que la variable desconocida y sean los moles por litro de H 2 o I 2 que han reaccionado en equilibrio:
La expresión de quilibrium es
El atajo de raíz cuadrada es ahora imposible porque las concentraciones iniciales de H 2 e I 2 son desiguales. En cambio, debemos reducir la ecuación a una expresión cuadrática:
Una ecuación cuadrática general de la forma ay 2 + por + c = 0 se puede resolver por la fórmula cuadrática,
Así para este problema
La primera solución es físicamente imposible ya que muestra más H 2 reaccionando de lo que estaba originalmente presente. La segunda solución es la respuesta correcta: y =0.935
|
Unidades y Constantes de Equilibrio
Como hemos visto, los corchetes alrededor de un símbolo químico, como en [N 2], representan concentraciones, generalmente pero no exclusivamente en unidades de moles litro -1. A las concentraciones expresadas como moles litro -1 se les suele dar el símbolo especial c, ya que en c N 2, las concentraciones medidas en estas unidades se denota con K c.
Una constante de equilibrio como la hemos definido hasta ahora puede tener unidades. En el Ejemplo 1, K eq es sin unidad ya que los moles 2 1iter -2 del numerador y denominador cancelan. En el Ejemplo 2, las unidades de K eq son moles -1 litro ya que la concentración se produce a la segunda potencia en el numerador y a la tercera potencia en el denominador. En el Ejemplo 3 las unidades de K eq son las inversas: moles litro -1. Las unidades que demanda el Ejemplo 4, moles 1/2 litro -1/2, pueden parecer extrañas pero son perfectamente respetables.
| ¿Cuáles son las unidades para las constantes de equilibrio en las cuatro reacciones del Ejemplo 5? | ||||||||||||||||||||
|
Solución La expresión de K eq se trata como una ecuación algebraica ordinaria y se resuelve para la concentración de HI:
|
|
Un paso en la síntesis comercial de ácido sulfúrico es la reacción del dióxido de azufre y el oxígeno para hacer trióxido de azufre:
A 1000 K, la constante de equilibrio para esta reacción es K p = 3.50 atm -1. Si la presión total en la cámara de reacción es de 1.00 atm y la presión parcial de 0 2 sin usar en equilibrio es de 0.10 atm, ¿cuál es la relación de concentraciones de producto (S0 3) a reactivo (S0 2)? |
|
Solución
La mezcla de equilibrio tiene 0.59 moles de S0 3 por cada 1 mol de S0 2. |
La ley de gas ideal nos permite convertir entre atmósferas y moles litro -1, y entre K p y K c:
PV = nRT (3-8)
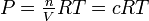 (4-12)
(4-12)
En la reacción química general escrita anteriormente,
aA + bBcC + dD (4-7)
Δn (read "delta n"), the increase in number of moles of gas during the reaction, is
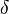 n = c + d - a - b (4-13)
n = c + d - a - b (4-13)
La expresión constante de equilibrio en términos de presiones parciales es
(4-14)
Con la ley de gas ideal aplicada a cada componente de gas, podemos convertir esta expresión a K c:
(RT)Δn = Kc(RT)Δn (4-15)
(No confundir los dos usos del símbolo c en la ecuación 4-15: uno es para concentración en moles litro -1 y el otro para el número de moles de sustancia C.)
| ¿Cuál es el valor numérico de K c para la reacción del Ejemplo 14? |
|
Solución Tres moles de gases reactivos se convierten en solo 2 moles de producto, por lo que Δn = - 1. De ahí que a 1000 K,
|
Si bien las respuestas numéricas que resultan cuando se utilizan diferentes unidades pueden diferir, la realidad física debe ser la misma.
| ¿Cuál es la concentración de oxígeno en el Ejemplo 14, en moles litro -1? Resuelve el Ejemplo 14 nuevamente usando K c del Ejemplo 15. |
|
Solución Tres moles de gases reactivos se convierten en solo 2 moles de producto, por lo que Δn = - 1. De ahí que a 1000 K,
Esta es la misma ración de SO_3 a SO_4 que se obtuvo cuando se utilizaron atmósferas. La elección es de conveniencia. |
Equilibrio que involucra gases con líquidos o sólidos

Todos los ejemplos considerados hasta ahora han implicado un solo estado físico, un gas, y son ejemplos de equilibrios homogéneos. Los equilibrios que involucran dos o más estados físicos (como un gas con un líquido o un sólido) se denominan equilibrios heterógenos. Si uno o más de los reactivos o productos son sólidos o líquidos, ¿cómo afecta esto a la forma de la constante de equilibrio?
La respuesta, en definitiva, es que cualquier sólido o líquido puro que pueda estar presente en equilibrio tiene el mismo efecto sobre el equilibrio sin importar cuánto sólido o líquido esté presente. La concentración de un sólido o líquido puro puede considerarse constante, y por conveniencia todos esos términos constantes se llevan al lado izquierdo de la ecuación y se incorporan a la propia constante de equilibrio. Como ejemplo, la piedra caliza (carbonato de calcio, CaCo 3), se descompone en cal viva (óxido de calcio, CaO) y dióxido de carbono, CO 2:
-
- CaCo 3
 CaO (s) + CO 2 (g)
CaO (s) + CO 2 (g)
- CaCo 3
La expresión simple de equilibrio constante es
-
- K' eq =
![\ textstyle\ frac {[CaO (s)] [CO_2 (g)]} {[CACO_3 (s)]}](https://upload.wikimedia.org/math/1/d/9/1d9983f0ee9f4c65fa2bbf91a455e0e9.png)
- K' eq =
Mientras cualquier piedra caliza sólida y cal viva estén en contacto con el gas, su efecto sobre el equilibrio es invariable. De ahí que los términos [CaCo 3] y [CaO] permanezcan constantes y puedan fusionarse con K' eq:
-
- K eq = K' eq
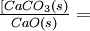 [CO 2 (g)]
[CO 2 (g)]
- K eq = K' eq
Esta forma de la expresión constante de equilibrio nos dice que, a una temperatura dada, la concentración de gas dióxido de carbono por encima de la piedra caliza y el óxido de calcio es una cantidad fija. (esto es cierto sólo mientras ambas formas sólidas estén presentes.) Midiendo la concentración en unidades de atmósferas, obtenemos
-
- K p = p CO 2
con el valor experimental 0.236 atm a 800°C.
Podemos ver lo que esto significa experimentalmente al considerar un cilindro al que se le han agregado CaCo, y CaO. El cilindro tiene un pistón móvil, como se muestra en la Figura 4-2. Si el pistón está fijo en una posición, entonces CaCo 3 se descompondrá hasta que la presión de CO 2 por encima de los sólidos sea de 0.236 atm (si la temperatura es de 800°C). Si intenta disminuir la presión elevando el pistón, entonces más CaCo 3 se descompondrá hasta que la presión vuelva a subir a 0.236 atm. Por el contrario, si intenta aumentar la presión bajando el pistón, parte del gas CO 2 reaccionará con CaO y se convertirá en CaO 3 disminuyendo la cantidad de gas CO 2 presente hasta que la presión una vez más sea de 0.236 atm. La única manera de aumentar el p CO 2, es elevar la temperatura, lo que aumenta el valor de K p en sí a 1 atm a 894°C y a 1.04 atm a 900°C.
Un ejemplo aún más sencillo es la vaporización de un líquido como el agua:
-
- H 2 O (l)
 H 2 O (g)
H 2 O (g)
- H 2 O (l)
Este proceso puede tratarse como una reacción química en un sentido formal a pesar de que los enlaces dentro de las moléculas no se hacen ni se rompen. Imagínese que el cilindro que se muestra en la Figura 4-2 está medio lleno de agua en lugar de con CaCo 3 y CaO, y que el pistón es llevado inicialmente a la superficie del agua. A medida que se eleva el pistón, el líquido se evaporará hasta que la presión del vapor de agua sea un valor constante que depende únicamente de la temperatura. Esta es la presión de vapor de equilibrio del agua a esa temperatura. A 25°C, la presión de vapor del agua es de 0.0313 atm. A 100°C, la presión de vapor alcanza 1 atm y, como veremos en el Capítulo 18, esta es solo la definición del punto de ebullición normal del agua. La presión del vapor de agua por encima del líquido en el cilindro no depende de si el agua en el cilindro es de 1 cm o 10 cm de profundidad; el único requisito es que algo de agua esté presente y sea capaz de evaporarse para suplir cualquier disminución en la presión de vapor. Sólo cuando el pistón se eleva hasta el punto en que no existe más líquido puede la presión del vapor de agua caer por debajo de 0.0313 atm, si el cilindro está a 25°C.De igual manera, si el pistón se baja, parte del vapor se condensa, manteniendo la presión en 0.0313 atm. Solo cuando todo el vapor se haya condensado y el pistón esté descansando sobre la superficie del líquido se puede elevar la presión dentro del cilindro por encima de 0.0313 atm.
El tratamiento formal de equilibrio de la evaporación del agua sería
-
- K' eq =
![\ textstyle\ frac {[H_2O (g)]} {[H_2O (l)]}](https://upload.wikimedia.org/math/1/c/0/1c01d498a08bee5cc2f0b20feb722c95.png)
- K' eq =
- [H 2 O (l)] = constante, siempre y cuando esté presente líquido
-
- K eq = K' eq [H 2 O (l)] = [H 2 O (g)]
En unidades de presión, la expresión sería
-
- K p = p H 2 O (g)
Desde un punto de vista práctico, lo que significa la discusión anterior es que los términos de concentración para sólidos y líquidos puros simplemente se eliminan de la expresión constante de equilibrio. (Están presentes, implícitamente, en la K eq.)
| Si la reacción del yoduro de hidrógeno previamente discutida en este capítulo se lleva a cabo a temperatura ambiente, entonces el yodo está presente como cristales de color púrpura profundo más que como vapor. ¿Cuál es entonces la forma de la expresión constante de equilibrio, y el equilibrio depende de la cantidad de cristales de yodo presentes? |
|
Solución La reacción es
y la expresión de equilibrio constante es:
Mientras estén presentes algunos cristales de I 2 (s), la cantidad es inmaterial en lo que respecta al equilibrio. |
|
El óxido de estaño (IV) reacciona con el monóxido de carbono para formar estaño metálico y CO 2 mediante la reacción
¿Cuál es la expresión de equilibrio constante? |
|
Solución
|
|
¿Cuál es la expresión constante de equilibrio para la siguiente reacción que conduce al agua líquida?
¿Cuál sería la expresión si el producto fuera vapor de agua? |
|
Solución Si el producto es H 2 O (l), la expresión constante de equilibrio es
Si el producto es H 2 O (g), la expresión constante de equilibrio es
|
El ejemplo anterior muestra que mientras esté presente agua líquida, la concentración en fase gaseosa se fija a la presión de vapor del agua a esa temperatura. De ahí que la contribución del agua, siendo constante, pueda agruparse en K eq.
Factores que afectan al equilibrio: el principio de Le Chatelier
El equilibrio representa un equilibrio entre dos reacciones opuestas. ¿Qué tan sensible es este equilibrio a los cambios en las condiciones de una reacción? ¿Qué se puede hacer para cambiar el estado de equilibrio? Estas son preguntas muy prácticas si, por ejemplo, se está tratando de incrementar el rendimiento de un producto útil en una reacción.
Bajo condiciones específicas, la expresión constante de equilibrio nos indica la relación de producto a reactivos cuando las reacciones hacia adelante y hacia atrás están en equilibrio. Esta constante de equilibrio no se ve afectada por cambios en la concentración de reactivos o productos. Sin embargo, si los productos se pueden retirar continuamente, entonces el sistema de reacción se puede mantener constantemente desequilibrado o corto del equilibrio. Se utilizarán más reactivos y se formará una corriente continua de nuevos productos. Este método es útil cuando un producto de la reacción puede escapar como gas, condensarse o congelarse fuera de una fase gaseosa como líquido o sólido, ser lavado de la mezcla de gases mediante una pulverización de un líquido en el que es especialmente soluble, o precipitarse de un gas o solución.
Por ejemplo, cuando la cal sólida (CaO) y el coque (C) se calientan en un horno eléctrico para hacer carburo de calcio (CaC 2),
-
- CaO (s) + 3C (s)
 CaC 2 (s) + CO (g) ↑
CaC 2 (s) + CO (g) ↑
- CaO (s) + 3C (s)
la reacción, que a 2000-3000°C tiene una constante de equilibrio cercana a 1.00, se inclina hacia la formación de carburo de calcio mediante la eliminación continua de gas monóxido de carbono. En la fabricación industrial de dióxido de titanio para pigmentos, TiCl 4 y O 2 reaccionan como gases:
-
- TiCl 4 (g) + O 2 (g)
 TiO 2 (s) ↓ + 2Cl 2 (g)
TiO 2 (s) ↓ + 2Cl 2 (g)
- TiCl 4 (g) + O 2 (g)
El producto se separa de los gases de reacción como un polvo fino de Ti0 2 sólido, y la reacción se mantiene así en movimiento en la dirección hacia adelante. Cuando el acetato de etilo u otros ésteres utilizados como disolventes y aromatizantes se sintetizan a partir de ácidos carboxílicos y alcoholes,
-
- CH 2 COOH + HOCH 2 CH 3
 CH 3 COOCH 2 CH 3 + H 2 O
CH 3 COOCH 2 CH 3 + H 2 O - ácido acético etanol acetato de etilo
- CH 2 COOH + HOCH 2 CH 3
la reacción se mantiene constantemente desequilibrada al eliminar el agua tan rápido como se forma. Esto se puede hacer usando un agente secante como Drierite (CaS0 4), ejecutando la reacción en benceno y hirviendo una mezcla de benceno-agua de ebullición constante, o ejecutando la reacción en un disolvente en el que el agua sea completamente inmiscible y se separe como gotitas en una segunda fase. Un ejemplo final: Dado que el amoníaco es mucho más soluble en agua que el hidrógeno o el nitrógeno, el rendimiento de amoníaco en la reacción
-
- N 2 (g) + 3H 2 (g)
 2NH 3 (g)
2NH 3 (g)
- N 2 (g) + 3H 2 (g)
puede elevarse a más del 90% lavando el amoníaco de la mezcla de equilibrio de gases con una corriente de agua, y reciclando el nitrógeno y el hidrógeno.
Temperatura

Todos los métodos anteriores alterarán un equilibrio (en nuestros ejemplos, a favor de los productos deseados) sin alterar la constante de equilibrio. Un químico a menudo puede mejorar los rendimientos de los productos deseados aumentando la constante de equilibrio para que la relación de productos a reactivos en equilibrio sea mayor. La constante de equilibrio suele depender de la temperatura. En general, las reacciones tanto hacia adelante como hacia atrás se aceleran al aumentar la temperatura, debido a que las moléculas se mueven más rápido y chocan con más frecuencia. Si el incremento en la velocidad de la reacción directa es mayor que la de la inversa, entonces K eq. aumenta con la temperatura y se forman más productos en equilibrio. Si se favorece la reacción inversa, entonces K eq. disminuye. Así K eq para la reacción de hidrógeno-yodo a 448°C es 50.53, pero a 425°C es 54.4, y a 357°C aumenta a 66.9. La producción de HI se ve favorecida en cierta medida por un aumento de la temperatura, pero su disociación a hidrógeno y yodo se ve favorecida mucho más.
La reacción productora de yoduro de hidrógeno es exotérmica o emisora de calor:
-
- H 2 (g) + I 2 (g)
 2HI (g)
2HI (g) - Δ H 298 = -10.2 k J por 2 moles de HI
- H 2 (g) + I 2 (g)
(Si comprueba esta cifra con el Apéndice 3, recuerde que esta reacción involucra yodo gaseoso, no sólido). Si se baja la temperatura externa de esta reacción, el equilibrio se desplaza a favor de la reacción emisora de calor o hacia adelante; a la inversa, si se incrementa la temperatura, se favorece la reacción inversa, produciendo H 2 e I 2. El equilibrio se desplaza para contrarrestar en cierta medida el efecto de agregar calor externamente (elevar la temperatura) o eliminarlo (bajar la temperatura).
La dependencia de la temperatura del punto de equilibrio es un ejemplo de un principio más general, conocido como el principio de Le Chatelier: Si se aplica una tensión externa a un sistema en equilibrio químico, entonces el punto de equilibrio cambiará de tal manera que contrarresta los efectos de ese estrés. Si la mitad delantera de una reacción de equilibrio es exotérmica, entonces K eq disminuirá a medida que aumente la temperatura; si es endotérmica, K eq aumentará. Solo para una reacción de absorción de calor se puede mejorar el rendimiento de equilibrio de los productos aumentando la temperatura. Una buena manera de recordar esto es escribir la reacción explícitamente con un término de calor:
-
- H 2 (g) + I 2 (g)
 2HI (g) + calor (desprendido)
2HI (g) + calor (desprendido)
- H 2 (g) + I 2 (g)
Entonces queda claro que agregar calor, al igual que agregar HI, desplaza la reacción hacia la izquierda. (ver Figura 4-3.)
Presión
El principio de Le Chatelier es cierto para otros tipos de estrés, como los cambios de presión. La constante de equilibrio, K eq, no se ve alterada por un cambio de presión a temperatura constante. Sin embargo, las cantidades relativas de reactivos y productos cambiarán de una manera que se puede predecir a partir del principio de Le Chatelier.
La reacción de hidrógeno-yodo implica un número igual (2) de moles de reactivos y producto. Por lo tanto, si doblamos la presión a temperatura constante, el volumen de la mezcla de gases se dividirá a la mitad. Todas las concentraciones en moles litro -1 se duplicarán, pero su relación será la misma. En el Ejemplo 12, duplicar las concentraciones de los reactivos y el producto no cambia la constante de equilibrio:
-
- K eq =
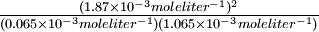
- =
 50.51
50.51
- K eq =
Así, el equilibrio hidrógeno-yodo no es sensible a los cambios de presión. Observe que en este caso K eq no tiene unidades, ya que las unidades de concentración en el numerador y denominador cancelan.
En contraste, la disociación del amoníaco se ve afectada por cambios en la presión debido a que el número de moles (2) de reactivo no equivale al número total de moles (4) de productos:
-
- 2NH 3 (g)
 N 2 (g) + 3H 2 (g)
N 2 (g) + 3H 2 (g)
- 2NH 3 (g)
La constante de equilibrio para esta reacción a 25°C es
-
- K eq =
![\ textstyle\ frac {[N_2] [H_2] ^3} {[NH_3] ^2} =](https://upload.wikimedia.org/math/4/e/2/4e2ff16db04c5a821a95e94d95ce0423.png) 2.5
2.5 10 -9 mol 2 litros -2
10 -9 mol 2 litros -2
- K eq =
Un conjunto de condiciones de equilibrio es
-
- N 2 = 3.28
 10 -3 mol litro -1
10 -3 mol litro -1 - H 2 = 2.05
 10 -3 mol litro -1
10 -3 mol litro -1 - NH 3 = 0.106 mol litro -1
- N 2 = 3.28
(¿Se puede verificar que estas concentraciones satisfacen la condición de equilibrio?) Si ahora duplicamos la presión a temperatura constante, reduciendo así a la mitad el volumen y duplicando cada concentración,
-
- N 2 = 6.56
 10 -3 mol litro -1
10 -3 mol litro -1 - H 2 = 4.10
 10 -3 mol litro -1
10 -3 mol litro -1 - NH 3 = 0.212 mol litro -1
- N 2 = 6.56
la relación de productos a reactivos, el cociente de reacción, ya no es igual a K eq:
-
- Q =
 1.0
1.0 10 -8 mol 2 litro -2
10 -8 mol 2 litro -2
- Q =

Dado que Q es mayor que K eq, hay demasiadas moléculas de producto presentes para el equilibrio. La reacción inversa se desarrollará espontáneamente, formando así más NH 3 y disminuyendo las cantidades de H 2 y N 2. En consecuencia, parte del aumento de presión se compensa cuando la reacción se desplaza en la dirección que disminuye el número total de moles de gas presentes. En general, una reacción que reduzca el número de moles de gas se verá favorecida por un aumento en la presión, y una que produzca más gas se verá desfavorecida. (Ver Figura 4-4.)
| Si la reacción de yoduro de hidrógeno se realizara a una temperatura a la que el yodo fuera sólido, ¿un aumento de presión desplazaría la reacción de equilibrio hacia más HI, o menos? ¿Cuál sería el efecto de la presión sobre K eq? |
|
Solución Dado que la reacción de 2 moles de HI gaseoso produce ahora 1 mol de H 2 gaseoso y 1 mol de sólido I 2, la tensión de aumento de presión se alivia disociando HI a H 2 e I 2. Sin embargo, K eq no cambiará por el aumento de presión. |

Catálisis
¿Qué efecto tiene un catalizador en una reacción en equilibrio? Ninguno. Un catalizador no puede cambiar el valor de K eq, pero puede aumentar la velocidad con la que se alcanza el equilibrio. Esta es la función principal de un catalizador. Puede llevar la reacción solo al mismo estado de equilibrio que eventualmente se alcanzaría sin el catalizador.
Sin embargo, los catalizadores son útiles. Muchas reacciones deseables, aunque espontáneas, ocurren a velocidades extremadamente lentas en condiciones ordinarias. En los motores de automóviles, la principal reacción productora de humo que involucra óxidos de nitrógeno es
-
- N 2 + O 2
 2NO
2NO
- N 2 + O 2
(Una vez que el NO está presente, reacciona fácilmente con más oxígeno para hacer marrón N0 2.) A la alta temperatura de un motor de automóvil, K eq para esta reacción es tan grande que se forman cantidades apreciables de NO. Sin embargo, a 25°C, K eq = 10 -30. (Utilizando solo los dos bits de información anteriores y el principio de Le Chatelier, predecir si la reacción tal como está escrita es endotérmica o exotérmica. Verifique su respuesta utilizando los datos del Apéndice 3.) La cantidad de NO presente en la atmósfera en equilibrio a 25°C debe ser insignificante. El NO debe descomponerse espontáneamente a N 2 y O 2 a medida que los gases de escape se enfrían. Pero cualquier sureño californiano puede verificar que esto no es lo que sucede. Tanto el NO como el N0 2 están efectivamente presentes, debido a que los gases de la atmósfera no están en equilibrio.
La velocidad de descomposición del NO es extremadamente lenta, aunque la reacción es espontánea. Una aproximación al problema del smog ha sido buscar un catalizador para la reacción
que podría estar alojado en un sistema de escape y podría descomponer el NO en los gases de escape a medida que se enfrían. Encontrar un catalizador es posible; un problema práctico surge del envenenamiento gradual del catalizador por aditivos de gasolina, como los compuestos de plomo. Esta es la razón por la que los autos nuevos con convertidores catalíticos solo usan gasolina sin plomo.
Una prueba de la afirmación de que un catalizador no puede cambiar la constante de equilibrio se ilustra en la Figura 4-5. Si un catalizador pudiera desplazar el punto de equilibrio de una mezcla gaseosa reaccionante y producir un cambio de volumen, entonces esta expansión y contracción podrían aprovecharse por medios mecánicos y hacerse funcionar. Tendríamos una verdadera máquina de movimiento perpetuo que entregaría energía sin una fuente de energía. Desde el sentido común y la experiencia sabemos que esto es imposible. Este “sentido común” se afirma científicamente como la primera ley de la termodinámica, que se discutirá en el Capítulo 15. Un matemático llamaría a esto una prueba por contradicción: Si asumimos que un catalizador puede alterar K eq, entonces debemos asumir la existencia de una máquina de movimiento perpetuo. Sin embargo, una máquina de movimiento perpetuo no puede existir; por lo tanto, nuestra suposición inicial era errónea, y debemos concluir que un catalizador no puede alterar K eq.
En resumen, K eq es una función de la temperatura, pero no es una función de las concentraciones de reactivo o producto, presión total, o la presencia o ausencia de catalizadores. Las cantidades relativas de sustancias en equilibrio se pueden cambiar aplicando una tensión externa a la mezcla de equilibrio de reactivos y productos, y el cambio es uno que aliviará este estrés. Esta última afirmación, el principio de Le Chatelier, nos permite predecir qué pasará con una reacción cuando se cambien factores externos, sin tener que hacer cálculos exactos.
Resumen
Una reacción espontánea es aquella que se llevará a cabo, dado el tiempo suficiente, sin asistencia externa. Algunas reacciones espontáneas son rápidas, pero el tiempo no es un elemento en la definición de espontaneidad. Una reacción puede ser casi infinitamente lenta y aún así ser espontánea.
La reacción neta que observamos es el resultado de la competencia entre pasos adelante y retroceso. Si el proceso hacia adelante es más rápido, entonces los productos se acumulan, y decimos que la reacción es espontánea en la dirección hacia adelante. Si el proceso inverso es más rápido, entonces los reactivos se acumulan, y decimos que la reacción inversa es la espontánea. Si tanto el proceso directo como el inverso tienen lugar a la misma velocidad, entonces no se observa ningún cambio neto en ninguno de los componentes de la reacción. Esta es la condición de equilibrio químico.
La relación de productos a reactivos, elevándose cada término de concentración a una potencia correspondiente al coeficiente de esa sustancia en la ecuación química equilibrada, se denomina constante de equilibrio, K eq. (Ver ecuación 4-8.) Se puede utilizar para predecir si una reacción dada bajo condiciones específicas será espontánea, y para calcular las concentraciones de reactivos y productos en equilibrio. El cociente de reacción, Q, tiene una forma que es idéntica a la de la constante de equilibrio, K eq, pero Q se aplica también en condiciones de no equilibrio. Para un conjunto dado de condiciones, si Q es menor que K eq, la reacción directa es espontánea; si Q es mayor que K eq, la reacción inversa es espontánea; y si Q = K eq, la el sistema está en equilibrio.
La constante de equilibrio se puede utilizar con cualquier conjunto conveniente de unidades de concentración: moles litro -1, presión en atmósferas, u otras. Su valor numérico dependerá de las unidades de concentración, por lo que se debe tener cuidado de igualar los valores adecuados de K eq y unidades a la hora de resolver problemas. Si las concentraciones de gas se expresan en moles litro -1, la constante de equilibrio se designa por K c; si en atmósferas, por K p. Así como la presión parcial del j ésimo componente de una mezcla de gases se relaciona con moles por litro por p j = c j RT, así K p y K c están relacionados por K p = K c (RT) Δn, en el que Δn es el cambio neto en el número de moles de gas durante la reacción.
Cuando algunos de los reactivos o productos son sólidos o líquidos puros, actúan como depósitos infinitos de material siempre que quede algún sólido o líquido. Su efecto sobre el equilibrio depende únicamente de su presencia, no de la cantidad de sólidos o líquidos presentes. Sus concentraciones efectivas son constantes, y pueden incorporarse en K eq. En la práctica, esto significa simplemente omitir términos de concentración para sólidos y líquidos puros de la expresión constante de equilibrio. La evaporación de un líquido puede tratarse formalmente como una reacción química con el líquido como reactivo y vapor como producto. Estas convenciones para escribir términos de concentración para un líquido nos permiten escribir la constante de equilibrio para evaporación como K p = p j donde p j es la presión de vapor de equilibrio de la sustancia j.
El principio de Le Chatelier establece que si se aplica tensión a un sistema en equilibrio, las cantidades de reactivos y productos se desplazarán de tal manera que se minimice la tensión. Esto significa que para una reacción de absorción de calor, o endotérmica, K eq aumenta a medida que aumenta la temperatura, ya que llevar a cabo más de la reacción es una forma de absorber parte del calor agregado. De manera similar, el enfriamiento aumenta K eq para una reacción emisora de calor o exotérmica. Aunque la constante de equilibrio K eq es independiente de la presión, y cambiar la presión total en un sistema de reacción no altera K eq directamente, un aumento en la presión hace que la reacción se desplace en la dirección que disminuye el número total de moles de gas presentes.
Un catalizador no tiene ningún efecto sobre K eq o las condiciones de equilibrio. Todo lo que un catalizador puede hacer es hacer que el sistema alcance el equilibrio más rápido de lo que hubiera hecho de otra manera. Los catalizadores pueden convertir reacciones inherentemente espontáneas pero lentas en reacciones rápidas, pero no pueden hacer que las reacciones no espontáneas tengan lugar por su propia cuenta.


![K_ {eq} =\ textstyle\ frac {[CO_2] [H_2]} {[CO] [H_2O]}](https://upload.wikimedia.org/math/8/1/c/81c99d309e6f1206b50dc7ff9aa92680.png)
![K_ {eq} =\ textstyle\ frac {[H_2O] ^2} {[H_2] ^2 [O_2]}](https://upload.wikimedia.org/math/2/4/6/246875e68142de3c40832911102d5100.png)
![K_ {eq} =\ textstyle\ frac {[H_2] ^2 [O_2]} {[H_2O] ^2}](https://upload.wikimedia.org/math/f/7/5/f75780e1d3dcee744860ec416c6344b3.png)
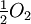
![K_ {eq} =\ textstyle\ frac {[H_2] [O_2] ^ {1/2}} {[H_2O]}](https://upload.wikimedia.org/math/0/9/7/0972b6b068e323e50342085c05a477e8.png)
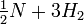
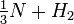
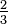 NH 3
NH 3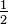 N 2 +
N 2 +
![K_ {a} =\ textstyle\ frac {[NH_3] ^2} {[N_2] [H_2] ^3}](https://upload.wikimedia.org/math/a/d/8/ad86d4564aac8b1cda9e05a3eefffcf0.png) c)
c)![K_ {c} =\ textstyle\ frac {[NH_3] ^ {2/3}} {[N_2] ^ {1/3} [H_2]}](https://upload.wikimedia.org/math/f/7/5/f757becfc6583f9321e4106bdfa8cd7b.png)
![K_ {b} =\ textstyle\ frac {[NH_3] ^2} {[N_2] ^ {1/2} [H_2] ^ {3/2}}](https://upload.wikimedia.org/math/a/8/a/a8a5314f8ca783f5849e6de01daf00b6.png) d)
d)![K_ {d} =\ textstyle\ frac {[N_2] ^ {1/2}} {[H_2] ^ {3/2} [NH_3]}](https://upload.wikimedia.org/math/a/6/6/a66109e186a5e0a05c3f21eeda4ff15a.png)

 = 0.040
= 0.040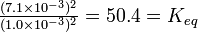
![\ textstyle\ frac {[HI] ^2} {(1.0\ times 10^ {-3}) ^2} = K_ {eq}](https://upload.wikimedia.org/math/8/7/2/8727ce0aa7b426542e2508e20e9b7476.png) = 50.53
= 50.53![[HI] ^2 = 50.53\ times 1.0\ times 10^ {-6}](https://upload.wikimedia.org/math/b/d/1/bd16b32b5b1f6c52889415d385aea896.png)
![\ textstyle [HI] = 7.1\ times 10^ {-3}\ textstyle mole litro^ {-1}](https://upload.wikimedia.org/math/2/c/a/2cab478a8df4ae5dc2ef8cf5352a461f.png)
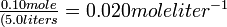

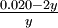
![\ textstyle\ frac {2y} {[HI] _0} =\ frac {0.0044} {0.020}](https://upload.wikimedia.org/math/1/2/c/12cf43f99b7d30ac9751410fed8007cd.png) = 0.22, o 22% de disociación
= 0.22, o 22% de disociación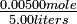 = 0.00100 mol litro -1
= 0.00100 mol litro -1 = 0.00200 mol litro -1
= 0.00200 mol litro -1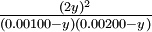

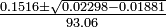
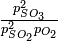 (p j = presión parcial de j)
(p j = presión parcial de j)
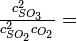 287 moles -1 litro
287 moles -1 litro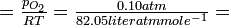 0.00122 mol litro -1
0.00122 mol litro -1
![\ textstyle\ frac {[HI] ^2} {[H_2]}](https://upload.wikimedia.org/math/f/d/f/fdfe56442332ce0e0fc27ca90b0ccd65.png)
![\ textstyle\ frac {[CO_2] ^2} {[CO] ^2}](https://upload.wikimedia.org/math/c/3/6/c360a1ad89af9307345447bc04268660.png)
![\ textstyle\ frac {[CO]} {[CO_2] [H_2]}](https://upload.wikimedia.org/math/0/8/b/08b72caa66c89fe78271a5944718837b.png)
![\ textstyle\ frac {[CO] [H_20]} {[CO_2] [H_2]}](https://upload.wikimedia.org/math/4/d/3/4d33a02b44cfc295a0b768043e40b8e0.png)