6.1: Introducción
- Page ID
- 77081
La hipótesis atómica proporciona una
forma conveniente de hablar, que
describe con éxito muchos de los hechos de
manera metafórica. Pero la práctica manera en
que la hipótesis atómica se presta
a la representación de los
rasgos característicos de un cambio químico no
llega a constituir una prueba de que los átomos
tener alguna existencia real.
Alexander Smith, Profesor de
Química, Universidad de Chicago
(1910)
Introducción
En los primeros cinco capítulos se encontraron algunas de las ideas más fundamentales en química: átomos, moléculas, moles, conservación de masa y energía, comportamiento de los gases, teoría cinética, equilibrio y química ácido-base en solución. Todas estas ideas se han presentado de una manera muy dogmática, sin pruebas de ningún tipo. Ahora es el momento de dejar de ser creyente y de volverse escéptico. ¿Cómo sabemos que el material de los cinco primeros capítulos es cierto? ¿Cómo sabemos, por ejemplo, que la fórmula molecular para el agua es H 2 0? Después de todo, los mejores químicos del mundo pensaron que era HO durante 58 años completos después de que la teoría atómica fuera propuesta en 1802 por John Dalton. ¿Por qué cambiaron de opinión? ¿Qué nos da el derecho de afirmar que un átomo de carbono es aproximadamente 12 veces más pesado que un átomo de hidrógeno? No es fácil pensar en formas de pesar el mismo número de átomos sin el concepto de topo, y este concepto depende de la existencia de un conjunto confiable de pesos atómicos, lo que nos lleva de vuelta en círculo a los pesos relativos del carbono y el hidrógeno. ¿Cómo se puede romper el círculo?
¿Cómo se obtienen los números atómicos para los elementos? ¿Por qué los átomos con el mismo número atómico pero diferentes pesos atómicos (isótopos) tienen propiedades químicas tan casi idénticas que se les da el mismo símbolo y se clasifican como un elemento? ¿Qué pruebas hay de que las cargas negativas en un átomo están en el exterior, y las cargas positivas se agrupan en un diminuto núcleo central que contiene prácticamente toda la masa del átomo? ¿Y qué queremos decir con el radio de un átomo? ¿No es tan difícil medir el tamaño de un átomo como su peso? ¿Qué mediciones de laboratorio se pueden relacionar con tales dimensiones microscópicas y cómo podemos estar seguros de que la relación es correcta?
¿Cómo, de hecho, sabemos que los átomos existen en absoluto? ¿Cómo sabemos realmente que todo lo dicho hasta ahora no es producto de la imaginación hiperactiva del químico? Quizás el profesor Smith, autor de nuestra cita de apertura de capítulo, tenía razón. Los alquimistas explicaron las reacciones químicas en términos de figuras mitológicas o planetas (la distinción no estaba clara en sus propias mentes) que asociaban con los reactivos: oro con el sol, cobre con Venus, hierro con Marte, estaño con Júpiter y plomo con Saturno. ¿De qué manera los átomos son modelos más exitosos que los dioses griegos? Y ¿cómo son realmente más satisfactorios el hidrógeno, el helio, el litio, el berilio, etc. como “materiales fundamentales” que la tierra, el aire, el fuego y el agua de Empédocles en la antigua Grecia?
Ya hemos mencionado los experimentos de Faraday con iones y electrólisis, y las mediciones de Thomson y Millikan de carga y masa de electrones, en el Capítulo 1. El tremendo logro de Mendeleev y Meyer en la construcción de la tabla periódica de los elementos es el tema del Capítulo 7. El trabajo de Rutherford, Bohr, Schrödinger y otros en el desarrollo de la teoría moderna de la estructura atómica y la unión se describe en el Capítulo 8. En este capítulo nos remontaremos aún más atrás, y nos centraremos en dos hombres que revolucionaron la química: Antoine Lavoisier (1743-1794), quien demostró que la cantidad fundamental en cualquier reacción química es la masa) y John Dalton (1766-1844), quien propuso que las unidades fundamentales en las reacciones químicas son átomos. Dalton no fue el primero en proponer la idea de los átomos en principio, pero fue el primero en mostrar de manera convincente que los átomos sí existen, y que son una base útil para entender las reacciones químicas.
Este capítulo es un ejercicio tanto de historia química como de comprensión química, los dos frecuentemente van de la mano. Uno de los principios rectores de este libro es que conocer cómo evolucionaron los conceptos químicos ayuda a hacerlos más comprensibles e interesantes. Dicho material histórico suele presentarse en posscriptos al final de los capítulos. En efecto, este capítulo es una larga posdata de los cinco primeros capítulos. Mientras viajas por el resto de este libro, estudia y aprende el material en los capítulos, y relájate y disfruta de los posguiones.
El concepto de un elemento

Una de las ideas más antiguas de la ciencia es la de los materiales fundamentales a partir de los cuales se hace todo lo demás. Empédocles (500 a.C.), en Grecia, realizó lo que podría ser el primer análisis químico registrado. Señaló que cuando la madera se quema, el humo o el aire se eleva primero y es seguido por la llama o el fuego. El vapor de agua se condensará en una superficie fría que se mantiene cerca de la llama. Después de la combustión, los restos son cenizas o tierra. EmpeDoc1es interpretó la combustión como una descomposición de la sustancia ardiente en sus cuatro elementos: tierra, aire, fuego y agua. Él y los escritores posteriores generalizaron estos en los cuatro elementos de los cuales todas las sustancias estaban compuestas en proporciones variables (Figura 6-1). Originalmente, al menos, estas ideas no estaban destinadas a ser vuelos de invención metafísica, sino que eran intentos de explicar observaciones. Posteriormente, entre los alquimistas griegos, árabes y medievales, las ideas se impregnan de misticismo. Entonces la tierra, el aire, el fuego y el agua fueron abandonados como elementos fundamentales, pero diferentes conjuntos de lo que ahora llamaríamos elementos o compuestos simples fueron elegidos por diferentes alquimistas como materiales fundamentales de la naturaleza.
Aristóteles (384 -322 a.C.) dio una definición de un elemento que, incluso ahora, difícilmente puede mejorarse:
-
- “Todo es un elemento o compuesto de elementos... Un elemento es aquel en el que se pueden resolver otros cuerpos, y que existe en ellos ya sea potencial o realmente, pero que no puede resolverse por sí mismo en algo más simple, o diferente en especie”.
Sin embargo, esta definición no responde a la pregunta de cómo reconocer un elemento cuando te encuentras con uno. Robert Boyle (1627- 1691) dio una definición más práctica: Un elemento es una sustancia que siempre va a subir de peso al sufrir un cambio químico. Esta afirmación debe entenderse en el sentido en que se pretendía. Por ejemplo, cuando el hierro se oxida, el óxido de hierro producido pesa más que el hierro original. Sin embargo, el peso t del hierro y el oxígeno que se combina con él es exactamente el mismo que el peso del óxido de hierro. Por el contrario, cuando se calienta el polvo rojo de óxido mercúrico, se emite gas oxígeno, y el mercurio líquido plateado que queda pesa menos que el polvo rojo original. Pero si esta descomposición se lleva a cabo en un matraz cerrado, se ve que no hay pérdida general de peso durante la reacción. (Fue un siglo después de Boyle que Lavosier realizó cuidadosos experimentos de pesaje demostrando la conservación de la masa en tales reacciones).
Por definición de Boyle, el óxido mercúrico no podría ser un elemento, porque puede descomponerse en partes, cada una de las cuales es más ligera que la sustancia original. El mercurio podría llamarse provisionalmente un elemento, al menos hasta el día en que alguien más logró separarlo en componentes. Hasta el presente siglo de espectroscopía y otras técnicas de laboratorio, era fácil demostrar que una sustancia no era un elemento, sino imposible probar que uno lo era. Como escribió el famoso químico alemán Justus von Liebig, en 1857, “Los elementos cuentan como sustancias simples no porque sepamos que son así, sino porque no sabemos que no lo son”.
Los elementos llamados tierras raras proporcionan un ejemplo de las dificultades de probar por medios puramente químicos que una sustancia es un elemento. En 1839, el químico sueco Carl Mosander extrajo un nuevo elemento del nitrato de cerio y lo llamó lantano (del lantano griego, “estar oculto”). Dos años después demostró que su preparación que contenía lantano contenía un segundo elemento al que bautizó didimio (del griego didimos, o “gemelo”). En 1879, Fran~ois Lecoq de Boisbaudran aisló otra sustancia, el samario, de la preparación de didimio, y todos estos fueron aceptados como elementos químicos. Pero el didimio desapareció de los rollos de la química en 1885, cuando el austriaco Carl von Welsbach lo separó en dos nuevos elementos, el neodimio (“nuevo gemelo”) y el praseodimio (“gemelo verde”). Es sólo porque ahora tenemos la tabla periódica, y entendemos los principios detrás de su construcción, que podemos decir que no puede haber otros elementos nuevos entre el hidrógeno, 1 H, y el elemento 105.
¿Qué tipo de sustancias son los elementos? Los primeros en ser reconocidos correctamente como tales fueron los metales. El oro, la plata, el cobre, el estaño, el hierro, el platino, el plomo, el zinc, el mercurio, el níquel, el tungsteno y el cobalto son metales. De hecho, todos menos 22 de los 105 elementos conocidos tienen propiedades metálicas. Cinco de los no metales (helio, neón, argón, criptón y xenón) fueron descubiertos en la mezcla de gases que quedaron cuando se eliminó todo el nitrógeno y oxígeno en el aire. Los químicos pensaron que estos gases “nobles” eran inertes hasta 1962, cuando se demostró que el xenón se combina con el flúor, el no metal químicamente más activo. Los otros no metales químicamente activos son gases (como hidrógeno, nitrógeno, oxígeno y cloro) o sólidos cristalinos quebradizos (como carbono, azufre, fósforo, arsénico y yodo). Solo un elemento no metálico, el bromo, es líquido en condiciones ordinarias.
Compuestos, Combustión y Conservación de Masa

La mayoría de los químicos del siglo XVIII se dedicaron a preparar y describir compuestos puros, y a descomponerlos en los elementos a partir de los cuales se forman. Los grandes avances de la época estuvieron en la química de los gases. En 1756, Joseph Black cambió por completo las ideas de los químicos sobre los gases cuando mostró, en su tesis de maestría en Edimburgo, que el mármol (que sabemos que es principalmente carbonato de calcio, CaCo 3) podría descomponerse en cal viva (óxido de calcio, CaO) y un gas (dióxido de carbono, CO 2), y que el proceso podría revertirse. Esta demostración demostró que había diferentes tipos de gases, y que podían tomar parte en reacciones químicas de la misma manera que los líquidos y los sólidos. Uno de los contemporáneos de Black, John Robinson, escribió lo siguiente:
-
- “Había descubierto que una pulgada cúbica de mármol consistía en aproximadamente la mitad de su peso de cal pura y tanto aire como llenaría un recipiente con seis galones de vino... ¿Qué podría ser más singular que encontrar una sustancia tan sutil como el aire existente en forma de piedra dura, y su presencia acompañada de tal cambio en las propiedades de la piedra?”
En los años siguientes, Henry Cavendish descubrió hidrógeno (1766), Daniel Rutherford encontró nitrógeno (1772), y Joseph Priestley inventó el agua carbonatada e identificó óxido nitroso (“gas de la risa”), óxido nítrico, monóxido de carbono, dióxido de azufre, cloruro de hidrógeno, amoníaco y oxígeno. En 1781, Cavendish demostró que el agua es una combinación de solo hidrógeno y oxígeno, después de haber presenciado a Priestley explotar los dos gases en lo que Priestley luego recordó como “un experimento aleatorio para entretener a algunos amigos filosóficos”. El descubrimiento de oxígeno (Figura 6-2) llevó a Antoine Lavoisier a derrocar la idea predominante de la química del siglo XVIII, la teoría del flogiston. El proceso por el que se hizo añicos esta teoría ilustra la gran importancia de las mediciones cuantitativas en la química.
Phlogiston
Cuando Empedocles vio quemar madera, quedó impresionado con la idea de que algo dejara la madera; solo quedaba una ligera ceniza esponjosa. Se aceptó generalmente que la combustión era la descomposición de una sustancia acompañada de una pérdida de peso. Los óxidos metálicos suelen ser menos densos y menos compactos que los metales de los que provienen. Aun cuando se supo que el óxido era más pesado que el metal original, una confusión entre la densidad (peso por unidad de volumen) y el peso mismo agravó el error. Los alemanes Johann Becher y Georg Stahl propusieron, en 1702, que todo el material combustible contenga un elemento llamado flogistón, que escapa cuando el material se quema. Según su teoría,
-
- 1. Los metales, cuando se calientan, pierden flogiston y se convierten en calces. (Un calx es un residuo desmenuzable).
- 2. Los calces, cuando se calientan con carbón vegetal, reabsorben la flogistona y vuelven a convertirse en metales. El carbón es necesario porque el flogistón original se ha dispersado por la atmósfera circundante y se ha perdido.
- 3. Por lo tanto, el carbón debe ser muy rico en flogistón.
Por esta teoría, una cerilla encendida se apaga cuando se coloca en una botella cerrada debido a que el aire en la botella se satura de flogiston; la respiración en organismos vivos es un proceso de purificación en el que se elimina el flogiston; un ratón debajo de una campana eventualmente muere cuando el aire a su alrededor ha absorbido todos los flogistón puede.
Piensa en estas ideas por un tiempo. Siempre y cuando no hagas experimentos de pesaje, esta teoría explica la combustión así como nuestras ideas actuales, y parece estar de acuerdo con las observaciones de sentido común sobre la aparición de metales y calces. Jean Rey, en Francia, había demostrado que el estaño gana peso cuando se quema, pero los químicos, desacostumbrados a darle mucha importancia al peso, pasaron por alto la importancia de la obra de Rey. En 1723, Stahl dio una explicación inteligente para el hallazgo de Rey:
-
- “El hecho de que los metales cuando se transforman en sus calces aumenten en
peso, no desmiente la teoría del flogiston, sino que, por el contrario, la confirma, porque el flogiston es más ligero que el aire y, al combinarse con sustancias, se esfuerza por levantarlas, y así disminuir su peso; en consecuencia, una sustancia que ha perdido flogiston debe ser más pesada que antes”.
¡No es de extrañar que el hidrógeno, cuando fue descubierto, fuera aclamado como la primera preparación de flogiston puro! Nuevamente hubo una confusión entre las dos ideas de peso y de densidad (en términos de flotabilidad).
Conservación de la Masa
Lavoisier descubrió que el calx mercúrico perdió peso cuando se calentaba y se producían mercurio libre y un gas. Midió el volumen de gas liberado. Entonces demostró que cuando el mercurio se reconvirtió a calx, se reabsorbió el mismo volumen de este gas y hubo un aumento de peso igual a la pérdida anterior. A partir de experimentos de pesaje cuidadosos como estos, Lavoisier propuso que los materiales combustibles se quemen al agregar oxígeno, aumentando así de peso. (Oxígeno era su nombre para el gas. Priestley lo llamó aire desflogisticado ya que aparentemente podría absorber aún más flogistón que el aire atmosférico). Lavoisier demostró que los productos obtenidos de la quema de madera, azufre, fósforo, carbón vegetal y otras sustancias eran gases cuyo peso siempre excedía al de los sólidos que se quemaban. Su refutación a las explicaciones metalúrgicas de Becher y Stahl fue la siguiente:
-
- 1. Los metales se combinan con el oxígeno del aire para formar calces, que son óxidos.
- 2. El carbón caliente elimina el oxígeno de los calces para formar un metal y un gas, 0 2 (en ese momento llamado aire fijo).
- 3. El carbón, por lo tanto, no se combina con el metal) · más bien, elimina el oxígeno que previamente se había combinado con el metal en el calx.
La clave de esta teoría fue el equilibrio químico. Lavoisier fue el primer químico en darse cuenta de la importancia del principio de la conservación de la masa. En su Traite Etementaire de Chimie) escribió:
-
- “Debemos establecerlo como un axioma incontestable, que en todas las operaciones del arte y la naturaleza no se crea nada; existe igual cantidad de materia tanto antes como después del experimento... De este principio, depende todo el arte de realizar experimentos químicos”.
Lavoisier fue primero un hombre de negocios y un químico segundo. Su ocupación de tiempo completo fue como miembro de la Ferme Generale) agencia que recaudaba impuestos a comisión para el gobierno francés antes de la revolución. Uno de sus biógrafos ha llamado a su conservación del dictum masivo el “principio del balance”, y ha afirmado ver su origen en su papel de recaudador de impuestos. Sea como fuere, en 1794, su conexión con el Ferme Generale le costó la vida. *
-
- *Aclamado ante un tribunal revolucionario por sus asociaciones aristocráticas pasadas, Lavoisier escuchó a Coffinhal, presidente del tribunal, rechazar un alegato de clemencia: “La República no necesita químicos y sabios. No se interrumpirá el curso de la justicia”. Este fue seguramente uno de los recortes gubernamentales más serios en la historia de la ciencia.
Lavoisier publicó su libro de texto, Traite Etementaire de Chimie) en 1789, y sería difícil exagerar el impacto que tuvo en la química. Además de exponer el principio de conservación de la masa en las reacciones químicas y derrocar la teoría del flogistón, el libro contenía en un apéndice lo que es esencialmente nuestro sistema actual de nomenclatura. Durante una generación, por lo tanto, la química se convirtió en “la ciencia francesa” (la frase permaneció más tiempo en Francia que en otros lugares).
¿Un Compuesto Tiene Una Composición Fija?
Después de Lavoisier, los químicos comenzaron un estudio intensivo de cantidades en reacción química, es decir, masas. La distinción entre compuestos y mezclas o soluciones poco a poco se hizo clara. Se desarrolló una disputa entre quienes afirmaron que las proporciones de elementos en los compuestos eran fijas y quienes creían que era posible un rango continuo de proporciones. El químico francés Berthollet citó aleaciones de metales en apoyo de la idea de composición variable. Pero]. L. Proust, en Madrid, insistió en que los compuestos tenían composición fija, y reconocieron correctamente las aleaciones como soluciones sólidas, no compuestos:
-
- “Las propiedades de los compuestos verdaderos son invariables como lo es la proporción de sus constituyentes. Entre polo y polo, se encuentran idénticos en estos dos aspectos; su apariencia puede variar debido a la forma de agregación, pero sus propiedades [químicas] nunca. Aún no se han observado diferencias entre los óxidos de hierro del Sur y los del Norte. El cinabrio de Japón se constituye según la misma proporción que el de España. La plata no se oxida o muriada de manera diferente en el muriato de Perú que en el de Siberia”.
A este principio se le ha llamado la ley de la composición constante. La disputa entre Berthollet y Proust tuvo el buen efecto de enviar químicos al laboratorio para probar las ideas de uno u otros campos, y por cierto para compilar rápidamente un conjunto de conocimientos sobre composición química. *Por supuesto, Proust tenía razón; sin embargo, existen materiales cristalinos sólidos en los que, debido a defectos en la estructura cristalina, la misma proporción de átomos no es exactamente la que predice la fórmula química ideal. Por ejemplo, el sulfuro de hierro puede variar de Fe 1.1 S a FeS 1.1, dependiendo de cómo se prepare la muestra. Tales sustancias se denominan sólidos no estequiométricos, aunque se ha sugerido que se les llame “bertollidas” después del perdedor en el debate que acabamos de discutir.
-
- *El punto de vista ortodoxo es que acudieron al laboratorio para decidir entre dos teorías contradictorias. Seamos honestos: Los científicos son personas, y la ciencia rara vez se lleva a cabo en un vacío tan no partidista.
Proporciones Equivalentes
Entre 1792 y 1802, un oscuro químico alemán llamado Jeremias Richter realizó un descubrimiento importante que fue ignorado casi por completo por sus contemporáneos. Su idea era la de las proporciones equivalentes: Las mismas cantidades relativas de dos elementos que se combinan con en otro también se combinarán con un tercer elemento (asumiendo que las reacciones son posibles en absoluto). Este concepto es fácil de entender a partir de algunos ejemplos:
-
- 1 g oh hidrógeno se combina con 8 g de oxígeno para formar agua.
- 1 g de hidrógeno se combina con 3 g de carbono para formar metano.
- 1 g de hidrógeno se combina con 35.5 g de cloro para formar cloruro de hidrógeno.
- 1 g de hidrógeno se combina con 25 g de arsénico para formar arsina.
Las reacciones químicas y fórmulas (que no se conocían en ese momento) son, de hecho,
-
- 2H 2 + O 2 → 2H 2 O
- 2H 2 + O 2 → 2H 2 O
- H 2 + O 2 → 2H 2 O
- 3H 2 + O 2 → 2H 2 O
Usando pesos atómicos modernos, verificar que las declaraciones anteriores sobre los pesos involucrados en las reacciones son verdaderas.
La ley de proporción equivalente de Richter establece que si el carbono y el oxígeno se combinan deben hacerlo en la proporción de 3 a 8 en peso. Esto es cierto para lo que ahora sabemos que es CO 2. Si reaccionan, el carbono y el cloro deberían hacerlo en la proporción de 3 a 35.5, y esto es cierto para el líquido que ahora conocemos como tetracloruro de carbono, CCl 4. De manera similar, el arsénico forma AsCl 3, y As 2 O 3 y el cloro y el oxígeno forman Cl 2 O.
Combinar pesos

Un peso combinado se puede definir para cada elemento como el peso del elemento que combina con 1 g de hidrógeno. Si no existe compuesto de hidrógeno, es el peso que combina con 8 g de oxígeno o con uno combinando peso de algún otro elemento que sí forma un compuesto de hidrógeno. De esta manera una red de ramificación de reacciones puede llevar a una tabla de combinación de pesos para todos los elementos. El principio de Richter, si es cierto, nos asegura que no habrá contradicciones dentro de la mesa. Tal conjunto de pesos combinatorios para todos los elementos. El principio de Richter, si es cierto, nos asegura que no habrá contradicciones dentro de la mesa. Dicho conjunto de pesos de combinación se muestra en la Figura 6-3 y la Tabla 6-1.
Hay un grave defecto en este esquema, razón por la cual nadie se tomó muy en serio a Richter. El defecto es que muchos elementos parecen tener más de un peso combinado. El carbono forma un segundo óxido (lo conocemos ahora como monóxido de carbono, CO), en el que la relación de carbono a oxígeno es solo de 3 a 4. O el peso combinado del carbono ha subido a 6, o el del oxígeno ha caído a 4. En etano (C 2 H 6) el peso combinado de carbono es 4, en etileno (C 2 H 4) es 6, y en acetileno (C 2 H 2) es 12. El óxido esperado de azufre, SO, no aparece, y en los dos óxidos más comunes (SO 2 y SO 3) el azufre tiene pesos combinados de 8 y 5 (Figura 6-4).
(Figura 6-4).


El nitrógeno es particularmente problemático. En amoníaco tiene un peso combinado de 4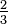 , y en los tres óxidos conocidos desde la época de Priestley sus pesos combinados son 3
, y en los tres óxidos conocidos desde la época de Priestley sus pesos combinados son 3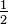 , 7 y 14. Si conoces fórmulas químicas, los pesos combinados son fáciles de calcular, y deberías poder verificarlos. Pero si solo conoces los pesos combinatorios, ¿podrías deducir las fórmulas? La significación de las proporciones de elementos en los compuestos se oscureció aún más por el hábito de reportar la composición en porcentaje en peso; fue John Dalton quien desarrolló el truco de escribirlos como ratios a un elemento común y establecer tablas de peso combinando, lo que todavía hacemos. Cuando Humphry Davy informó que los tres óxidos de nitrógeno contenían 29.50%, 44.05% y 63.30% de nitrógeno en peso, nadie notó que el nitrógeno se estaba combinando en las relaciones relativas de 1 a 2 a 4. (Estos porcentajes son los valores experimentales de Davy. ¿Cuáles son los porcentajes correctos?) Para 1802, se estableció que los compuestos tenían composiciones fijas, y que podría haber varias de esas composiciones definidas entre los mismos dos elementos. Sin embargo, nadie sabía por qué, ni a dónde ir a partir de ahí.
, 7 y 14. Si conoces fórmulas químicas, los pesos combinados son fáciles de calcular, y deberías poder verificarlos. Pero si solo conoces los pesos combinatorios, ¿podrías deducir las fórmulas? La significación de las proporciones de elementos en los compuestos se oscureció aún más por el hábito de reportar la composición en porcentaje en peso; fue John Dalton quien desarrolló el truco de escribirlos como ratios a un elemento común y establecer tablas de peso combinando, lo que todavía hacemos. Cuando Humphry Davy informó que los tres óxidos de nitrógeno contenían 29.50%, 44.05% y 63.30% de nitrógeno en peso, nadie notó que el nitrógeno se estaba combinando en las relaciones relativas de 1 a 2 a 4. (Estos porcentajes son los valores experimentales de Davy. ¿Cuáles son los porcentajes correctos?) Para 1802, se estableció que los compuestos tenían composiciones fijas, y que podría haber varias de esas composiciones definidas entre los mismos dos elementos. Sin embargo, nadie sabía por qué, ni a dónde ir a partir de ahí.
John Dalton y la Teoría de los Átomos

John Dalton, profesor de ciencias (o “filosofía natural”) en las escuelas de Manchester, Inglaterra, se vio obligado por datos como los de la Sección 6-3 a proponer una teoría de los átomos, que presentó a la Sociedad Literaria y Filosófica de Manchester en 1802 y publicó tres años después. Su teoría fue la siguiente:
-
- 1. Toda la materia está compuesta por átomos. Estas son las partículas definitivas, y son indivisibles e indestructibles.
- 2. Todos los átomos de un elemento dado son idénticos, tanto en peso como en propiedades químicas.
- 3. Los átomos de diferentes elementos tienen diferentes pesos y diferentes propiedades químicas.
- 4. Los átomos de diferentes elementos pueden combinarse en números enteros simples para formar compuestos.
- 5. Cuando un compuesto se descompone, los átomos recuperados permanecen inalterados y pueden formar los mismos o nuevos compuestos.
Dalton también enfatizó pesos, como lo hizo Lavoisier; además, Dalton inventó un conveniente simbolismo para los átomos, mostrado en la Figura 6-5. El símbolo de Dalton para hidrógeno representa más que simplemente una cantidad no especificada de hidrógeno. Representa un átomo de hidrógeno o algún peso estándar de hidrógeno que contiene un número estándar de átomos (como el peso atómico que contiene el número de átomos de Avogadro). Por lo tanto, las fórmulas y ecuaciones químicas no son meramente simbólicas, sino cuantitativas.
La teoría atómica griega
La idea de los átomos estaba lejos de ser nueva. Demócrito y los epicúreos en Grecia habían propuesto una teoría atómica, alrededor del 400 a.C., que contenía prácticamente todas las ideas de Dalton sobre el tema. Se pierden los escritos originales, pero sabemos de esta teoría por los ataques de sus oponentes y por un largo poema escrito, en el 55 a.C., por un epicúreo romano, Lucrecio. (El poema se titula De Rerum Natura, “Sobre la naturaleza de las cosas”.) Después de Lucrecio, las ideas del atomismo entraron y salieron de la alquimia durante casi 1900 años sin tener un impacto significativo en ella. Isaac Newton y Lavoisier creían ambos en los átomos, pero más como conceptos filosóficos o figuras del habla que ayudaban a pensar en las reacciones que como una teoría que requería experimento.
Aquí hay un punto importante que no se puede sobreestresar. Una teoría en la ciencia es importante si, y sólo si, hace más clara la comprensión del comportamiento del mundo real. Describir el bronce como una aleación sustitutiva de estaño y cobre es superior a describirlo como la confluencia de Júpiter y Venus, en terminología alquímica, porque la teoría del estaño-cobre sugiere experimentos mediante los cuales las propiedades del bronce podrían explicarse, predecirse e incluso mejorarse, mientras que el” matrimonio celeste” teoría no lleva a ninguna parte. Pero tal vez sea menos evidente que la teoría atómica de Democrito, e incluso la de Newton, no fue una gran mejora en esta idea del matrimonio celeste; fueron las mediciones, explicaciones y predicciones de Dalton las que hicieron valiosa la teoría atómica.
Ratios Fijos
Dalton tomó la tabla de combinar pesos como su punto de partida y preguntó por qué se debían fijar las proporciones de elementos en los compuestos. Su respuesta fue que un compuesto consiste en un gran número de moléculas idénticas, cada una de las cuales se construye a partir del mismo pequeño número de átomos, dispuestas de la misma manera. Sin embargo, Dalton todavía necesitaba saber cuántos átomos de carbono y oxígeno se combinaban en cada molécula de un óxido de carbono, y cuántos átomos de hidrógeno y oxígeno se combinaban en una molécula de agua. Al carecer de otra guía, propuso una “regla de simplicidad” que lo inició bien pero que finalmente lo metió en serios problemas. La molécula de dos elementos más estable, razonó, sería la simple diatómica, AB. Si solo se conociera un compuesto de dos elementos, sería un compuesto AB. A continuación más estables serían las moléculas triatómicas, AB 2 y A 2 B. Si solo se conocieran dos o tres compuestos de dos elementos, serían de estos tres tipos. Esta regla era uno de esos principios de la economía, como la minimización de la energía en la mecánica o el principio de menor acción en la física, que a veces son correctos, y a veces incorrectos. Dalton se equivocó.
Dalton comenzó asumiendo erróneamente de su regla de simplicidad que el agua tenía una fórmula diatómica, HO. Esto hizo que el peso atómico del oxígeno sea igual a su peso combinado de 8 (todo relativo a 1 para hidrógeno). Posteriormente recurrió a los óxidos de carbono y nitrógeno; las posibles elecciones se muestran en el Cuadro 6-2. (Todos los pesos atómicos en esta discusión se basan en los valores numéricos verdaderos, no en los valores de Dalton. Era un experimentalista notoriamente pobre. El peso atómico del oxígeno, incluso en sus propios términos, comenzó en 6.5 y poco a poco trabajó hasta 8.) Un óxido de carbono tuvo una relación carbono-oxígeno de 0.75 y el otro tuvo una relación de 0.375. Si el primer óxido fuera CO- asumió que uno de ellos tenía que ser entonces, como muestra el Cuadro 6-2, el otro sería CO 2, así, el peso atómico del carbono sería 6. Si el segundo óxido fuera CO, el primero tendría que ser C 2 0. (¿Puedes probarlo?) Entonces el carbono tendría un peso atómico de 3. Dado que el óxido A era más estable a la descomposición, argumentó que éste debía ser CO, y eligió correctamente la posibilidad 1. Para los óxidos de nitrógeno, de manera similar descartó las posibilidades 1 y 3 porque las moléculas de cinco átomos chocaron con su regla de simplicidad; y nuevamente hizo la correcta asignación de un peso atómico de 7 para el nitrógeno. (Correcto, es decir, relativo a 8 para el oxígeno.)

Dalton debió haber sentido problemas en cuanto llegó al amoníaco. Supuso por regla de simplicidad que la fórmula molecular para el amoníaco era NH. Sin embargo, dado que 4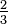 g de nitrógeno se combina con 1 g de hidrógeno, esta suposición habría significado un peso atómico de 4
g de nitrógeno se combina con 1 g de hidrógeno, esta suposición habría significado un peso atómico de 4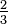 para el nitrógeno, valor en conflicto con el número 7 calculado a partir de los óxidos. Como alternativa, podría haber mantenido el peso atómico de 7 y elaborar la fórmula para el amoníaco:
para el nitrógeno, valor en conflicto con el número 7 calculado a partir de los óxidos. Como alternativa, podría haber mantenido el peso atómico de 7 y elaborar la fórmula para el amoníaco:
-
- Hidrógeno:
 = 1 mol de átomos de hidrógeno
= 1 mol de átomos de hidrógeno - Nitrógeno:
 = 0.667 moles de átomos de nitrógeno
= 0.667 moles de átomos de nitrógeno
- Hidrógeno:
Con la relación molar de hidrógeno a nitrógeno (y por lo tanto la relación de átomos también) siendo 1:0 .667, o 3:2, la fórmula química tendría que ser N 2 H 3, N 4 H 6, o algún múltiplo superior. Tal resultado habría sacudido la fe de Dalton en la regla de la simplicidad, y podría haberlo obligado a regresar y encontrar el camino correcto. Sin embargo, fue deshecho por la mala calidad de sus datos experimentales. Su valor inicial para el peso combinado del oxígeno fue de 6.5, el cual elevó a 7 en 1808. Davy lo aumentó 7.5, y Proust finalmente llegó a la cifra correcta (dadas las suposiciones de Dalton) de 8. Dalton se negó a creer sus valores (una actitud obstinada para un experimentalista tan pobre), y todos los cálculos de nitrógeno aquí descritos fueron realizados por Dalton con un peso atómico de nitrógeno de 5 en lugar de 7.
Ley de Múltiples Proporciones
Es fácil criticar a un hombre que se ha extraviado por malos datos. Pero el verdadero logro de la teoría atómica, que hizo que la gente la aceptara casi a la vez, no fue el cálculo de los pesos atómicos. Fue la teoría atómica explicada perfectamente un principio que había permanecido desapercibido en que publicaba literatura desde hacía más de 15 años, relacionando elementos que se combinan para formar más de un compuesto. Esta era la ley de Dalton de múltiples proporciones.
La ley de proporciones múltiples establece que si dos elementos se combinan para formar más de un compuesto, entonces las cantidades de un elemento que se combinan con una cantidad fija del otro diferirán por factores que son las proporciones de números enteros pequeños. (O, que se pueden multiplicar las cantidades por una constante adecuada y producir un conjunto de enteros.) Ya que hemos estado usando pesos combinados, quizás una afirmación más significativa es que si un elemento muestra varios pesos de combinación, estos pesos diferirán entre ellos por razones de números enteros pequeños. Por ejemplo, los pesos de combinación de carbono en la Tabla 6-1 difieren en las relaciones de 3 a 4 a 6 a 12, o, más revelando, en la relación de 1/4 a 1/3 a 1/2 a 1. Los pesos de combinación para azufre están en las relaciones de 1 a 1/2 a 1/3, y los de nitrógeno son 1/3 a 1/4 a 1/2 a 1 en NH 3, NO 2, NO y N 2 O. La explicación de Dalton de estas fracciones simples fue que uno, o dos, o pequeño número de átomos podrían combinarse con uno de otro tipo, pero que una molécula con 1.369... átomos combinados con 1 átomo de otro era físicamente imposible según la teoría atómica. Los pesos combinados difieren en pequeñas fracciones de números enteros porque los átomos se combinan en números enteros pequeños.
Una búsqueda a través de la literatura química mostró que esta ley era la norma universal. Una cosa es probar tu teoría con nuevos datos que has recopilado, pero es mucho más impresionante probarlo con los de todos los demás; esto es lo que hizo Dalton. La aceptación de la teoría atómica fue rápida y casi unánime.
Números iguales en volúmenes iguales: Gay-Lussac y Avogadro
A medida que los químicos intentaban deducir fórmulas para cada vez más compuestos, los defectos en los pesos atómicos de Dalton y en su regla de simplicidad se hicieron cada vez más evidentes. A nadie se le ocurrió un método confiable para decidir sobre fórmulas químicas. De las tres piezas de información molecular -combinando pesos de los elementos, pesos atómicos de los elementos y fórmulas moleculares- cualquiera podría calcularse si se conocían los otros dos. Sin embargo, solo uno, el peso combinado, era directamente medible. Las suposiciones erróneas de Dalton sobre las fórmulas llevaron a pesos atómicos equivocados, lo que llevó de nuevo a fórmulas equivocadas que se asignaron al ácido acético, el ácido común del vinagre. La confusión fue tan grande que algunos químicos se desesperaron por la teoría atómica. Jean Dumas escribió:
-
- “Si yo estuviera a cargo, borraría la palabra átomo de la ciencia, pues estoy persuadido de que va mucho más allá de la experiencia, y la química nunca debe ir más allá de la experiencia”.
El gran químico alemán Friedrich Wöhler se quejó, incluso ya en 1835, de que
-
- “... la química orgánica en este momento es suficiente para enloquecer a uno. Me da la impresión de un bosque tropical primigenio, lleno de las cosas más notables, un matorral monstruoso e ilimitado, sin forma de escapar, en el que uno bien puede temer entrar”.
Sin embargo, la clave del dilema ya estaba en la literatura química, y lo había estado desde 1811. El primer paso fue proporcionado por Gay-Lussac, y el segundo por Avogadro.
Gay-Lussac

En 1808, Joseph Gay-Lussac (1778-1850) inició una serie de experimentos con los volúmenes de gases reaccionantes. Encontró que volúmenes iguales de gas HCL y amoníaco forman cloruro amónico sólido neutro. Un exceso inicial de cualquiera de los gases queda al final de la reacción. Dos volúmenes de hidrógeno reaccionan con uno de oxígeno para formar dos volúmenes de vapor; tres volúmenes de hidrógeno reaccionan con uno de nitrógeno para producir dos volúmenes de amoníaco; y un volumen de hidrógeno reacciona con uno de cloro para producir dos volúmenes de gas HCl. En estos y otros experimentos, en los que las reacciones de gas fueron generalmente explosiones desencadenadas por una chispa en un contenedor cerrado, Gay-Lussac siempre encontró que los gases reaccionan [en unidades simples de número entero de unidades de volumen 1 siempre que después de la explosión los productos vuelvan a la temperatura y presión de los gases iniciales.
Gay-Lussac era un hombre cauteloso y protegido de Berthollet, quien como hemos visto no creía en compuestos con composiciones fijas. Gay-Lussac no sacó conclusiones en su Memoria, pero la posibilidad de una conexión con la teoría atómica de Dalton era evidente.
Avogadro
Dalton utilizó los datos de Gay-Lussac para “probar” que volúmenes iguales de gas no tienen el mismo número de moléculas, otro giro equivocado, como su regla de simplicidad. El argumento de Dalton se ilustra en la Figura 6-6a. El físico italiano Amedeo Avogadro (1776- 1856) vio otro camino. Comenzó asumiendo que volúmenes iguales de gas (a la misma temperatura y presión) contienen el mismo número de moléculas. Como muestra la Figura 6-6b, esta suposición requiere que los gases de los elementos reactivos como hidrógeno, oxígeno, cloro y nitrógeno estén compuestos por moléculas de dos átomos en lugar de átomos individuales aislados. Si se le hubiera creído a Avogadro cuando publicó sus ideas en 1811, se habría evitado medio siglo de confusión en química. A mucha gente, sin embargo, sus ideas parecían una suposición inestable (números iguales en volúmenes iguales) respaldada por una aún más temblorosa (moléculas diatómicas). En ese momento, las ideas de unión química se basaban casi en su totalidad en la atracción eléctrica y la repulsión, y era difícil para los científicos entender cómo dos átomos idénticos podían hacer cualquier cosa que no fuera repelerse entre sí. Y si atraían, ¿por qué no formaron moléculas más grandes, como H 3 y H 4? Jöns Jakob Berzelius (1779- 1848) utilizó datos sobre los vapores de azufre y fósforo para socavar Avogadro. Sin embargo, Berzelius no se dio cuenta de que estos eran ejemplos de agregados tan altos (S 8 y P 4). El propio Avogadro no ayudaba las cosas; mezclaba tanto la terminología que a veces aparecía como si estuviera dividiendo átomos de hidrógeno (“moléculas elementales”) en lugar de separar átomos en una molécula diatómica (“moléculas integrales”).
Cannizzaro y un método racional de cálculo de pesos atómicos
Para 1860, la confusión sobre los pesos atómicos estaba tan extendida que casi todos los químicos de cualquier reputación tenían su propio método privado de escribir fórmulas químicas. August Kekulé (el inventor de la estructura Kekulé para el benceno) convocó una conferencia en Karlsruhe, Alemania, para tratar de llegar a algún tipo de acuerdo. El hombre que resolvió todo el tema fue el italiano Stanislao Cannizzaro (1826-1910), quien basó un método riguroso para encontrar pesos atómicos en la obra largamente ignorada de su compatriota Avogadro.
El razonamiento de Cannizzaro, basado en el principio de Avogadro de que volúmenes iguales de gas contienen igual número de moléculas, fue el siguiente:
-
- 1. Supongamos que el peso atómico del hidrógeno es 1.0, y que el gas hidrógeno está compuesto por moléculas diatómicas, como sugieren los experimentos de volumen de gas de Gay-Lussac.
- 2. Supongamos que Avogadro tuvo razón al deducir que el gas oxígeno también es diatómico, O 2, y de ahí que la fórmula molecular para el agua es H 2 O, no HO. (Ver Figura 6-6b.) Dado que el peso combinado de oxígeno en agua es 8.0, el peso atómico del oxígeno debe ser 16.0, y el peso molecular de O 2 debe ser 32.0.
- 3. Si volúmenes iguales de todos los gases contienen igual número de moléculas, entonces el peso molecular (m) de un gas es proporcional a la densidad (D) del gas: M = k D. Utilice H 2 y O 2 para evaluar la constante de proporcionalidad, k:
-
-
Densidad, D Peso molecular, Constante, k Gas (g litro -1) M (g mol -1 (litros mol -1) H 2 0.0894 2.0 22.37 O 2 1.427 32.0 22.42 Valor promedio: 22.4
-
(El hecho de que k sea el mismo o ambos H 2 y O 2 indicó que Cannizzaro iba por buen camino).
-
- 4. Evaluar los pesos moleculares de una serie de compuestos que contienen los elementos cuyos pesos atómicos se van a determinar. Partiendo de la composición porcentual en peso de los análisis químicos, y los pesos moleculares calculados a partir de las densidades de gas, se calcula el peso de cada elemento por unidad molecular. Observe estos pesos para un elemento dado para ver si los números pueden interpretarse como múltiplos integrales de algún factor común, que entonces puede ser el peso atómico.
En los datos que se dan en la Tabla 6-3, el carbono se presenta solo en múltiplos de 12, el hidrógeno en múltiplos de 1 y el cloro en múltiplos de 35.3. De ahí que el peso atómico del carbono no pueda ser mayor a 12, aunque podría ser un submúltiplo integral de 12, como 6, 4 o 3.

Los pesos atómicos obtenidos por el método de Cannizzaro son los verdaderos pesos atómicos o múltiplos integrales de ellos. Si solo se hubiera incluido en la tabla etano, benceno y cloruro de etilo, entonces se podría haber llegado a la conclusión de que el peso atómico del carbono era de 24. Si se hubiera agregado información de otros compuestos de carbono a la tabla, y solo un análisis dio un peso de 6 para el carbono, entonces el valor menor tendría que haber sido aceptado, haciendo las fórmulas probables C 2 H 4, C 4 H 6, C 12 H 6, C 2 HCl 3, y así sucesivamente. Sin embargo, no importa cuántos compuestos de carbono se analizaron por el método de Cannizzaro, el peso por unidad molecular siempre resultó ser un múltiplo integral de 12. De ahí que este valor fue aceptado como el peso atómico del carbono.
El logro de Cannizzaro fue el último eslabón de la cadena de lógica que comenzó con Proust y la ley de la composición constante. Se acabó la batalla, salvo para la computación. Los científicos pudieron encontrar pesos atómicos precisos para cualquier elemento que apareciera en compuestos con densidades de vapor medibles. Con estos pesos atómicos, la composición porcentual de un nuevo compuesto conduciría sin ambigüedades a la fórmula química. El mol se definió como lo hemos señalado en el Capítulo 1, es decir, como el número de gramos de un compuesto igual a su peso molecular en la escala de Cannizzaro (que es la que hoy usamos, con mejoras en la precisión). Se dio cuenta de que un mol de cualquier compuesto tendría el mismo número de moléculas. A pesar de que entonces no se conocía el valor de ese número, se le denominó el número de Avogadro, N, en reconocimiento tardío de su contribución.
Con la retrospectiva que viene del conocimiento de la ley de gas ideal, podemos ver que la constante k de Cannizzaro es simplemente RT/P:
-
- PV = nRT =

- PM = DRT
- k =

- PV = nRT =
| donde | P | = | presión | w | = | peso en gramos | |||
| V | = | volumen | M | = | peso molecular | ||||
| n | = | número de moléculas | D | = | densidad = p/v | ||||
| R | = | constante | k | = | constante = M/D | ||||
| T | = | temperatura |
Los valores de densidad de gas que se utilizaron en la demostración previa del argumento de Cannizzaro son aquellos a temperatura y presión estándar o STP: 1.00 atm y 273 K. Así,
-
- k =
 litros mol -1 = 22.4 litros mol -1
litros mol -1 = 22.4 litros mol -1
- k =
|
En STP, se observan las siguientes densidades de vapor y composiciones porcentuales para tres compuestos de C, H y S:
Suponiendo pesos atómicos de 12 para C y 1 para H, como se acaba de encontrar, se calcula el peso atómico probable del azufre, S, y las fórmulas probables para las moléculas x, y y z. |
||||||||||||||||||||||||||||||||||||||
|
Solución Para cada compuesto, primero calcule el peso molecular (peso molecular) a partir de la densidad del gas, y el peso de cada elemento por molécula:
El peso atómico probable del azufre es, por lo tanto, 32.0 g mol -1. |
| Supongamos que otro compuesto, w, tiene una densidad de vapor de 1.38 g litro -1, y un análisis de 38.7% C, 9.4% H y 51.6% S en peso. ¿Cómo te obligaría esto a revisar tus conclusiones para el Ejemplo 1? |
|
Solución El peso molecular del compuesto w sería 31.0 g mol -1, y el porcentaje de composición indicaría 12.0 g o 1 mol de C por mol, 2.9 g o 3 moles de H, y solo 16.0 g de azufre. De ahí que el peso atómico revisado de S sería 16.0 g mol -1 y la fórmula para la molécula w sería CH 3 S. La fórmula para x entonces sería CS 4; para y, CH 4 S 2; y para z, C 2 H 6 S 2. No hace falta decir que nunca se ha observado un compuesto como w, y el peso atómico de 32.0 para el azufre es válido. |
Mediante cálculos como estos, se obtuvo un conjunto consistente de pesos atómicos para los elementos más ligeros que se pueden encontrar en las moléculas gaseosas.
Pesos atómicos para los elementos pesados: Dulong y Petit
Quedó un problema: ¿qué se hace con los elementos pesados, especialmente los metales, que no se pueden preparar fácilmente en compuestos gaseosos? El problema se puede ilustrar considerando el plomo y la plata.
| El peso combinado del plomo (cantidad por 8.00 g de oxígeno) en el óxido de plomo es de 51.8 g. ¿Cuál es el peso atómico del plomo? |
|
Solución Sabemos que 103.6 de plomo se combinan con 16 g, o 1 mol, de átomos de oxígeno, pero no podemos ir más lejos sin conocer la fórmula química del óxido de plomo. De ahí que estemos atrapados en el mismo círculo vicioso del que Cannizzaro escapó por los átomos más ligeros. Si la fórmula es PbO, entonces el peso atómico del plomo es 103.6. Pero si la fórmula es Pb 2 O, el peso atómico es 51.8, y si PbO 2, 207.2. ¿Se puede demostrar que, en general, si la fórmula para el óxido de plomo es Pb x O y, el peso atómico del plomo será 103.6 (y/x)? El problema tiene varias soluciones. |
| El óxido de plata es 93.05% de plata en peso. ¿Cuál es el peso atómico de la plata? | ||||||||||||||
|
Solución Si tomamos, por simplicidad, una muestra de ejemplar de 100 g, habrá 93.05 g de plata por cada 6.95 g de oxígeno. El peso combinado de plata (cantidad por 8.00 g de oxígeno) es entonces 93.05 g
Necesitamos algún medio para decidir entre estos valores. Sin más información no se puede hacer una elección. |
Pierre Dulong (1785-1838) y Alexis Petit (1791-1820) habían descubierto un método para estimar los pesos atómicos de los elementos más pesados en 1819, pero se había pasado por alto en la confusión general que asistía a la química en ese momento. Hicieron un estudio sistemático de todas las propiedades físicas que posiblemente pudieran tener una correlación con el peso atómico, y encontraron una buena en las capacidades térmicas de los sólidos. La capacidad calorífica en gramos de una sustancia es el número de julios de calor necesarios para elevar la temperatura de 1 g de la sustancia en 1°C. El producto de la capacidad calorífica gramo y el peso atómico de un elemento es el calor requerido para elevar la temperatura de 1 mol en 1°C, o la capacidad calorífica molar. Dulong y Petit notaron que para muchos elementos sólidos cuyo peso atómico se conocía la capacidad calorífica molar fue muy cercana a 25 J deg -1 mol -1 (Cuadro 6-4). Esto indica que el proceso de absorción de calor debe estar relacionado más fuertemente con el número de átomos de materia presentes que con la masa de materia. El trabajo posterior sobre la teoría de las capacidades térmicas de los sólidos ha demostrado que debe haber una capacidad calorífica molar tan constante para los sólidos simples. Dulong y Petit no dieron ninguna explicación, sin embargo.
Dado que no avanzaron ninguna razón para este fenómeno, en su momento fue considerado por la mayoría de los químicos como tan dudoso como la regla de simplicidad de Dalton (que estaba equivocada) o el principio de Avogadro de igual volumen/igual número de moléculas (lo cual era correcto). No fue hasta que Cannizzaro preparó el camino con átomos ligeros que se apreció el método de Dulong y Petit para los átomos pesados.
Ahora podemos elegir entre los posibles valores precisos de peso atómico derivados de datos analíticos utilizando un valor aproximado obtenido asumiendo, con Dulong y Petit, que la capacidad calorífica molar es aproximadamente constante para todos los sólidos, 25 J deg -1 mol -1.

| Las capacidades caloríficas del plomo y la plata, tabuladas por Dulong y Petit, son 0.123 y 0.233 J deg -1 g -1, respectivamente. Utilice esta información para elegir los pesos atómicos adecuados para los Ejemplos 3 y 4. |
|
Solución
Las elecciones correctas de los ejemplos anteriores deben ser 207.2 para el plomo y 107.1 para la plata; las fórmulas químicas entonces son PbO 2 y Ag 2 O. |
| Un mineral común que contiene cobalto, la linnaeita, contiene 58.0% de cobalto y 42.0% de azufre en peso. La capacidad calorífica del metal cobalto es de 0.434 J deg -1 g -l. Suponiendo que usted sabe que el peso atómico del azufre es 32.06, compute el peso atómico del cobalto y escriba la fórmula empírica correcta para la linnaeita. |
|
Solución Las respuestas correctas son 59 y Co 3 S 4. |
Combinando Capacidades, “Valencia” y Número de Oxidación
Con la teoría atómica de Dalton, y con las contribuciones de Avogadro, Dulong y Petit, y Cannizzaro, se hizo posible deducir pesos atómicos para elementos a partir de análisis químicos y datos físicos como densidades de vapor y capacidades caloríficas. Estas deducciones nos han dado la tabla de pesos atómicos que se muestra en la contraportada interior. La siguiente gran tarea de la química fue explicar las fórmulas que podrían derivarse.
El concepto más primitivo en la unión química es probablemente la idea de combinar capacidad, a veces llamada “valencia”. La capacidad de combinación de un elemento en un compuesto dado se define como la relación de su peso atómico verdadero a su peso de combinación en ese compuesto:
-
- Capacidad de combinación =

- Capacidad de combinación =
El hidrógeno tiene una capacidad de combinación de 1, por definición. El oxígeno tiene una capacidad de combinación de 2 en H 2 O y la mayoría de los otros compuestos, pero una capacidad de combinación de 1 en peróxido de hidrógeno, H 2 O 2. Usando los datos de la Tabla 6-1, podemos ver que Cl y Br tienen capacidades de combinación de 1; Ca, 2; y As, 3; el carbono muestra varias capacidades de combinación: 4, 3, 2 y 1. El azufre tiene una capacidad de combinación de 2 en H 2 S, 4 en S0 2 y 6 en SO 3. El nitrógeno tiene una capacidad de combinación de 3 en amoníaco, 4 en NO 2, 2 en NO y 1 en N 2 O. Observe que en estos compuestos de dos elementos la capacidad de combinación total de un elemento equilibra exactamente la capacidad de combinación total del otro. En SO 3 un átomo de azufre con una capacidad de combinación de 6 equilibra tres átomos de oxígeno que tienen una capacidad de 2 cada uno. La formulación del concepto de combinar capacidad o “valencia” fue el primer paso hacia una teoría de la unión química. El segundo paso fue asignar signos más y menos a estas capacidades de combinación para que la suma de las capacidades firmadas para una molécula sea cero. Al hidrógeno se le asignó el valor +1; por lo tanto, el valor para el oxígeno tuvo que ser -2 por lo que la suma para el agua, H 2 O, sería cero. La fórmula para el ácido sulfúrico, H 2 SO 4, requiere que el azufre esté asociado con el valor +6:
-
- H: 2
 +1 = +2
+1 = +2 - O: 4
 -2 = -8
-2 = -8 - S: 1
 +6 = +6
+6 = +6 - Suma: 0
- H: 2
Estas capacidades de combinación firmadas son solo los números de oxidación que encontramos en el Capítulo 1. Son importantes en las teorías de la unión química porque describen cómo los electrones se desplazan hacia o lejos de los átomos en una molécula.
Resumen
Este capítulo ha narrado el proceso mediante el cual los científicos dedujeron que los compuestos químicos están formados por números específicos de átomos de diferentes tipos que tienen pesos atómicos específicos, y poco a poco elaboraron un conjunto de pesos atómicos confiables. La teoría de los átomos se originó como un concepto filosófico más que como un medio de manipulación de sustancias y reacciones. Antoine Lavoisier sentó las bases al establecer que la masa era la cantidad fundamental en las reacciones químicas. John Dalton convirtió la filosofía en realidad al demostrar que la teoría atómica daría cuenta de las observaciones experimentales que se resumieron en las leyes de proporciones equivalentes y proporciones múltiples.
La tarea de decidir sobre un conjunto de pesos atómicos consistentes no fue fácil, y el propio Dalton se descarrió. El argumento circular que involucra supuestos pesos atómicos y fórmulas moleculares asumidas no se rompió hasta 1860, cuando Cannizzaro aplicó un principio que había sido descubierto en 1811 por Avogadro pero que había sido ignorado: Bajo las mismas condiciones de temperatura y presión, volúmenes iguales de todos los gases contienen iguales número de moléculas. Dado que esto significaba que la densidad del gas era proporcional al peso molecular, se abrió el camino para establecer la escala de peso atómico estándar que todavía usamos hoy en día. Se habían sentado las bases cuantitativas de la química moderna.


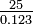 = 203
= 203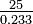 = 107
= 107