12.6: Elementos del grupo VA
- Page ID
- 75611
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Aunque todos los elementos de este grupo forman compuestos en los que su estado de oxidación de +5 es igual al número de grupos, sus otras propiedades varían considerablemente. El nitrógeno es claramente no metálico y consiste en moléculas N 2 diatómicas triples unidas.
El fósforo, también no metálico, existe como moléculas tetraédricas de P 4 (Figura\(\PageIndex{1a}\)) en el vapor y la forma alotrópica blanca del sólido. Al estar de pie, el fósforo blanco cambia lentamente al alótropo rojo, cuya estructura se muestra en la Figura\(\PageIndex{1c}\). La forma más estable del elemento es el fósforo negro, que tiene una estructura de capas (Figura\(\PageIndex{1b}\)). El fósforo negro se puede hacer calentando la forma blanca con un catalizador de mercurio durante 8 días a 220 a 370°C.

El arsénico es un semimetal y consta de As 4 moléculas en fase gaseosa. Cuando As 4 (g) se condensa a un sólido, se pueden formar tres alótropos. El más estable de estos es el arsénico metálico, en el que cada átomo de arsénico tiene tres vecinos más cercanos, con tres átomos más de arsénico algo más alejados.
El antimonio, también semimetal, tiene dos alótropos, siendo el más estable el metálico, como el arsénico. En el caso del bismuto, solo se produce la forma metálica. Obsérvese que para todos los elementos VA del grupo se sigue la regla 8 — N. El número de enlaces o vecinos más cercanos para cada átomo es 8 menos el número de grupo en , P 4, e incluso en las formas metálicas de As, Sb y Bi. La tabla resume las propiedades atómicas de los elementos VA del grupo. En general, las tendencias son las que esperaríamos, en base a nuestra experiencia con grupos anteriores. Estos elementos exhiben una variedad mucho más amplia de estados de oxidación, sin embargo, especialmente en el caso del nitrógeno. Este elemento forma compuestos en los que tiene todos los números de oxidación posibles de —3 (el número de grupo menos 8) a +5 (el número de grupo). Al igual que en grupos anteriores, el estado de oxidación en el que no se utiliza el par ns 2 de electrones para la unión se vuelve más prominente hacia la parte inferior de la tabla periódica. Existen algunos compuestos, Bi (NO 3) 3, por ejemplo, en los que están presentes iones Bi 3+ discretos.
, P 4, e incluso en las formas metálicas de As, Sb y Bi. La tabla resume las propiedades atómicas de los elementos VA del grupo. En general, las tendencias son las que esperaríamos, en base a nuestra experiencia con grupos anteriores. Estos elementos exhiben una variedad mucho más amplia de estados de oxidación, sin embargo, especialmente en el caso del nitrógeno. Este elemento forma compuestos en los que tiene todos los números de oxidación posibles de —3 (el número de grupo menos 8) a +5 (el número de grupo). Al igual que en grupos anteriores, el estado de oxidación en el que no se utiliza el par ns 2 de electrones para la unión se vuelve más prominente hacia la parte inferior de la tabla periódica. Existen algunos compuestos, Bi (NO 3) 3, por ejemplo, en los que están presentes iones Bi 3+ discretos.
| Element | Símbolo |
Configuración de electrones |
Estado de oxidación habitual |
Radio/PM |
|
|---|---|---|---|---|---|
| Covalente |
Iónico (carga) |
||||
| Nitrógeno | N | [Él] 2 s 2 2 p 3 | +5, +3, -3 | 70 |
(3-) 171 |
| Fosforo | P | [Ne] 3 s 2 3 p 3 | +5, +3, -3 | 110 |
- |
| Arsénico | Como | [Ar] 4 s 2 3 d 10 4 p 3 | +5, +3 | 121 |
- |
| Antimonio | Sb | [Kr] 5 s 2 4 d 10 5 p 3 | +5, +3 | 141 |
- |
| Bismuto | Bi | [Xe] 6 s 2 4 f 14 5 d 10 6 p 3 | +5, +3 | 146 | (3+) 108 |
| Símbolo | Energía de ionización/MJ mol —1 |
Densidad/ g cm —3 |
Electro negatividad |
Fusión Punto (en °C) |
||||
|---|---|---|---|---|---|---|---|---|
| Primero | Segundo | Tercero | Cuarto | Quinto | ||||
| N | 1.407 | 2.862 | 4.585 | 7.482 | 9.452 | 1.25×10 -3 | 3.0 |
-210 |
| P | 1.018 | 1.909 | 2.918 | 4.963 | 6.280 | 1.82 | 2.1 | 44 |
| Como | 0.953 | 1.804 | 2.742 | 4.843 | 6.049 | 5.72 | 2.0 | 817 |
| Sb | 0.840 | 1.601 | 2.450 | 4.271 | 5.403 | 6.69 | 1.9 | 631 |
| Bi | 0.710 | 1.616 | 2.472 | 4.380 | 5.417 | 9.80 | 1.9 | 271 |
Los compuestos más importantes del grupo VA son los de nitrógeno y fósforo. Ambos elementos son esenciales para todos los organismos vivos, y ambos se eliminan progresivamente del suelo cuando se cultivan las plantas y se cosechan los cultivos. De acuerdo con la ley del mínimo de Liebig, un suministro insuficiente de cualquiera de los elementos puede limitar el crecimiento de las plantas y reducir los rendimientos de los cultivos, por lo que estos elementos son componentes importantes del fertilizante. Más recientemente ambos elementos han sido implicados en varios tipos de problemas de contaminación. Al discutir las propiedades de los compuestos de nitrógeno y fósforo, también se discutirán sus efectos en la producción de alimentos y la degradación ambiental.
Nitrógeno
La importancia del fertilizante nitrogenado se reconoció por primera vez hace más de un siglo. A finales del siglo XIX el único mineral importante de nitrógeno, el salitre de Chile, NaNO 3, estaba siendo minado en Chile y enviado a Europa para su aplicación a tierras agrícolas, pero el suministro era obviamente limitado. La mayor parte del nitrógeno en la superficie terrestre está en forma de N 2 (g), que constituye el 78 por ciento de la atmósfera por volumen (o por cantidad de sustancia). Por lo tanto, los químicos comenzaron a buscar formas de obtener compuestos nitrogenados directamente de la atmósfera. Cualquier proceso que haga esto se llama fijación de nitrógeno.
La fijación de nitrógeno puede ocurrir de forma natural cuando una descarga eléctrica (relámpago) calienta el aire a una temperatura alta. Se produce la siguiente reacción:
\[\text{N}_2(g) + \text{O}_2(g) \rightarrow \text{2NO}(g) \label{1} \]
El monóxido de nitrógeno (óxido nítrico) formado puede reaccionar aún más a temperaturas ordinarias, produciendo el gas marrón, dióxido de nitrógeno:
\[\text{2NO}(g) + \text{O}_2(g) \rightarrow \text{2NO}_2(g)\label{2} \]
Los diagramas de Lewis para estos y otros compuestos de nitrógeno importantes se muestran en la Figura\(\PageIndex{2}\).

De la figura se puede ver que tanto el NO como el NO 2 tienen un número impar de electrones y violan la regla del octeto. En tal caso es común que dos moléculas se combinen (dimerizan) emparejando sus electrones impares. En el caso del NO 2, la dimerización ocurre por debajo de la temperatura ambiente, produciendo tetróxido de dinitrógeno incoloro:
\[\text{2NO}_2(g) \rightleftharpoons \text{N}_2\text{O}_4(g) \nonumber \]
A temperatura ambiente, sin embargo, el NO 2 y el N 2 O 4 están en equilibrio, como lo demuestra el color marrón de la mezcla. NO dimeriza solo a temperaturas muy bajas en estado sólido.
La primera fijación industrial de nitrógeno se realizó imitando la naturaleza.
La reacción\(\ref{1}\) se realizó en una planta cerca de las Cataratas del Niágara, donde la generación hidroeléctrica proporcionó energía económica para soportar un arco eléctrico. El NO se oxidó adicionalmente a NO 2 que se disolvió en H 2 O para convertirlo en ácido nítrico, HNO 3:
\[\text{3NO}_2(g) + \text{H}_2\text{O}(l) \rightarrow \text{2H}^{+}(aq) + \text{2NO}_3^{-}(aq) + \text{NO}(g)\label{4} \]
Tenga en cuenta que NO 2 no es el anhídrido de ácido del HNO 3. Esta reacción implica, la desproporción de NO 2 (que contiene N en el estado de oxidación +4) para formar HNO 3 en el estado + 5) y NO (N en el estado + 2). El NO se puede reciclar reoxidándolo a NO 2, y así no se desperdició. El HNO 3 producido en la Ecuación (12.5) se neutralizó con NaOH para hacer un sustituto del salitre de Chile:
\[\text{NaOH}(aq) + \text{HNO}_3(aq) \rightarrow \text{NaNO}_3(aq) + \text{H}_2\text{O}(l) \nonumber \]
La fijación de nitrógeno mediante el proceso de arco eléctrico utilizó mucha energía y fue bastante costosa. Se diseñaron otros métodos para reemplazarlo, y el más exitoso de estos es el proceso Haber, que es el principal que se usa hoy en día. El nitrógeno se hace reaccionar con hidrógeno a alta temperatura y presión extremadamente alta sobre un catalizador que consiste en hierro y óxido de aluminio:
\[\text{N}_2(g) + \text{3H}_2(g) \xrightleftharpoons[\text{1000atm}]{\text{450}{}^\circ \text{C}} \text{2NH}_3(g) \nonumber \]
El amoníaco producido por el proceso Haber se utiliza directamente como fertilizante. Se puede licuar bajo presión e inyectar a través de boquillas especiales alrededor de un pie debajo de la superficie del suelo. Esto evita la pérdida de amoníaco gaseoso que de otro modo irritaría la nariz, la garganta y los pulmones de cualquier persona cerca de un campo fertilizado. Probablemente estés familiarizado con el olor a amoníaco ya que es la base débil más común que se encuentra en el laboratorio químico.
Antes del reciente desarrollo de las técnicas de inyección subterránea, la mayor parte del amoníaco se convertía en nitrato de amonio para uso de fertilizantes:
\[\text{NH}_3(aq) + \text{HNO}_3(aq) \rightarrow \text{NH}_4\text{NO}_3(aq)\label{7} \]
A excepción del amoníaco, el nitrato de amonio contiene una mayor fracción de masa de nitrógeno que cualquier otro compuesto de costo comparable. La fabricación de nitrato de amonio requiere que la mitad del amoníaco producido en el proceso Haber se convierta en ácido nítrico. El primer paso es la oxidación del amoníaco sobre un catalizador de platino metálico:
\[\text{4NH}_3(g) + \text{5O}_2(g) \xrightarrow[\text{800}{}^\circ \text{C}]{\text{Pt}} \text{4NO}(g) + {6H}_2\text{O}(g) \nonumber \]
A esto se le llama el proceso de Ostwald. Le siguen las Eqs. \(\ref{2}\)y\(\ref{4}\), produciendo ácido nítrico, que se puede combinar con amoníaco (Ecuación\(\ref{7}\)).
El ácido nítrico y los nitratos tienen aplicaciones comerciales distintas a la producción de fertilizantes. Debido a que el NO 3 — es un agente oxidante fuerte, reacciona vigorosamente con sustancias cuyos elementos se encuentran en estados de baja oxidación. Un ejemplo de esto es el polvo negro, que consiste en carbón (carbono), azufre, un nitrato de potasio, KNO 3 (salitre o nitre). Durante la revolución americana, por ejemplo, ambos ejércitos contaban con numerosas personas cuyo trabajo era encontrar cuevas en las que el KNO 3 relativamente soluble se hubiera depositado como agua evaporada. Un segundo ejemplo es la nitroglicerina que contiene carbono e hidrógeno en estados de baja oxidación así como nitrato. Otro ejemplo más de un nitrato explosivo es el NH 4 NO 3, que contiene nitrógeno en su estado de oxidación máximo y mínimo. NH 4 NO 3 se descompone de la siguiente manera:
\[\text{NH}_4\text{NO}_3(s) \xrightarrow[\text{shock}]{\text{heat or}} \text{N}_2\text{O}(g) + \text{2H}_2\text{O}(g) \nonumber \]
ΔH m = —37 kJ mol —1
La reacción es exotérmica y produce 3 moles de productos gaseosos por cada mol de reactivo sólido. Esto provoca un tremendo aumento de presión, y, si la reacción es rápida, una explosión.
El compuesto monóxido de dinitrógeno (óxido nitroso o gas de risa), producido por descomposición de NH 4 NO 3, es un tercer óxido importante de nitrógeno (además de NO y NO 2). El N 2 O se produce durante la descomposición microbiana de materia orgánica que contiene nitrógeno. Debido a que es bastante poco reactiva, es la segunda sustancia que contiene nitrógeno más concentrada en la atmósfera (después del N 2). Se utiliza comercialmente como anestésico, es levemente intoxicante y es venenoso en grandes dosis.
Los otros dos importantes óxidos de nitrógeno, NO y NO 2, juegan un papel importante en un problema de contaminación del aire conocido como smog fotoquímico (o smog de Los Ángeles). El NO se forma por Ecuación\(\ref{1}\) en motores de automóviles y otros procesos de combustión a alta temperatura. A temperaturas normales el NO se oxida a NO 2 (Ecuación\(\ref{2}\)). Ambos óxidos son radicales libres y son bastante reactivos. Además, el NO 2 de color marrón absorbe la luz solar y la energía de los fotones absorbidos rompe un enlace nitrógeno-oxígeno:
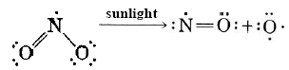
Los átomos de oxígeno producidos son altamente reactivos. Se combinan con moléculas de hidrocarburos (de gasolina evaporada o no quemada) para formar aldehídos, cetonas y otros compuestos que forman una nube casi neblina e irritan los ojos, la garganta y los pulmones. El smog fotoquímico es especialmente malo en ciudades como Los Ángeles y Denver que tienen mucho sol y tráfico de automóviles, pero sus efectos se han observado en todas las grandes ciudades de Estados Unidos.
Fosforo
Al igual que en el caso del carbono y el silicio, existen grandes diferencias entre las químicas del nitrógeno y el fósforo. Las concentraciones de compuestos de fósforo en la atmósfera terrestre son tan pequeñas que son insignificantes, pero el fósforo es más abundante que el nitrógeno en la corteza sólida. Aquí se encuentra como roca de fosfato, la cual es principalmente hidroxiapatita, Ca 10 (PO 4) 6 (OH) 2, o fluorapatita, Ca 10 (PO 4) 6 F 2. (Se trata de las mismas sustancias que intervienen en la discusión de la caries dental en la sección sobre elementos del grupo IVA.)
La roca de fosfato es bastante insoluble y, por lo tanto, sus iones fosfato no pueden ser asimilados por las plantas. La producción de fertilizante fosfato requiere tratamiento de ácido de apatita. Esto protonaba los PO 4 3 —iones, convirtiéndolos en H 2 PO 4 —, cuya sal de calcio es mucho más soluble:
\[\text{Ca}_{10}(\text{PO}_4)_6(\text{OH})_2 + \text{7H}_2\text{SO}_4 + \text{H}_2\text{O} \rightarrow \text{3Ca(H}_2\text{PO}_4)_2•\text{H}_2\text{O} + \text{7CaSO}_4 \nonumber \]
\[\text{Ca}_{10}(\text{PO}_4)_6(\text{OH})_2 + \text{14H}_3\text{PO}_4 \rightarrow \text{10Ca(H}_2\text{PO}_4)_2 + \text{2H}_2\text{O} \nonumber \]
El compuesto Ca (H 2 PO 4) •H 2 O se conoce como superfosfato, y Ca (H 2 PO 4) 2 se llama triple superfosfato.
El ácido fosfórico, H 3 PO 4, utilizado para elaborar superfosfato triple también se obtiene de roca de fosfato. El primer paso es una reducción con carbono (coque) y dióxido de silicio en un horno eléctrico:
\[\text{2Ca}_{10}(\text{PO}_4)_6\text{(OH)}_2 + \text{18SiO}_2 + \text{30C} \rightarrow \text{3P}_4 + \text{30CO} + \text{2Ca(OH)}_2 + \text{18CaSiO}_3 \nonumber \]
El fósforo obtenido de esta manera se oxida luego a pentóxido de fósforo:
\[\text{P}_4(s) + \text{5O}_2(g) \rightarrow \text{P}_4\text{O}_{10}(s) \nonumber \]
(El nombre pentóxido de fósforo para P 4 O 10 proviene de la fórmula empírica P 2 O 5 de este compuesto.) El pentóxido de fósforo es el anhídrido de ácido del ácido fosfórico:.
\[\text{P}_4\text{O}_6(s) + \text{6H}_2\text{O}(l) \rightarrow \text{4H}_3\text{PO}_3(aq) \nonumber \]
Aunque no es un ácido muy fuerte, el ácido fosfórico es triprótico. Por lo tanto, 1 mol de este ácido puede transferir 3 mol de protones a una base fuerte. Existe otro óxido de fósforo, P 4 O 6, que implica el estado de oxidación + 3, correspondiente al uso de los electrones 3p 3, pero no los 3s 2, para la unión. P 4 O 6 es el anhídrido de ácido del ácido fosforoso, H 3 PO 3:
\[\text{P}_4\text{O}_6(s) + \text{6H}_2\text{O}(l) \rightarrow \text{4H}_3\text{PO}_3(aq) \nonumber \]
El ácido fosforoso es bastante débil y, contrariamente a lo que podría sugerir su fórmula, sólo puede donar dos protones. Esto al parecer se debe a que su estructura de Lewis es

Solo se espera que los dos protones unidos a átomos de oxígeno altamente electronegativos sean ácidos.
Otro uso comercial importante de fosfatos es en detergentes para lavado de ropa. El problema de la precipitación de jabón por iones de agua dura como Ca 2+ se mencionó en la sección sobre metales alcalinotérreos. Esto se puede prevenir, y se puede mejorar el poder de limpieza de los detergentes sintéticos, mediante la adición de fosfatos. El compuesto que se suele utilizar es el tripolifosfato de sodio, cuyo anión es un polímero de condensación de iones hidrogenofosfato y dihidrogenofosfato:
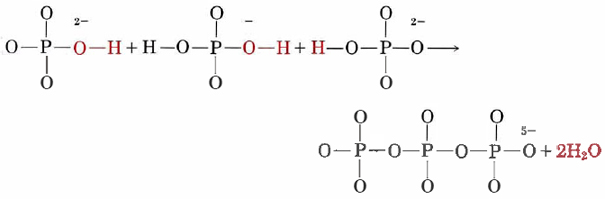

El uso de fosfatos en detergentes es responsable en parte de un problema ambiental conocido como eutrofización acelerada, o envejecimiento prematuro de cuerpos de agua. Durante un periodo de muchos miles de años, un lago u otro cuerpo de agua acumulará lentamente elementos nutritivos esenciales como el nitrógeno o el fósforo debido a que sus compuestos se disuelven en arroyos que alimentan al lago. A medida que el agua se enriquece en nutrientes, pueden crecer más plantas y microorganismos. Parte de la materia orgánica que queda cuando estos organismos mueren precipita al fondo del lago y no se descompone. Eventualmente el lago se llena de escombros, convirtiéndose en pantano, y finalmente tierra seca.
Este proceso de eutrofización puede acelerarse en gran medida por el aporte humano de nutrientes como fertilizantes nitrogenados o de fósforo, o fosfatos de detergentes. Dado que la reducción en el uso de fosfatos detergentes parecería tener los efectos menos negativos (la ropa de la gente podría no verse tan limpia), muchos han sugerido que prohibir o limitar el contenido de fosfato es la forma de resolver el problema. Muchos estados han aprobado leyes que implementan tales limitaciones o prohibiciones.


