15.9: Catálisis
- Page ID
- 72794
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Entender cómo los catalizadores incrementan la velocidad de reacción y la selectividad de las reacciones químicas.
Los catalizadores son sustancias que incrementan la velocidad de reacción de una reacción química sin ser consumidas en el proceso. Un catalizador, por lo tanto, no aparece en la estequiometría global de la reacción que cataliza, sino que debe aparecer en al menos una de las reacciones elementales en el mecanismo para la reacción catalizada. La vía catalizada tiene un menor E a, pero el cambio neto en la energía que resulta de la reacción (la diferencia entre la energía de los reactivos y la energía de los productos) no se ve afectado por la presencia de un catalizador (Figura e\(\PageIndex{1}\)). Sin embargo, debido a su menor E a, la velocidad de reacción de una reacción catalizada es más rápida que la velocidad de reacción de la reacción no catalizada a la misma temperatura. Debido a que un catalizador disminuye la altura de la barrera de energía, su presencia aumenta las velocidades de reacción tanto de la reacción directa como de la inversa en la misma cantidad. En esta sección, examinaremos las tres clases principales de catalizadores: catalizadores heterogéneos, catalizadores homogéneos y enzimas.
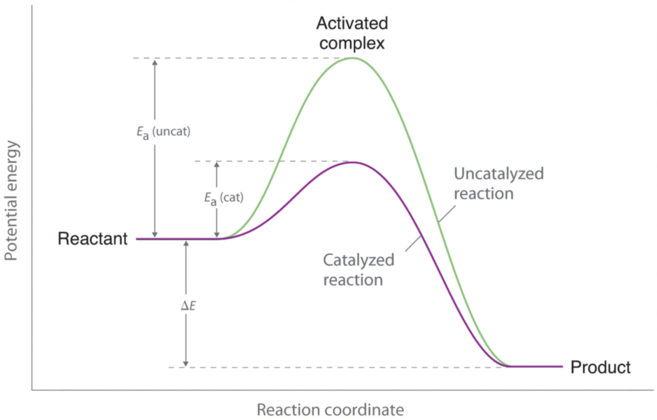
Un catalizador afecta a E a, no a Δ E.
Catálisis heterogénea
En catálisis heterogénea, el catalizador se encuentra en una fase diferente a la de los reactivos. Al menos uno de los reactivos interactúa con la superficie sólida en un proceso físico llamado adsorción de tal manera que un enlace químico en el reactivo se debilita y luego se rompe. Los venenos son sustancias que se unen irreversiblemente a los catalizadores, evitando que los reactivos se adsorban y, por lo tanto, reducen o destruyen la eficiencia del catalizador.
Un ejemplo de catálisis heterogénea es la interacción del gas hidrógeno con la superficie de un metal, como Ni, Pd o Pt. Como se muestra en la parte (a) de la Figura\(\PageIndex{2}\), los enlaces hidrógeno-hidrógeno se rompen y producen átomos de hidrógeno adsorbidos individuales en la superficie del metal. Debido a que los átomos adsorbidos pueden moverse en la superficie, dos átomos de hidrógeno pueden colisionar y formar una molécula de gas hidrógeno que luego puede salir de la superficie en el proceso inverso, llamado desorción. Los átomos de H adsorbidos en una superficie metálica son sustancialmente más reactivos que una molécula de hidrógeno. Debido a que el enlace H—H relativamente fuerte (energía de disociación = 432 kJ/mol) ya se ha roto, la barrera energética para la mayoría de las reacciones de H2 es sustancialmente menor en la superficie del catalizador.
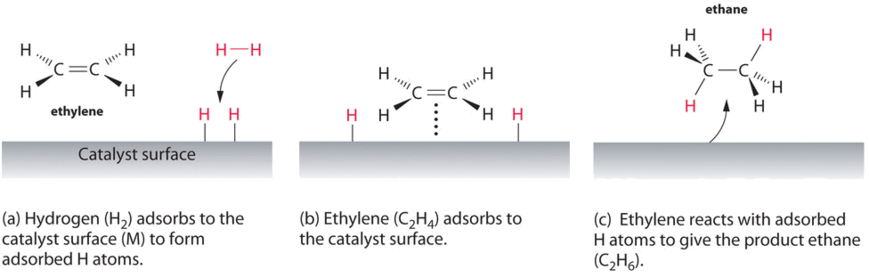
La figura\(\PageIndex{2}\) muestra un proceso denominado hidrogenación, en el que se añaden átomos de hidrógeno al doble enlace de un alqueno, como el etileno, para dar un producto que contiene enlaces sencillos C-C, en este caso etano. La hidrogenación se utiliza en la industria alimentaria para convertir los aceites vegetales, que consisten en cadenas largas de alquenos, en derivados sólidos más valiosos comercialmente que contienen cadenas alquílicas. La hidrogenación de algunos de los dobles enlaces en aceites vegetales poliinsaturados, por ejemplo, produce margarina, un producto con punto de fusión, textura y otras propiedades físicas similares a las de la mantequilla.
Varios ejemplos importantes de reacciones catalíticas heterogéneas industriales se encuentran en la Tabla\(\PageIndex{1}\). Aunque los mecanismos de estas reacciones son considerablemente más complejos que la simple reacción de hidrogenación aquí descrita, todos implican la adsorción de los reactivos sobre una superficie catalítica sólida, la reacción química de las especies adsorbidas (a veces a través de varias especies intermedias), y finalmente desorción de los productos de la superficie.
| Proceso Comercial | Catalizador | Reacción Inicial | Producto Comercial Final |
|---|---|---|---|
| proceso de contacto | V 2 O 5 o Pt | 2SO 2 + O 2 → 2SO 3 | H 2 SO 4 |
| Proceso Haber | Fe, K 2 O, Al 2 O 3 | N 2 + 3H 2 → 2NH 3 | NH 3 |
| Proceso de Ostwald | Pt y Rh | 4NH 3 + 5O 2 → 4NO + 6H 2 O | HNO 3 |
| reacción de cambio de agua-gas | Fe, Cr 2 O 3, o Cu | CO + H 2 O → CO 2 + H 2 | H 2 para NH 3, CH 3 OH y otros combustibles |
| reformado con vapor | Ni | CH 4 + H 2 O → CO + 3H 2 | H 2 |
| síntesis de metanol | ZnO y Cr 2 O 3 | CO + 2H 2 → CH 3 OH | CH 3 OH |
| Proceso Sohio | fosfomolibdato de bismuto | \(\mathrm{CH}_2\textrm{=CHCH}_3+\mathrm{NH_3}+\mathrm{\frac{3}{2}O_2}\rightarrow\mathrm{CH_2}\textrm{=CHCN}+\mathrm{3H_2O}\) | \(\underset{\textrm{acrylonitrile}}{\mathrm{CH_2}\textrm{=CHCN}}\) |
| hidrogenación catalítica | Ni, Pd o Pt | RCH=CHR′ + H2 → RCH 2 —CH 2 R′ | aceites parcialmente hidrogenados para margarina, y así sucesivamente |
Catálisis Homogénea
En catálisis homogénea, el catalizador se encuentra en la misma fase que el/los reactante (s). El número de colisiones entre los reactivos y el catalizador es máximo debido a que el catalizador se dispersa uniformemente por toda la mezcla de reacción. Muchos catalizadores homogéneos en la industria son compuestos de metales de transición (Tabla\(\PageIndex{2}\)), pero recuperar estos costosos catalizadores de la solución ha sido un desafío importante. Como barrera añadida a su uso comercial generalizado, muchos catalizadores homogéneos solo pueden usarse a temperaturas relativamente bajas, e incluso entonces tienden a descomponerse lentamente en solución. A pesar de estos problemas, en los últimos años se han desarrollado varios procesos comercialmente viables. El polietileno de alta densidad y el polipropileno son producidos por catálisis homogénea.
| Proceso Comercial | Catalizador | Reactivos | Producto Final |
|---|---|---|---|
| Carburo de unión | [Rh (CO) 2 I 2] − | CO + CH 3 OH | CH 3 CO 2 H |
| proceso de hidroperóxido | Complejos Mo (VI) | CH 3 CH=CH 2 + R—O—O—H | 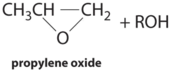 |
| hidroformilación | Complejos Rh/PR 3 | RCH=CH 2 + CO + H 2 | RCH 2 CH 2 CHO |
| proceso de adiponitrilo | Complejos Ni/PR 3 | 2HCN + CH 2 =CHCH=CH 2 | NCCH 2 CH 2 CH 2 CH 2 CN utilizado para sintetizar nylon |
| polimerización de olefinas | (RC 5 H 5) 2 ZrCl 2 | CH 2 =CH 2 | — (CH 2 CH 2 —) n: polietileno de alta densidad |
Enzimas
Las enzimas, catalizadores que ocurren naturalmente en los organismos vivos, son casi todas moléculas proteicas con masas moleculares típicas de 20.000—100,000 amu. Algunos son catalizadores homogéneos que reaccionan en solución acuosa dentro de un compartimento celular de un organismo. Otros son catalizadores heterogéneos incrustados dentro de las membranas que separan las células y los compartimentos celulares de sus alrededores. El reactivo en una reacción catalizada por enzimas se llama sustrato.
Debido a que las enzimas pueden aumentar las velocidades de reacción por factores enormes (hasta 10 17 veces la tasa no catalizada) y tienden a ser muy específicas, produciendo típicamente solo un solo producto en rendimiento cuantitativo, son el foco de la investigación activa. Al mismo tiempo, las enzimas suelen ser caras de obtener, a menudo dejan de funcionar a temperaturas superiores a 37 °C, tienen una estabilidad limitada en solución y tienen una especificidad tan alta que se limitan a convertir un conjunto particular de reactivos en un producto en particular. Esto significa que se deben desarrollar procesos separados que utilicen diferentes enzimas para reacciones químicamente similares, lo que lleva mucho tiempo y es costoso. Hasta ahora, las enzimas solo han encontrado aplicaciones industriales limitadas, aunque se utilizan como ingredientes en detergentes para ropa, limpiadores de lentes de contacto y ablandadores de carne. Las enzimas en estas aplicaciones tienden a ser proteasas, que son capaces de escindir los enlaces amida que mantienen unidos a los aminoácidos en las proteínas. Los ablandadores de carne, por ejemplo, contienen una proteasa llamada papaína, la cual se aísla del jugo de papaya. Escinde algunas de las moléculas proteicas largas y fibrosas que hacen duros los cortes económicos de carne de res, produciendo un trozo de carne que es más tierno. Algunos insectos, como el escarabajo más bombadiero, portan una enzima capaz de catalizar la descomposición del peróxido de hidrógeno en agua (Figura\(\PageIndex{3}\)).

Los inhibidores enzimáticos causan una disminución en la velocidad de reacción de una reacción catalizada por enzimas al unirse a una porción específica de una enzima y, por lo tanto, ralentizar o prevenir que ocurra una reacción. Los inhibidores irreversibles son por lo tanto el equivalente de venenos en catálisis heterogénea. Uno de los inhibidores enzimáticos comerciales más antiguos y más utilizados es la aspirina, que inhibe selectivamente una de las enzimas involucradas en la síntesis de moléculas que desencadenan la inflamación. El diseño y síntesis de moléculas relacionadas que sean más efectivas, selectivas y menos tóxicas que la aspirina son objetivos importantes de la investigación biomédica.
Resumen
Los catalizadores participan en una reacción química y aumentan su velocidad. No aparecen en la ecuación neta de la reacción y no se consumen durante la reacción. Los catalizadores permiten que una reacción proceda a través de una vía que tiene una energía de activación menor que la reacción no catalizada. En catálisis heterogénea, los catalizadores proporcionan una superficie a la que se unen los reactivos en un proceso de adsorción. En catálisis homogénea, los catalizadores están en la misma fase que los reactivos. Las enzimas son catalizadores biológicos que producen grandes aumentos en las velocidades de reacción y tienden a ser específicos para ciertos reactivos y productos. El reactivo en una reacción catalizada por enzimas se llama sustrato. Los inhibidores enzimáticos provocan una disminución en la velocidad de reacción de una reacción catalizada por enzimas.

