11.2: Electrolitos
- Page ID
- 75324
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Definir y dar ejemplos de electrolitos
- Distinguir entre los cambios físicos y químicos que acompañan a la disolución de electrolitos iónicos y covalentes
- Relacionar la resistencia del electrolito con las fuerzas de atracción soluto-disolvente
Cuando algunas sustancias se disuelven en agua, sufren ya sea un cambio físico o químico que produce iones en solución. Estas sustancias constituyen una importante clase de compuestos llamados electrolitos. Las sustancias que no producen iones cuando se disuelven se denominan no electrolitos. Si el proceso físico o químico que genera los iones es esencialmente 100% eficiente (todo el compuesto disuelto produce iones), entonces la sustancia se conoce como un electrolito fuerte. Si solo una fracción relativamente pequeña de la sustancia disuelta se somete al proceso de producción de iones, se le llama electrolito débil.
Las sustancias pueden identificarse como fuertes, débiles o no electrolitos midiendo la conductancia eléctrica de una solución acuosa que contiene la sustancia. Para conducir la electricidad, una sustancia debe contener especies cargadas libremente móviles. Lo más familiar es la conducción de electricidad a través de cables metálicos, en cuyo caso las entidades móviles cargadas son electrones. Las soluciones también pueden conducir electricidad si contienen iones disueltos, aumentando la conductividad a medida que aumenta la concentración de iones. Aplicar una tensión a electrodos sumergidos en una solución permite evaluar la concentración relativa de iones disueltos, ya sea cuantitativamente, midiendo el flujo de corriente eléctrica, o cualitativamente, observando el brillo de una bombilla incluida en el circuito (Figura\(\PageIndex{1}\)).
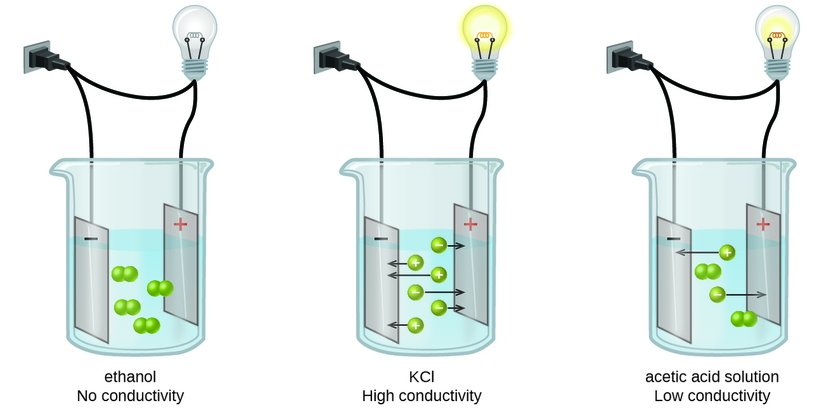
Electrolitos Ionicos
El agua y otras moléculas polares son atraídas por los iones, como se muestra en la Figura\(\PageIndex{2}\). La atracción electrostática entre un ion y una molécula con un dipolo se llama atracción ión-dipolo. Estas atracciones juegan un papel importante en la disolución de compuestos iónicos en el agua.
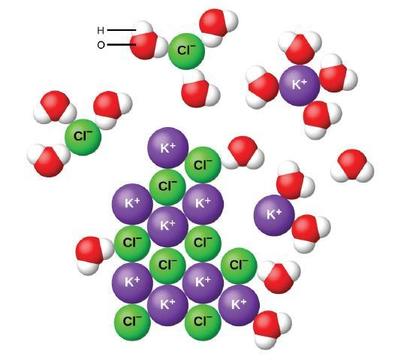
Cuando los compuestos iónicos se disuelven en agua, los iones en el sólido se separan y se dispersan uniformemente por toda la solución debido a que las moléculas de agua rodean y solvatan los iones, reduciendo las fuertes fuerzas electrostáticas entre ellos. Este proceso representa un cambio físico conocido como disociación. En la mayoría de las condiciones, los compuestos iónicos se disociarán casi por completo cuando se disuelven, por lo que se clasifican como electrolitos fuertes.
Consideremos lo que sucede a nivel microscópico cuando agregamos KCl sólido al agua. Las fuerzas ión-dipolo atraen el extremo positivo (hidrógeno) de las moléculas polares de agua a los iones cloruro negativos en la superficie del sólido, y atraen los extremos negativos (oxígeno) a los iones de potasio positivos. Las moléculas de agua penetran entre los iones K + y Cl − individuales y los rodean, reduciendo las fuertes fuerzas interiónicas que unen los iones entre sí y dejándolos pasar a la solución como iones solvatados, como muestra la Figura. La reducción de la atracción electrostática permite el movimiento independiente de cada ion hidratado en una solución diluida, resultando en un aumento en el desorden del sistema a medida que los iones cambian de sus posiciones fijas y ordenadas en el cristal a estados móviles y mucho más desordenados en solución. Este trastorno incrementado es responsable de la disolución de muchos compuestos iónicos, entre ellos KCl, que se disuelven con la absorción de calor.
En otros casos, las atracciones electrostáticas entre los iones en un cristal son tan grandes, o las fuerzas de atracción ión-dipolo entre los iones y las moléculas de agua son tan débiles, que el aumento del desorden no puede compensar la energía requerida para separar los iones, y el cristal es insoluble. Tal es el caso de compuestos como el carbonato de calcio (piedra caliza), el fosfato de calcio (el componente inorgánico del hueso) y el óxido de hierro (óxido).
Electrolitos Covalentes
El agua pura es un conductor extremadamente pobre de la electricidad porque solo está muy ligeramente ionizada, solo alrededor de dos de cada mil millones de moléculas ionizan a 25 °C. El agua se ioniza cuando una molécula de agua cede un protón a otra molécula de agua, produciendo iones hidronio e hidróxido.
\[\ce{H_2O (l)+ H_2O (l) \rightleftharpoons H_3O^{+} (aq) + OH^{−} (aq)} \label{11.3.2} \]
En algunos casos, encontramos que las soluciones preparadas a partir de compuestos covalentes conducen electricidad porque las moléculas de soluto reaccionan químicamente con el disolvente para producir iones. Por ejemplo, el cloruro de hidrógeno puro es un gas que consiste en moléculas covalentes de HCl. Este gas no contiene iones. Sin embargo, cuando disolvemos el cloruro de hidrógeno en agua, encontramos que la solución es un muy buen conductor. Las moléculas de agua juegan un papel esencial en la formación de iones: Las soluciones de cloruro de hidrógeno en muchos otros solventes, como el benceno, no conducen electricidad y no contienen iones.
El cloruro de hidrógeno es un ácido, por lo que sus moléculas reaccionan con el agua, transfiriendo iones H + para formar iones hidronio (\(H_3O^+\)) e iones cloruro (Cl −):
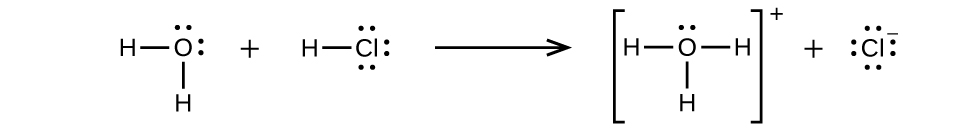
Esta reacción es esencialmente 100% completa para HCl (es decir, es un ácido fuerte y, en consecuencia, un electrolito fuerte). Asimismo, los ácidos y bases débiles que solo reaccionan parcialmente generan concentraciones relativamente bajas de iones cuando se disuelven en agua y se clasifican como electrolitos débiles. El lector tal vez desee revisar la discusión sobre los ácidos fuertes y débiles proporcionada en el capítulo anterior de este texto sobre clases de reacción y estequiometría.
Resumen
Las sustancias que se disuelven en el agua para producir iones se llaman electrolitos. Los electrolitos pueden ser compuestos covalentes que reaccionan químicamente con el agua para producir iones (por ejemplo, ácidos y bases), o pueden ser compuestos iónicos que se disocian para producir sus cationes y aniones constituyentes, cuando se disuelven. La disolución de un compuesto iónico se ve facilitada por las atracciones ión-dipolo entre los iones del compuesto y las moléculas polares de agua. Las sustancias iónicas solubles y los ácidos fuertes se ionizan completamente y son electrolitos fuertes, mientras que los ácidos y bases débiles se ionizan solo en pequeña medida y son electrolitos débiles. Los no electrolitos son sustancias que no producen iones cuando se disuelven en agua.
Glosario
- disociación
- proceso físico que acompaña a la disolución de un compuesto iónico en el que los iones constituyentes del compuesto están solvatados y dispersos por toda la solución
- electrolito
- sustancia que produce iones cuando se disuelve en agua
- atracción ion-dipolo
- atracción electrostática entre un ion y una molécula polar
- no electrolítico
- sustancia que no produce iones cuando se disuelve en agua
- electrolito fuerte
- sustancia que se disocia o ioniza completamente cuando se disuelve en agua
- electrolito débil
- sustancia que se ioniza solo parcialmente cuando se disuelve en agua


