20.E: Química Orgánica (Ejercicios)
- Page ID
- 75193
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)20.1: Hidrocarburos
Q20.1.1
Escribe la fórmula química y la estructura de Lewis de lo siguiente, cada uno de los cuales contiene cinco átomos de carbono:
- un alcano
- un alqueno
- un alquino
S20.1.1
Hay varios conjuntos de respuestas; una es:
a) C 5 H 12
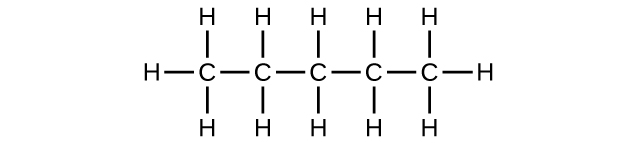
b) C 5 H 10
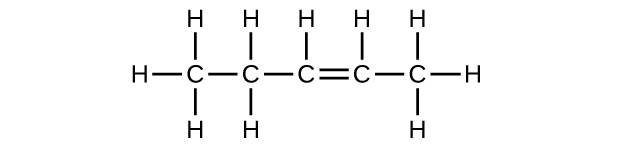
c) C 5 H 8
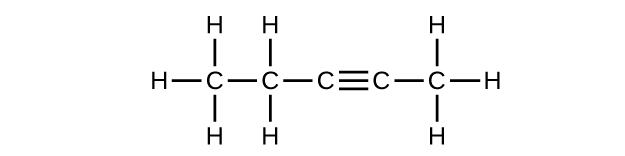
Q20.1.2
¿Cuál es la diferencia entre la hibridación de orbitales de valencia de átomos de carbono en hidrocarburos saturados e insaturados?
Q20.1.3
A nivel microscópico, ¿en qué se diferencia la reacción del bromo con un hidrocarburo saturado de su reacción con un hidrocarburo insaturado? ¿Cómo son similares?
Q20.1.4
Ambas reacciones dan como resultado que el bromo se incorpore a la estructura del producto. La diferencia es la forma en que se lleva a cabo esa incorporación. En el hidrocarburo saturado, se rompe un enlace C-H existente, y luego se puede formar un enlace entre el C y el Br. En el hidrocarburo insaturado, el único enlace roto en el hidrocarburo es el enlace π cuyos electrones pueden usarse para formar un enlace a uno de los átomos de bromo en Br 2 (los electrones del enlace Br-Br forman el otro enlace C—Br en el otro carbono que formaba parte del enlace π en el insaturado de partida hidrocarburo).
Q20.1.5
A nivel microscópico, ¿en qué se diferencia la reacción del bromo con un alqueno de su reacción con un alquino? ¿Cómo son similares?
Q20.1.6
Explica por qué los alquenos no ramificados pueden formar isómeros geométricos mientras que los alcanos no ramificados ¿Esta explicación involucra el dominio macroscópico o el dominio microscópico?
S20.1.6
Los alcanos no ramificados tienen rotación libre alrededor de los enlaces C-C, lo que produce todas las orientaciones de los sustituyentes alrededor de estos enlaces equivalentes, intercambiables por rotación. En los alquenos no ramificados, la incapacidad de rotar alrededor del\(\mathrm{C=C}\) enlace da como resultado orientaciones fijas (invariables) de los sustituyentes, permitiendo así diferentes isómeros. Dado que estos conceptos pertenecen a fenómenos a nivel molecular, esta explicación involucra el dominio microscópico.
Explique por qué estas dos moléculas no son isómeros:
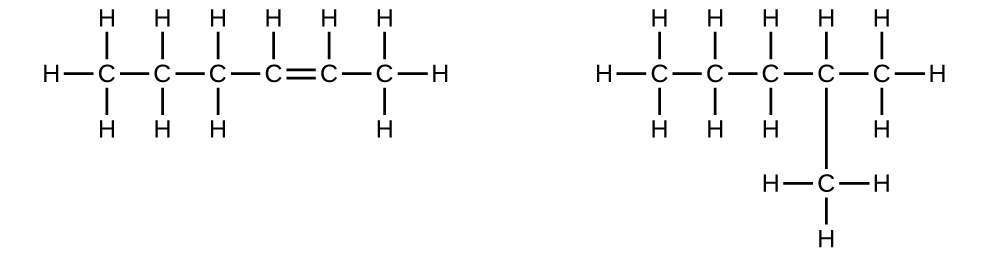
Q20.1.7
Explique por qué estas dos moléculas no son isómeros:
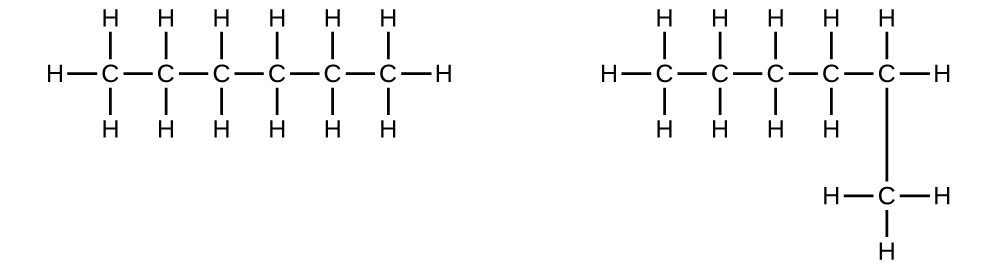
S20.1.6
Son el mismo compuesto porque cada uno es un hidrocarburo saturado que contiene una cadena no ramificada de seis átomos de carbono.
Q20.1.7
¿Cómo cambia la hibridación carbono-átomo cuando se prepara polietileno a partir de etileno?
Q20.1.8
Escriba la estructura de Lewis y la fórmula molecular para cada uno de los siguientes hidrocarburos:
- hexano
- 3-metilpentano
- cis-3-hexeno
- 4-metil-1-penteno
- 3-hexina
- 4-metil-2-pentino
Q20.1.9
a) C 6 H 14
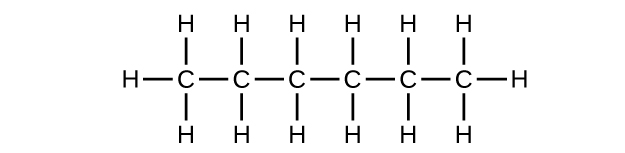
b) C 6 H 14

c) C 6 H 12
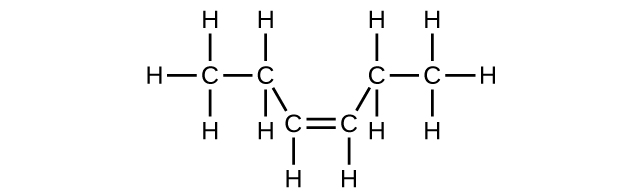
d) C 6 H 12
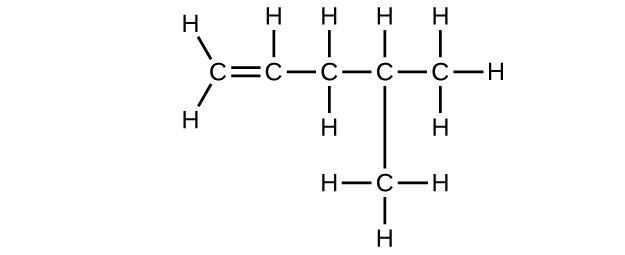
e) C 6 H 10
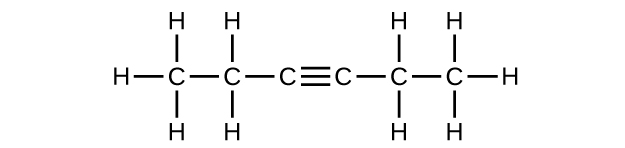
f) C 6 H 10
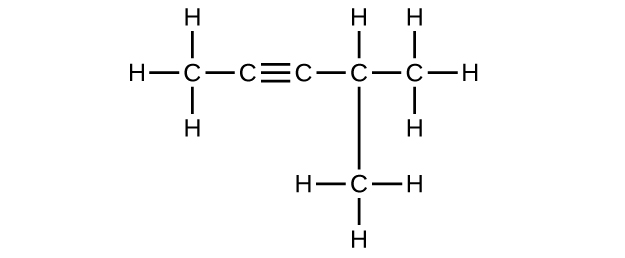
Q20.1.10
Escriba la fórmula química, la fórmula condensada y la estructura de Lewis para cada uno de los siguientes hidrocarburos:
- heptano
- 3-metilhexano
- trans -3-hepteno
- 4-metil-1-hexeno
- 2-heptino
- 3,4-dimetil-1-pentino
Q20.1.11
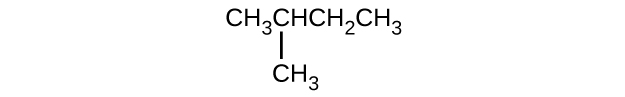
Dé el nombre completo de la IUPAC para cada uno de los siguientes compuestos:
- CH 3 CH 2 CbR 2 CH 3
- (CH 3) 3 CCl
- \ (\ mathrm {CH_3CH_2C=CH\, CH_3CH_2C=CH}\
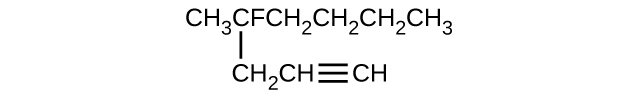

- \(\mathrm{(CH_3)_2CHCH_2CH=CH_2}\)
S20.1.11
(a) 2,2-dibromobutano; (b) 2-cloro-2-metilpropano; (c) 2-metilbutano; (d) 1-butino; (e) 4-fluoro-4-metil-1-octina; (f) trans-1-cloropropeno; (g) 5-metil-1-penteno
Q20.1.12
Dé el nombre completo de la IUPAC para cada uno de los siguientes compuestos:
- (CH 3) 2 CHF
- CH 3 CHCLCHClCH 3
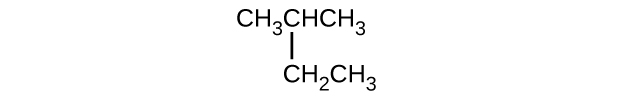
- \(\mathrm{CH_3CH_2CH=CHCH_3}\)
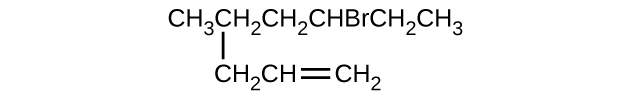
- \(\mathrm{(CH_3)_3CCH_2C≡CH}\)
Q20.1.13
El butano se utiliza como combustible en encendedores desechables. Escribe la estructura de Lewis para cada isómero de butano.
S20.1.13
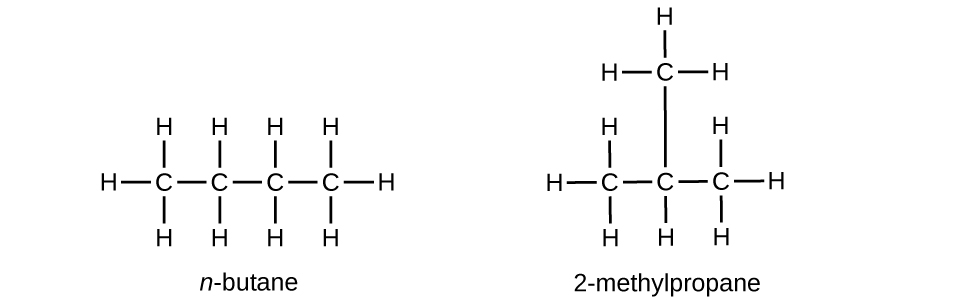
Q20.1.14
Escribe las estructuras de Lewis y nombra los cinco isómeros estructurales del hexano.
Q20.1.15
Escriba estructuras de Lewis para los isómeros cis-trans de\(\mathrm{CH_3CH=CHCl}\).
S20.1.15
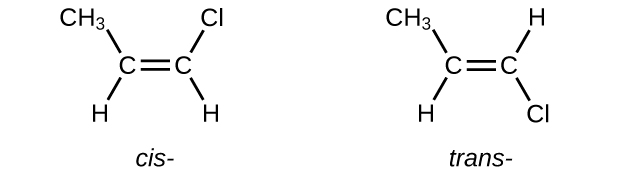
Q20.1.16
Escribir estructuras para los tres isómeros del hidrocarburo aromático xileno, C 6 H 4 (CH 3) 2.
Q20.1.17
Isooctano es el nombre común del isómero de C 8 H 18 utilizado como el estándar de 100 para el índice de octano de gasolina:
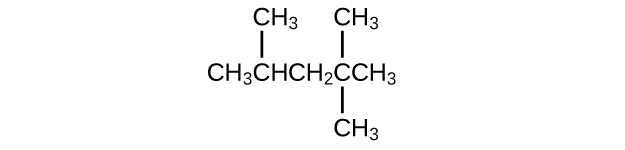
- ¿Cuál es el nombre de la IUPAC para el compuesto?
- Nombrar los otros isómeros que contienen una cadena de cinco carbonos con tres sustituyentes metilo.
Q20.1.18
a) 2,2,4-trimetilpentano; b) 2,2,3-trimetilpentano, 2,3,4-trimetilpentano y 2,3,3-trimetilpentano:
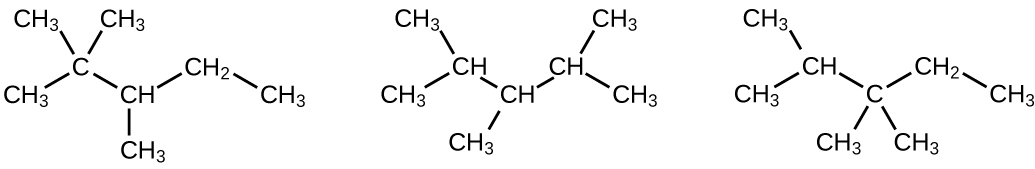
Q20.1.19
Escriba las estructuras de Lewis y los nombres de la IUPAC para los isómeros alquinos de C 4 H 6.
Q20.1.20
Escriba las estructuras de Lewis y los nombres de la IUPAC para todos los isómeros de C 4 H 9 Cl.
S20.1.20
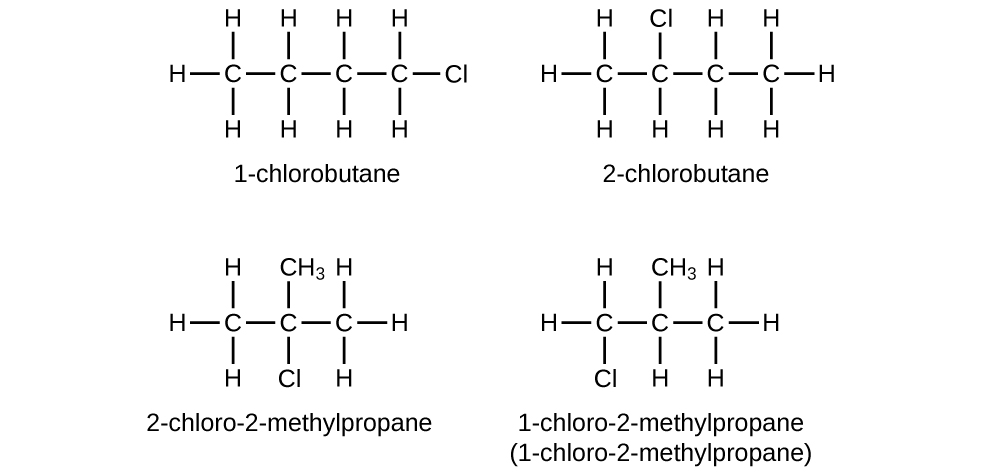
Q20.1.21
Nombra y escribe las estructuras de todos los isómeros de los grupos propil y butil alquilo.
Q20.1.22
Escriba las estructuras para todos los isómeros del grupo alquilo —C 5 H 11.
Q20.1.23
A continuación, la cadena principal de carbono y el número apropiado de átomos de hidrógeno se muestran en forma condensada:
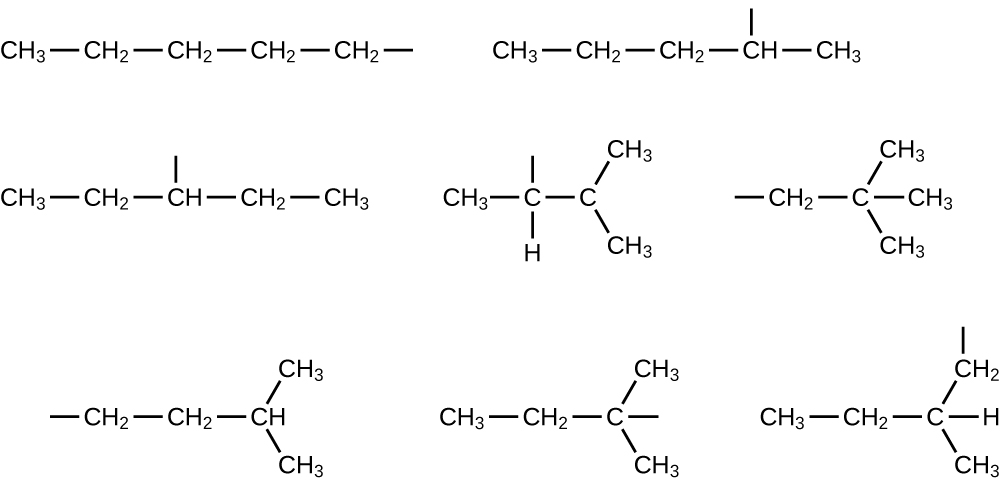
Q20.1.24
Escriba las estructuras de Lewis y describa la geometría molecular en cada átomo de carbono en los siguientes compuestos:
- cis-3-hexeno
- cis -1-cloro-2-bromoeteno
- 2-pentino
- trans - 6-etil-7-metil-2-octeno
Q20.1.25
El benceno es uno de los compuestos utilizados como potenciador del octano en la gasolina sin plomo. Se fabrica mediante la conversión catalítica de acetileno a benceno:
\[\ce{3C2H2 ⟶ C6H6}\]
Dibujar estructuras de Lewis para estos compuestos, con estructuras de resonancia según corresponda, y determinar la hibridación de los átomos de carbono en cada uno.
S20.1.25
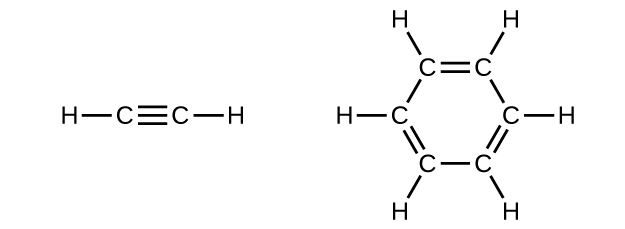
Q20.1.26
En acetileno, el enlace utiliza híbridos sp en átomos de carbono y orbitales s en átomos de hidrógeno. En benceno, los átomos de carbono son sp 2 hibridados.
Q20.1.27
El teflón se prepara mediante la polimerización de tetrafluoroetileno. Escribe la ecuación que describe la polimerización usando símbolos de Lewis.
Q20.1.28
Escribe dos ecuaciones completas y equilibradas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis.
- 1 mol de 1-butino reacciona con 2 mol de yodo.
- El pentano se quema en el aire.
S20.1.28
(a)\(\mathrm{CH=CCH_2CH_3 + 2I_2⟶ CHI_2CI_2CH_2CH_3}\)
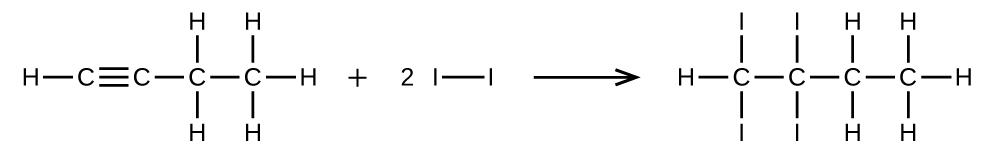
b)\(\ce{CH3CH2CH2CH2CH3 + 8O2 ⟶ 5CO2 + 6H2O}\)
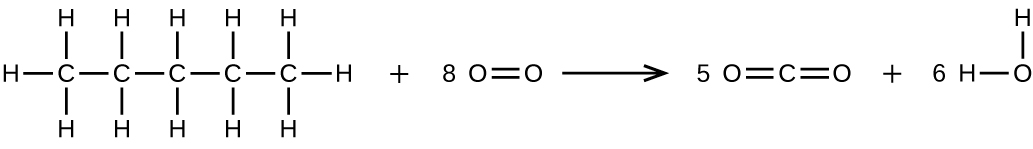
Q20.1.29
Escribe dos ecuaciones completas y equilibradas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis.
- El 2-buteno reacciona con el cloro.
- el benceno se quema en el aire.
Q20.1.30
¿Qué masa de 2-bromopropano se podría preparar a partir de 25.5 g de propeno? Asumir un rendimiento del 100% de producto.
S20.1.30
65.2 g
Q20.1.31
El acetileno es un ácido muy débil; sin embargo, reaccionará con óxido húmedo de plata (I) y formará agua y un compuesto compuesto por plata y carbono. La adición de una solución de HCl a una muestra de 0.2352-g del compuesto de plata y carbono produjo acetileno y 0.2822 g de AgCl.
- ¿Cuál es la fórmula empírica del compuesto de plata y carbono?
- La producción de acetileno por adición de HCl al compuesto de plata y carbono sugiere que el carbono está presente como el ion acetiliuro,\(\ce{C2^2-}\). Escriba la fórmula del compuesto que muestre el ion acetilido.
Q20.1.32
El etileno puede ser producido por la pirólisis de etano:
\(\ce{C2H6⟶C2H4 + H2}\)
¿Cuántos kilogramos de etileno se producen por la pirólisis de 1.000 × 10 3 kg de etano, asumiendo un rendimiento del 100.0%?
S20.1.33
9.328 × 10 2 kg
20.2: Alcoholes y Éteres
¿Por qué los compuestos hexano, hexanol y hexeno tienen nombres similares?
Escriba fórmulas condensadas y proporcione nombres IUPAC para los siguientes compuestos:
- a) alcohol etílico (en bebidas)
- b) alcohol metílico (utilizado como disolvente, por ejemplo, en goma laca)
- c) etilenglicol (anticongelante)
- d) alcohol isopropílico (utilizado en alcohol para frotar)
- e) glicerina
(a) alcohol etílico, etanol: CH 3 CH 2 OH; (b) alcohol metílico, metanol: CH 3 OH; (c) etilenglicol, etandiol: HOCH 2 CH 2 OH; (d) alcohol isopropílico, 2-propanol: CH 3 CH (OH) CH 3; (e) glicerina, l,2,3-trihidroxipropano: HOCH 2 CH (OH) CH 2 OH
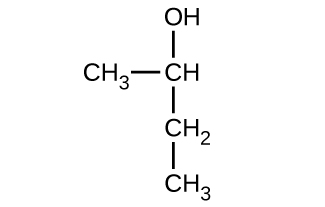
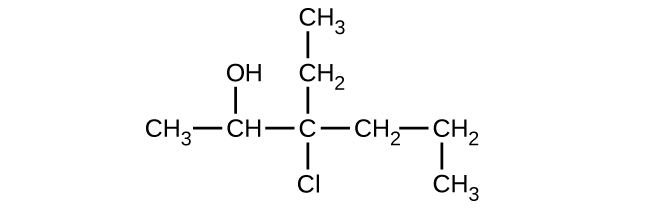
Dé el nombre completo de la IUPAC para cada uno de los siguientes compuestos:
a)
b)
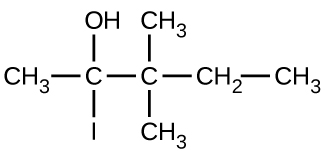
c)
Dé el nombre completo de la IUPAC y el nombre común para cada uno de los siguientes compuestos:
a)
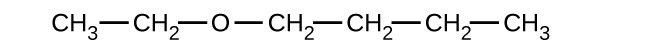
b)
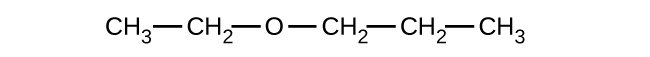
c)

(a) 1-etoxibutano, butil etil éter; (b) 1-etoxipropano, etil propil éter; (c) 1-metoxipropano, metil propil éter
Escribir las estructuras condensadas de ambos isómeros con la fórmula C 2 H 6 O. Marcar el grupo funcional de cada isómero.
Escribir las estructuras condensadas de todos los isómeros con la fórmula C 2 H 6 O 2. Marcar el grupo funcional (o grupos) de cada isómero.
HOCH 2 CH 2 OH, dos grupos alcohol; CH 3 OCH 2 OH, grupos éter y alcohol
Dibuje las fórmulas condensadas para cada uno de los siguientes compuestos:
- (a) éter dipropilo
- b) 2,2-dimetil-3-hexanol
- c) 2-etoxibutano
MTBE, metil terc - butil éter, CH 3 OC (CH 3) 3, se utiliza como fuente de oxígeno en gasolinas oxigenadas. MTBE se fabrica haciendo reaccionar 2-metilpropeno con metanol.
- (a) Usando estructuras de Lewis, escribir la ecuación química que representa la reacción.
- b) ¿Qué volumen de metanol, densidad 0.7915 g/mL, se requiere para producir exactamente 1000 kg de MTBE, asumiendo un rendimiento del 100%?
a)
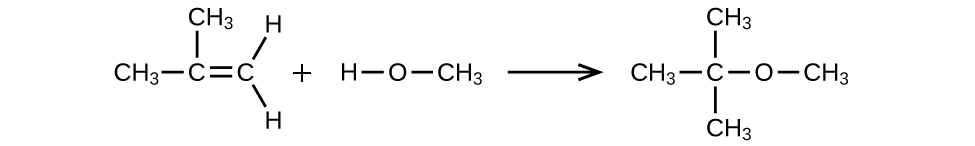
(b) 4.593 × 10 2 L
Escribe dos ecuaciones equilibradas completas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis.
(a) el propanol se convierte en éter dipropílico
b) el propeno se trata con agua en ácido diluido.
Escribe dos ecuaciones equilibradas completas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis.
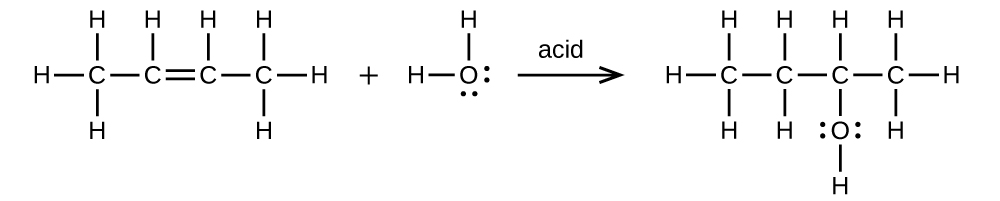
- (a) El 2-buteno se trata con agua en ácido diluido
- (b) el etanol se deshidrata para producir eteno
(a)\(\mathrm{CH_3CH=CHCH_3+H_2O⟶CH_3CH_2CH(OH)CH_3}\)
;
b)\(\mathrm{CH_3CH_2OH⟶CH_2=CH_2+H_2O}\)
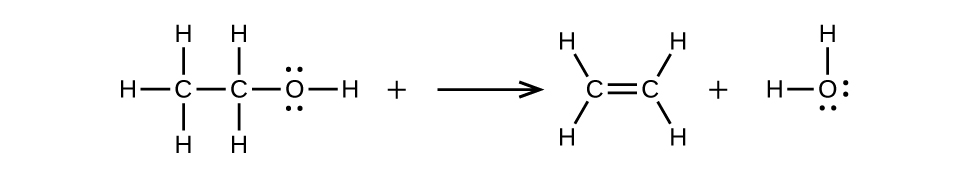
20.3: Aldehídos, Cetonas, Ácidos Carboxílicos y Ésteres
Q20.3.1
Ordene las siguientes moléculas de menor a mayor oxidado, basado en el átomo de carbono marcado:
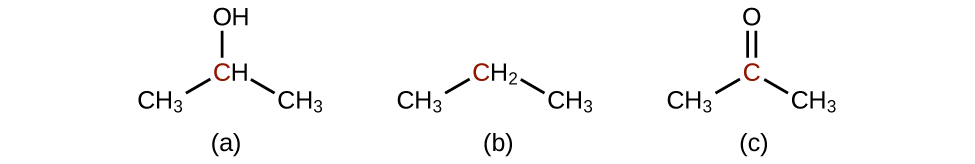
Q20.3.2
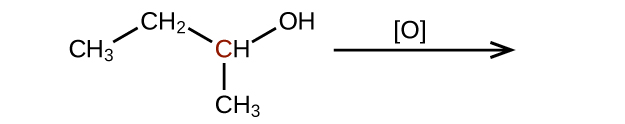
Predecir los productos de oxidación de las moléculas mostradas en este problema. En cada caso, identifique el producto que resultará del incremento mínimo en el estado de oxidación para el átomo de carbono resaltado:
a)
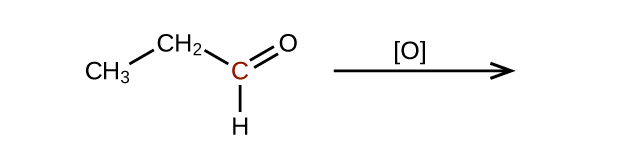
b)

c)
a)
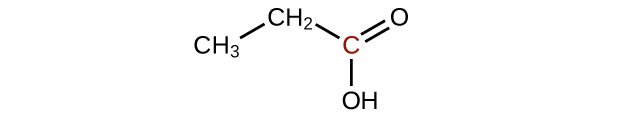
b)
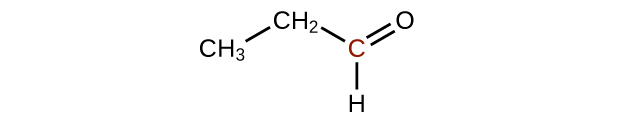
c)
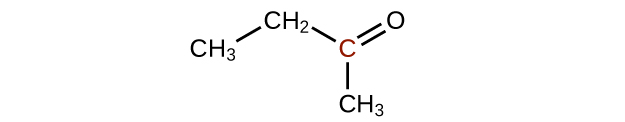
Q20.3.3
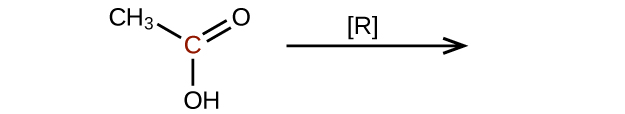
Predecir los productos de reducir las siguientes moléculas. En cada caso, identificar el producto que resultará de la disminución mínima en el estado de oxidación para el átomo de carbono resaltado:
a)
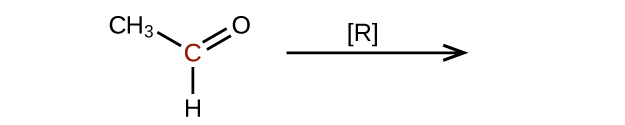
b)
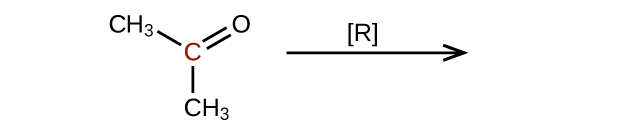
c)
Q20.3.4
Explique por qué no es posible preparar una cetona que contenga sólo dos átomos de carbono.
S20.3.4
Una cetona contiene un grupo unido a dos átomos de carbono adicionales; así, se necesita un mínimo de tres átomos de carbono.
Q20.3.5
¿Cómo cambia la hibridación del átomo de carbono sustituido cuando un alcohol se convierte en aldehído? ¿Un aldehído a un ácido carboxílico?
Q20.3.6
Los ácidos grasos son ácidos carboxílicos que tienen largas cadenas hidrocarbonadas unidas a un grupo carboxilato. ¿En qué se diferencia un ácido graso saturado de un ácido graso insaturado? ¿Cómo son similares?
S20.3.6
Al ser ambos ácidos carboxílicos, cada uno contiene el grupo funcional —COOH y sus características. La diferencia es que la cadena hidrocarbonada en un ácido graso saturado no contiene dobles o triples enlaces, mientras que la cadena hidrocarbonada en un ácido graso insaturado contiene uno o más enlaces múltiples.
S20.3.7
Escriba una fórmula estructural condensada, como CH 3 CH 3, y describa la geometría molecular en cada átomo de carbono.
- propeno
- 1-butanol
- éter etílico propilo
- cis -4-bromo-2-hepteno
- 2,2,3-trimetilhexano
- formaldehído
Q20.3.8
Escriba una fórmula estructural condensada, como CH 3 CH 3, y describa la geometría molecular en cada átomo de carbono.
- 2-propanol
- acetona
- éter dimetílico
- ácido acético
- 3-metil-1-hexeno
S20.3.8
(a) CH 3 CH (OH) CH 3: todos los carbonos son tetraédricos; (b)\(\ce{CH3C(==O)CH3}\): los carbonos finales son tetraédricos y el carbono central es plano trigonal; (c) CH 3 OCH 3: todos son tetraédricos; (d) CH 3 COOH: el carbono metílico es tetraédrico y el carbono ácido es plano trigonal; (e) CH 3 CH 2 CH 2 CH (CH 3) CHCH 2: todos son tetraédricos excepto los dos carbonos más a la derecha, que son planos trigonales
Q20.3.9
El mal olor de la mantequilla rancia es causado por el ácido butírico, CH 3 CH 2 CH 2 CO 2 H.
- Dibujar la estructura de Lewis y determinar el número de oxidación e hibridación para cada átomo de carbono en la molécula.
- Los ésteres formados a partir del ácido butírico son compuestos de olor agradable que se encuentran en las frutas y se utilizan en perfumes. Dibujar la estructura de Lewis para el éster formado a partir de la reacción del ácido butírico con 2-propanol.
Q20.3.10
Escribe las estructuras de dos resonancias para el ion acetato.
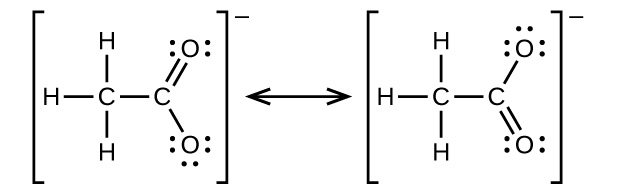
Q20.3.11
Escribe dos ecuaciones completas y equilibradas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis:
- el etanol reacciona con el ácido propiónico
- ácido benzoico, C 6 H 5 CO 2 H, se añade a una solución de hidróxido de sodio
Q20.3.12
Escribe dos ecuaciones equilibradas completas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis.
- 1-butanol reacciona con ácido acético
- El ácido propiónico se vierte sobre carbonato de calcio sólido
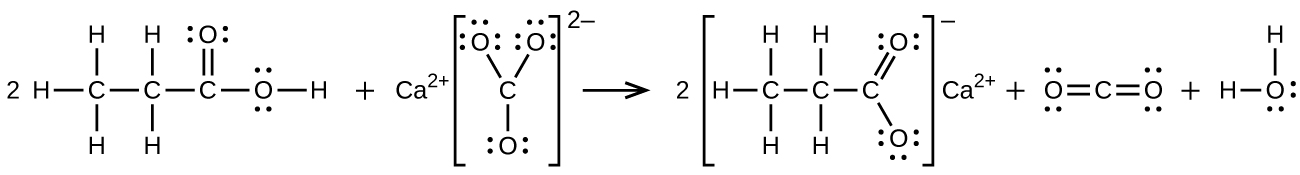
S20.3.12
a)\(\ce{CH3CH2CH2CH2OH + CH3C(O)OH⟶CH3C(O)OCH2CH2CH2CH3 + H2O}\):
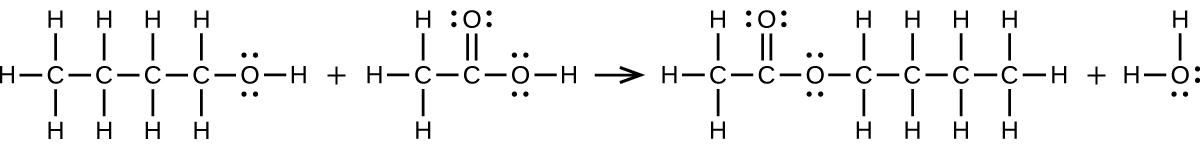
b)\(\ce{2CH3CH2COOH + CaCO3⟶(CH3CH2COO)2Ca + CO2 + H2O}\):
Q20.3.13
Los rendimientos en las reacciones orgánicas son a veces bajos. ¿Cuál es el rendimiento porcentual de un proceso que produce 13.0 g de acetato de etilo a partir de 10.0 g de CH 3 CO 2 H?
Q20.3.14
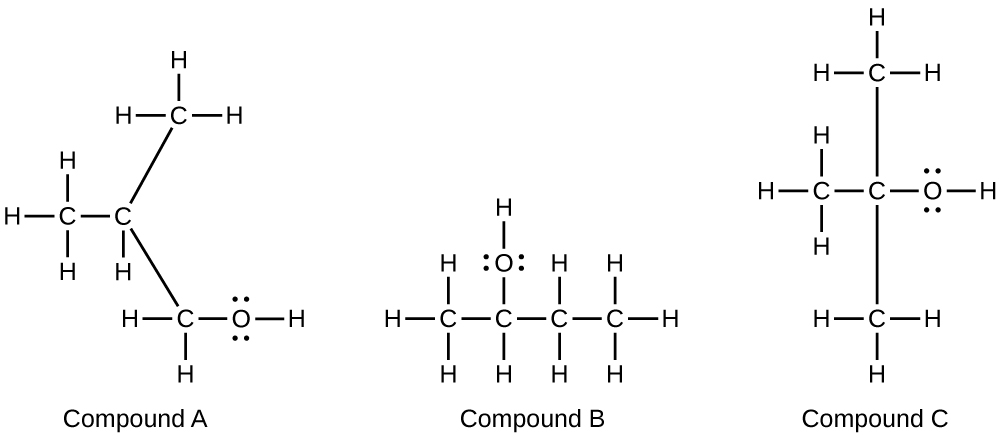
Los alcoholes A, B y C tienen todos la composición C 4H 10 O. Las moléculas de alcohol A contienen una cadena carbonada ramificada y pueden oxidarse a un aldehído; las moléculas de alcohol B contienen una cadena carbonada lineal y pueden oxidarse a una cetona; y las moléculas de alcohol C pueden oxidarse a ninguna un aldehído ni una cetona. Escribe las estructuras de Lewis de estas moléculas.
S20.3.15
20.4: Aaminas y Amidas
Q20.4.1
Escribe las estructuras de Lewis de ambos isómeros con la fórmula C 2 H 7 N.
Q20.4.2
¿Cuál es la estructura molecular del átomo de nitrógeno en la trimetilamina y en el ion trimetilamonio, (CH 3) 3 NH +? ¿Cuál es la hibridación del átomo de nitrógeno en la trimetilamina y en el ion trimetilamonio?
S20.4.2
Trimetilamina: piramidal trigonal, sp 3; ion trimetilamonio: tetraédrico, sp 3
Q20.4.3
Escribe las dos estructuras de resonancia para el ion piridinio, C 5 H 5 NH +.
Q20.4.4
Dibujar estructuras de Lewis para piridina y su ácido conjugado, el ion piridinio, C 5 H 5 NH +. ¿Cuáles son las geometrías e hibridaciones sobre los átomos de nitrógeno en la piridina y en el ion piridinio?
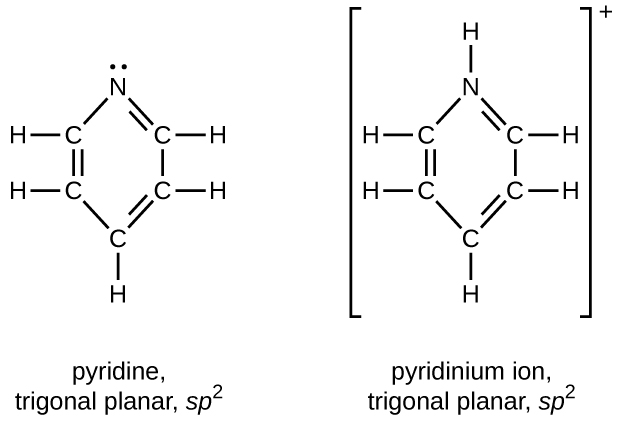
Q20.4.5
Escribir las estructuras de Lewis de todos los isómeros con la fórmula C 3 H 7 ON que contengan un enlace amida.
Q20.4.6
Escribe dos ecuaciones equilibradas completas para la siguiente reacción, una usando fórmulas condensadas y otra usando estructuras de Lewis.
- Se agrega metilamina a una solución de HCl.
S20.4.6
\[\ce{CH3NH2 + H3O+ ⟶CH3NH3+ + H2O}\]
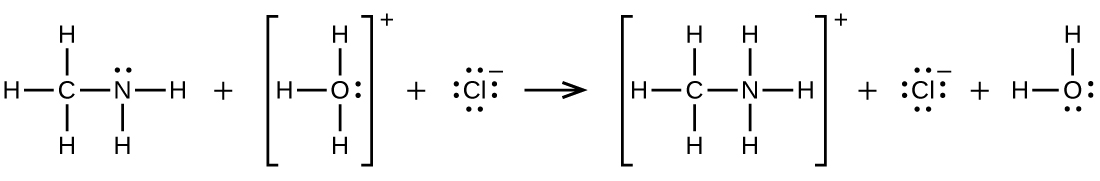
Q20.4.7
Escribe dos ecuaciones completas y equilibradas para cada una de las siguientes reacciones, una usando fórmulas condensadas y otra usando estructuras de Lewis.
Se agrega cloruro de etilamonio a una solución de hidróxido de sodio.
Q20.4.8
Identificar cualquier átomo de carbono que cambie la hibridación y el cambio en la hibridación durante las reacciones en [link].
S20.4.8
CH 3 CH = CHCH 3 (sp 2) + Cl\(⟶\) CH 3 CH (Cl) H (Cl) CH 3 (sp 3);
2C 6 H 6 (sp 2) + 15O 2\(⟶\) 12CO 2 (sp) + 6H 2 O
Q20.4.9
Identificar cualquier átomo de carbono que cambie la hibridación y el cambio en la hibridación durante las reacciones en [link].
Q20.4.10
Identificar cualquier átomo de carbono que cambie la hibridación y el cambio en la hibridación durante las reacciones en [link].
S20.4.10
el carbono en CO 3 2−, inicialmente en sp 2, cambia la hibridación a sp en CO 2


