12.4.5: El Efecto Quelato Cinético
- Page ID
- 81517
Se discutió el aumento de la estabilidad termodinámica de los ligandos quelantes en una sección previa sobre el efecto quelato (Sección 10.1.1). Este beneficio termodinámico está relacionado con un cambio en la tasa de eventos de unión y disociación llamado efecto quelato cinético. Este efecto también se mencionó anteriormente en este capítulo (Sección 12.2.2).
Recordemos que existe una relación entre la constante de equilibrio y las constantes de velocidad de cualquier reacción química. La relación se demuestra a continuación para una reacción general.
\[aA+bB \rightleftharpoons cC+dD \nonumber \]
\[\text{forward rate} = k_f[A]^a [B]^b \nonumber \]
\[\text{reverse rate} = k_r[C]^c [D]^d \nonumber \]
En equilibrio, la velocidad de las reacciones hacia adelante es igual a la velocidad de la reacción inversa. Por lo tanto:
\[ \text{forward rate} = \text{reverse rate} \nonumber \]
\[k_f[A]^a [B]^b = k_r[C]^c [D]^d \nonumber \]
La reorganización de la ecuación anterior da:
\[\dfrac{k_f}{k_r}=\dfrac{[C]^c [D]^d }{[A]^a [B]^b } = K_{eq} \nonumber \]
Debido a\(K_{eq}\) que los ligandos quelantes tienen valores mayores que los ligandos monodentados análogos, también debe haber un cambio en las velocidades relativas de las reacciones directa (unión) e inversa (disociación). De hecho, existe un beneficio cinético que hace que un metal unido a un ligando polidentado sea más inerte que el complejo análogo con ligandos monodentados: esto se denomina efecto quelato cinético.
El efecto cinético del quelato es el resultado de una primera etapa de disociación más lenta y una etapa de reasociación más rápida en relación con la de un ligando monodentado. La disociación completa de un ligando bidentado, por ejemplo, requeriría dos etapas de disociación (ver primera reacción en la figura a continuación). Es la primera etapa de disociación que es más lenta en un ligando bidentado (\(k_1 < k'_1\)en la figura a continuación). Esta primera etapa de disociación es más lenta en parte porque el quelato tendría que rotar para alejar el ligando libre del sitio de coordenadas abiertas en el ión metálico. Por la misma razón, lo inverso de esta etapa (asociación) es más rápido que la asociación de un ligando monodentado (\(k_{-1} > k'_{-1}\)).
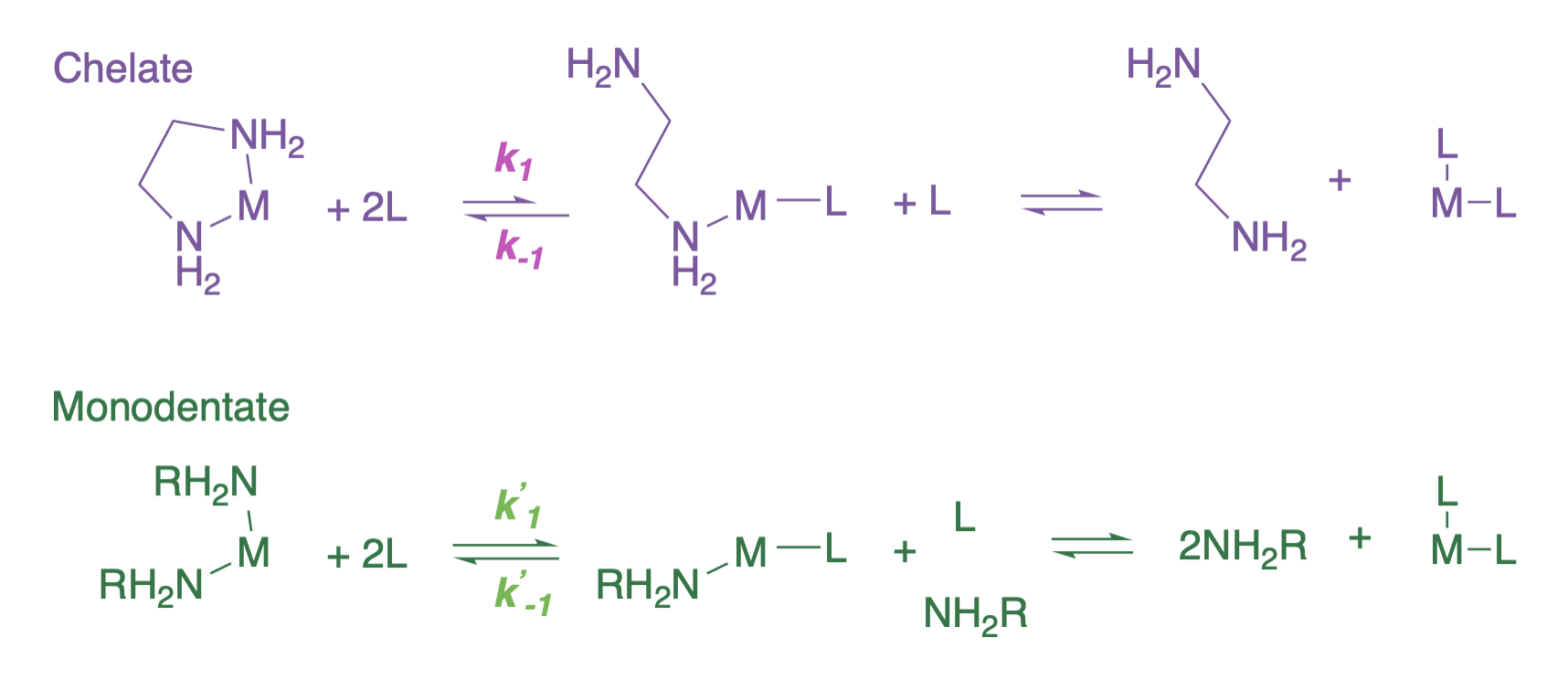
(1) Carter, M. J.; Beattie, J. K. Efecto quelato cinético. Quelación de Etilendiamina sobre Platino (II). Inorg. Chem.1970, 9 (5), 1233—1238. https://doi.org/10.1021/ic50087a044.
Modified by Kathryn Haas (khaaslab.com)


