12.9.1: Hidrólisis catalizada por metales
- Page ID
- 81449
Los iones de metales de transición (pero no iones de metales alcalinos) actúan como ácidos de Lewis en las interacciones metal-ligando. Como consecuencia de la interacción del ion metálico con el ligando, se altera la estructura electrónica del ligando. En algunos casos, la interacción metal-ligando provoca cambios en la fuerza y reactividad de otros enlaces dentro del propio ligando. Por ejemplo, cuando un ligando tiene un protón ácido, las interacciones con un ion metálico harán que ese protón ácido sea más ácido. En otras palabras, la interacción con el ion metálico puede provocar una disminución en los ligandos\(pK_a\). El complejo metal-ligando en sí mismo puede actuar como un ácido de Bronsted más fuerte (emitiendo un protón) en comparación con el ligando “libre”. Podemos ver este tipo de alteración en el\(pK_a\) del agua cuando está “libre” en comparación con cuando está unida a un ion metálico.
Ejemplo: El agua se encuentra con un ion de metal de transición 1
En biología, el solvente es el agua. El agua también es un ligando que se une a iones metálicos, de acuerdo con la ecuación que se muestra a continuación.
\[\ce{nH2O + M^{x+} <=>> [M(H2O)_{n}]^{x+}} \nonumber \]
Hay MUCHA agua alrededor en los sistemas biológicos. En consecuencia, la reacción mostrada anteriormente se desplaza lejos a la derecha (hacia el complejo acuo metálico\(\ce{[M(H2O)_{n}]^{x+}}\)) en solución acuosa. En consecuencia, cuando los metales se disuelven en solución acuosa, el ion “libre” no existe, y más bien el metal está en complejo con el agua. Esto es generalmente cierto a menos que haya otros ligandos presentes que tengan una afinidad más fuerte por el ión metálico.
Considere las dos reacciones de equilibrio que se muestran a continuación. La autoionización del agua se muestra a la izquierda. Esta reacción tiene una constante de equilibrio muy pequeña (\(K_W = 10^{-14}\)) y así es la\(pK_a\) para la disociación de un protón del agua\(pK_a = 14\). A la izquierda está la disociación de un protón de una molécula de agua unida al\(\ce{Zn^2+}\) ion (otros ligandos de agua no se dibujan por simplicidad). El enlace entre\(\ce{H2O}\) y\(\ce{Zn}\) se considera covalente.
\[\ce{H2O <=> H^+ + OH^-} \quad \quad \text{vs.} \quad \quad \ce{[Zn(H2O)]^2+ <=> H^+ + [Zn(OH)]^+} \nonumber \]
Predecir qué reacción anterior es más favorable. Es decir, en cuyo caso el agua es un mejor ácido; cuando el agua está “libre”, o cuando está unida a un ion de metal de transición como Zn 2 +? Defiende tu predicción. 1
- Pista
-
Considera estas dos cosas:
(1) ¿En qué caso es más estable el ion hidróxido: cuando es un ion libre o cuando está ligado al Zn? ¿Cómo afectará esto a un caso relativo al otro?
(2) Considerar la separación de carga en cada equilibrio. ¿La localización de la carga positiva y negativa es más favorable energéticamente en los reactivos o en los productos en cada caso? ¿Cómo afectará esto a un caso relativo al otro?
- Contestar
-
El agua es un mejor ácido cuando tiene un enlace covalente a un ion metálico. La interacción metal-ligando debilita el enlace H-O y estabiliza la base conjugada que se forma después de la desprotonación.
El agua tiene una\(pK_a\) de 14. Cuando el agua se une a un ion Zn 2 + en solución acuosa,\(pK_a\) se baja a 10. Calcular el pH del agua pura y el pH de una solución de 0.1 M ZnSO 4.
- Pista
-
Necesitará las ecuaciones químicas anteriores y deberá recordar las definiciones de\(K_a\) y\(pK_a\), así como\(pH\) completar esta tarea. Recordemos eso\(pK_a = - \log K_a\) y\(pH = - \log [H^+]\). La\(K_a\) es la constante de equilibrio para la ecuación química. Utilice una tabla I.C.E. para calcular la cantidad de ión hidrógeno en equilibrio.
- Contestar
-
El pH del agua pura es 7. El pH de 0.1 M\(\ce{ZnSO4}\) depende únicamente de la concentración del complejo Zn aquo que se forma después de la disociación de\(\ce{ZnSO4}\) a\(\ce{Zn^2+}\) y\(\ce{SO4^2-}\). Podemos usar el método I.C.E para determinar que la concentración de iones hidrógeno en equilibrio es aproximadamente\(3.2 \times 10^{-6}\) después de que\(\ce{Zn^2+}\) se agrega inicialmente 0.1M al agua. Esto da aproximadamente\(pH = 5.5\).
Los metales de transición disminuyen drásticamente el pH de la solución en comparación con agua pura. Por otro lado, los metales alcalinos no afectan significativamente el pH.
a) Con base en esta información, ¿qué se puede concluir sobre la naturaleza covalente relativa de las interacciones del agua con los metales de transición en comparación con los metales alcalinos?
b) Racionalizar esto con base en la posición del elemento en la tabla periódica y sus consiguientes configuraciones electrónicas.
- Contestar
-
a) los metales de transición forman más enlaces covalentes con el agua, mientras que las interacciones de los metales alcalinos son de carácter más electrostático.
b) los metales de transición tienen subcubiertas d parcialmente llenas, mientras que los metales alcalinos tienen las configuraciones electrónicas de los gases nobel. Quizás la configuración de electrones de gas nobel hace que el enlace covalente sea desfavorable, mientras que los orbitales d parcialmente llenos permiten interacciones de enlace productivas con ligandos.
Cuando un metal de transición se une a una cadena lateral de Cys, generalmente se une a la forma aniónica tiolato de esta cadena lateral. Explica por qué el Cys pierde su protón cuando se une un ion metálico. Use dibujos para describir lo que sucede con el hidrógeno\(pK_a\) del tiol.
- Pista
-
Una cadena lateral de cisteina tiene un grupo tiol (R-SH). Recordemos que los tioles se comportan de manera similar a los alcoholes, pero los tioles son más ácidos que los alcoholes
- Contestar
-
La unión de una cisteina S a un ion metálico debilitaría el enlace S-H y aumentaría la acidez de ese protón (su pKa disminuiría). En condiciones bilógicas, cerca de pH neutro, esta unión podría disminuir el pKa del grupo tiol tanto que el H se pierde para dar el tiolato base conjugado unido al metal.
Hidrólisis biológica 2
Arriba aprendiste cómo los metales pueden actuar como ácidos de Lewis para aumentar la acidez de una molécula de agua unida (u otro ligando). Esta modulación del agua\(pK_a\) puede ser realmente útil para catalizar reacciones en las que el ion hidróxido es un reactivo. La enzima anhidrasa carbónica (CA) es un excelente ejemplo de cómo la biología usa esta propiedad para catalizar una importante reacción biológica ácido/base. El CA es la enzima que\(\ce{CO2}\) se convierte en bicarbonato (\(\ce{HCO3^-}\)) muy rápidamente. Esto es importante en la sangre para llegar\(\ce{CO2}\) a los pulmones para ser exhalado. La conversión de\(\ce{CO2}\) a bicarbonato también es importante en la producción del fluido acuoso del ojo y otras secreciones; y la CA es una diana farmacológica importante para el tratamiento del glaucoma.
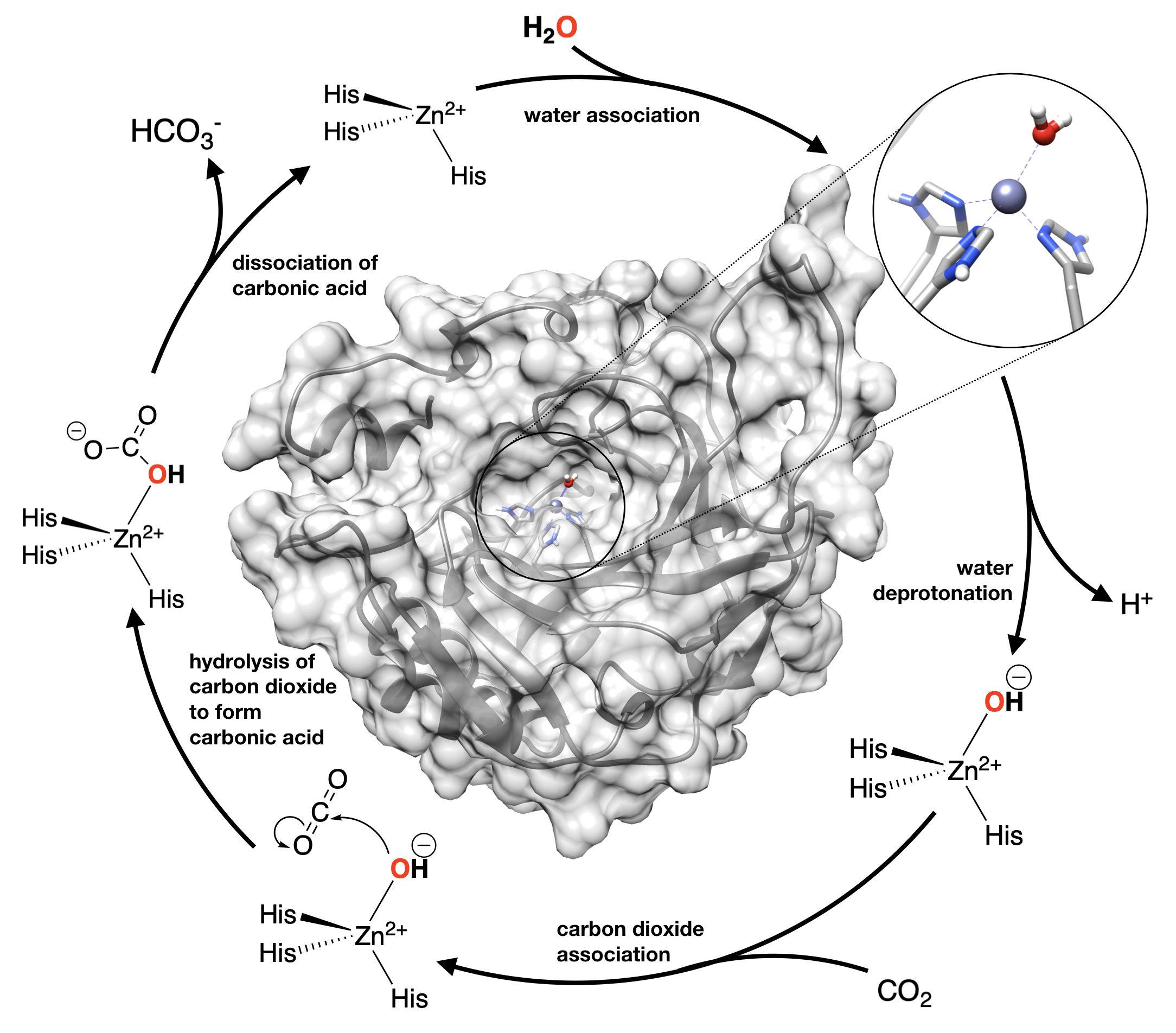
La figura muestra la estructura de la anhidrasa carbónica IV humana (de PDB 1znc), con un reventado del sitio activo Zn donde Zn está unido a 3 cadenas laterales de histidina (His). El mecanismo para esta enzima se muestra en las ecuaciones químicas que rodean la estructura en la Figura\(\PageIndex{4}\). Como discutimos anteriormente, la unión del agua a un ion metálico puede cambiar su\(pK_a\), y hacer sus protones más ácidos al estabilizar el ion hidróxido. Cuando se necesita hidróxido para llevar a cabo reacciones de hidrólisis, a menudo se utilizan iones metálicos ácidos, como Zn 2 +, para estabilizar el nucleófilo de hidróxido con el fin de catalizar la reacción (disminuir la energía de activación). El\(pK_a\) de agua “libre” es 14. Para el agua en [Zn (H 2 O) 6] 2+ en solución acuosa, el\(pK_a\) es 10. Pero, en el sitio activo de la anhidrasa carbónica, el\(pK_a\) de agua se reduce aún más, a 7, por el ambiente proteico alrededor del sitio activo de Zn. El sitio activo de esta proteína tiene el “poder” de disminuir el pKa del agua aún más que en el caso del Zn acuoso como una virtud de la bolsa hidrofóbica del sitio activo que hace que la separación de carga sea más inestable en comparación con el agua a granel donde las cargas pueden solubilizarse mejor por el agua a granel.
Observe cuidadosamente el ciclo catalítico que se muestra en la Figura\(\PageIndex{4}\) e identifique el paso en el que el agua pierde un protón (el paso etiquetado como “desprotonación de agua”). Este paso sería casi imposible bajo condiciones biológicas a pH 7.4. En otras palabras, pasaría con demasiada poca frecuencia para ser útil en sistemas biológicos. Pero, cuando el pKa se baja a 7, que está por debajo del pH, ese paso se vuelve tan favorable, que sucedería espontáneamente en solución.
La anhidrasa carbónica es solo un ejemplo de cómo los iones metálicos pueden ser útiles para catalizar reacciones de hidrólisis. Existen varios ejemplos más de enzimas catalíticas y complejos metálicos de moléculas pequeñas que utilizan metales (Cu, Co, Ni, Mn, Ca y Mg) para catalizar la hidrólisis de ésteres (por ejemplo, hidrólisis de grasas), amidas (por ejemplo, hidrólisis de enlaces peptídicos con agua), ésteres de fosfato (por ejemplo, hidrólisis de ADN y ARN) usando mecanismos simlar a lo mostrado anteriormente para la hidrólisis de dióxido de carbono.
Fuentes
1. Inspirado o tomado directamente de Metals in Acid Base Chemistry, una actividad en clase creada por Sheila Smith, Universidad de Michigan- Dearborn (sheilars@umd.umich.edu) y publicada en ViPer (www.ionicviper.org) el 17 de octubre de 2009. Derechos de autor Sheila Smith 2009. Esta obra está bajo la Licencia Creative Commons Atribución No comercial Compartir Igual. Para ver una copia de esta licencia visite http://creativecommons.org/about/license/.
2. De Metales en Sistemas Biológicos - ¿Quién? ¿Cómo? y ¿Por qué? , un 5 diapositivas sobre objeto de aprendizaje creado por Adam R. Johnson, Harvey Mudd College (adam_johnson@hmc.edu), Hilary Eppley, DePauw Univeristy (), y Sheila Smith, Universidad de Michigan- Dearborn (sheilars@umd.umich.edu) y publicado en ViPer (www.ionicviper.org) el 20 de enero, 2010. Derechos de autor Sheila Smith 2009. Esta obra está bajo la Licencia Creative Commons Atribución No comercial Compartir Igual. Para ver una copia de esta licencia visite http://creativecommons.org/about/license/.


