Capítulo 6.1: La regla de los 18 electrones
- Page ID
- 70242
Recuento de electrones en complejos de metales de transición
En este capítulo aprenderemos a contar electrones de valencia en compuestos de coordinación. El conteo de electrones es importante porque el número de electrones en un complejo puede decirnos mucho sobre la estabilidad y reactividad en un compuesto de coordinación. Además, nos permite predecir y comprender estructuras en cierta medida. El conteo de electrones suena trivial, pero no es tan trivial como parece, en realidad incluso hay dos métodos diferentes para el conteo de electrones. Cada método lleva al mismo resultado. El método que prefieres es el “gusto personal”, pero cada método es casi igual de común en la literatura, por lo que necesitas conocerlos a ambos.
El método del átomo neutro
El primer método se llama el “método del átomo neutro”. Como su nombre indica, dividiremos el complejo en fragmentos neutros, y contaremos los electrones que contribuyen a la unión en cada uno de los fragmentos. El método del átomo neutro se lleva a cabo de acuerdo con los tres pasos siguientes. Primero, contamos el número de los electrones de valencia del metal. Consideramos al metal como átomo neutro. El número de electrones de valencia es el mismo que el número de grupo del metal de transición en la tabla periódica. Para los metales de transición el número de grupos varía de 3 a 12. En el segundo paso, se da cuenta de la carga iónica del complejo, si el complejo no es neutro. Esto reducirá el número de electrones para un catión complejo, y aumentará el número de electrones de valencia para un anión complejo. En el tercer paso, necesitamos determinar cuántos electrones son aportados por cada ligando. Este es el paso más complicado. Para determinar el número de electrones se debe escindir cada enlace metal-ligando para que resulte un fragmento de ligando que sea neutro. Luego contamos el número de electrones en el ligando que contribuyó al enlace. Luego se resume el número de electrones aportados por cada ligando. Esto es suma luego se suma al número de electrones determinado por los pasos anteriores. Esto da el número total de electrones de valencia.
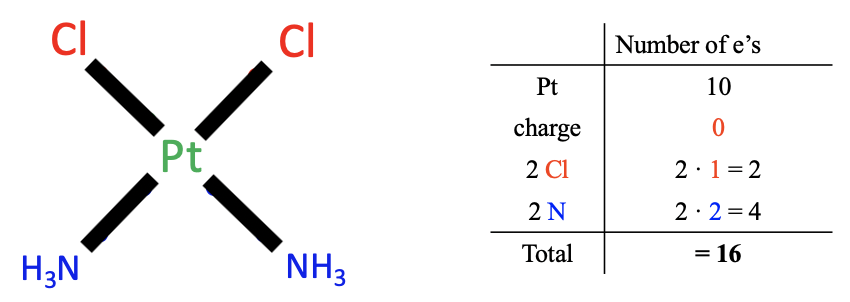
Figura\(\PageIndex{1}\): Example of neutral atom method
Apliquemos estas reglas con un ejemplo, el complejo cis-platino (Figura\(\PageIndex{1}\)). Primero necesitamos contar el número de electrones del metal. El metal es platino que se encuentra en el grupo 10 de la tabla periódica. Por lo tanto, un átomo de platino neutro tiene diez electrones de valencia.
A continuación, nos fijamos en la carga del complejo. En este caso, no hay carga, y por lo tanto no se suman ni restan electrones.
Por último, contamos los electrones de los ligandos. Hay dos tipos de ligandos, los ligandos cloro y los ligandos de amina. Ahora, nuestra tarea es escindir el enlace Pt-ligando para que resulten fragmentos de ligando neutros. Podemos ver que para los cloro-ligandos debemos escindir el enlace Pt-Cl, homolépticamente, es decir, en el medio, asignando un electrón al Pt y un electrón a Cl, porque al hacerlo se crea un átomo de cloro neutro. El hecho de que escindimos el enlace homolépticamente, significa que el ligando cloro aportó un electrón. Debido a que tenemos dos ligandos de cloro, en general hay dos electrones.
Ahora, pensemos en cuántos electrones aportan los ligandos de amina. En este caso necesitamos escindir heterolépticamente el enlace metal-ligando para producir un fragmento de ligando neutro. Ambos electrones de unión se asignan al ligando. Esto produce una molécula NH 3 neutra. Esto significa que cada ligando de aminaaporta dos electrones. En general, eso hace cuatro electrones, porque tenemos dos ligandos de aminos.
Por último, necesitamos resumir los electrones de los tres pasos. Es decir, diez electrones de Pt, cero electrones por carga, dos electrones de los ligandos de cloro y cuatro electrones de los ligandos de amina que equivalen a 16 electrones de valencia en total. Este es el resultado final.
Método “Estado de oxidación”
El método del estado de oxidación también se compone de tres etapas. El primer paso es el mismo que en el método del átomo neutro. Determinamos el número de electrones del metal neutro que igual que su número de grupo en la tabla periódica. Sin embargo, el siguiente paso es diferente. Requiere la determinación del estado de oxidación del metal. ¿Cómo podemos determinarlo? Primero, escindimos los enlaces metal-ligando heterolépticamente para que todos los electrones de unión se asignen a los ligandos. Luego determinamos la carga de los ligandos. Los ligandos pueden ser neutros o cargados negativamente. Determinamos el número total de cargas en los ligandos. La diferencia entre ese número y la carga del complejo es el estado de oxidación del metal. O sumamos o restamos electrones dependiendo del estado de oxidación del metal. Si el estado de oxidación es positivo restamos electrones, si es negativo, lo cual es raro, entonces sumamos electrones. El tercer paso cuenta el número de electrones aportados por los ligandos. Debido a que escindimos todos los enlaces heterolépticamente, se considera que todos los electrones de unión son aportados por los ligandos, y los contamos en consecuencia. Finalmente, resumimos los electrones de los tres pasos lo que da el número total de electrones.
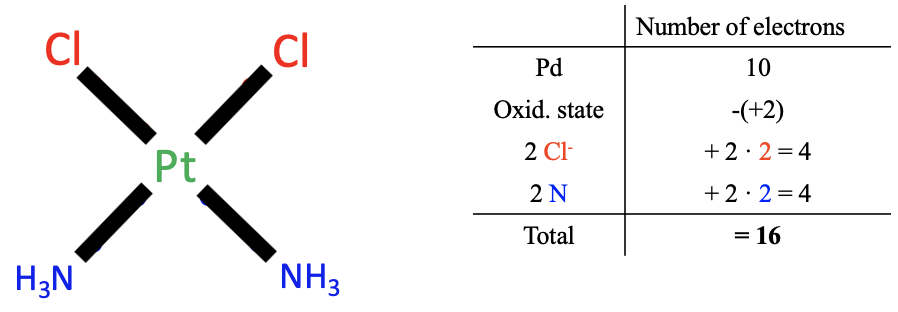
Apliquemos el método al ejemplo anterior cis-platino. Aplicar el primer paso nos da 10 electrones de valencia para el platino.
A continuación, necesitamos determinar el estado de oxidación de Pt. Para ello, ahora debemos escindir todos los enlaces metal-ligando heterolépticamente, de manera que todos los electrones de unión se asignen al ligando. Por cierto, esto equivale a decir que tratamos a todos los enlaces como enlaces dativos con todos los electrones provenientes de los ligandos como los donantes. Cuando hacemos esto para los ligandos de cloro vemos que esto creó aniones cloruro con una carga 1-. La división heteroléptica de los enlaces Pt-N conduce a moléculas NH 3 neutras. Por lo tanto, el número total de cargas en los ligandos es 2x (-1) +2x0=-2. La carga en el complejo es cero, por lo tanto el estado de oxidación de Pt es 0- (-2) =+2. Por lo tanto, debemos restar dos electrones de los 10 electrones del platino.
Ahora debemos determinar el número de electrones provenientes de los ligandos. Debido a que todos los enlaces son considerados como enlaces dativos, los ligandos de cloro aportan dos electrones cada uno, y los ligandos de amina aportan dos electrones cada uno. Eso genera en general ocho electrones.
En suma, 10 electrones del átomo neutro de Pt menos dos electrones debido al estado de oxidación +2 de Pt más 2x2=4 electrones de Cl más 2x2=4 electrones de NH 3 dan 16 electrones en total. Podemos ver que hemos llegado a los mismos resultados que en el caso del método del estado de oxidación.
Podemos discutir las ventajas y desventajas de ambos métodos, también. El método del átomo neutro tiene la ventaja de que no tenemos que pensar en cargas en ligandos y estados de oxidación. Sin embargo, tenemos que pensar en cómo escindir enlaces para crear fragmentos neutros. Es posible que necesitemos escindir los vínculos de una manera que no refleje la naturaleza donante-aceptor de un compuesto de coordinación. El método de oxidación sí explica la naturaleza donante-aceptor de un compuesto de coordinación porque los enlaces se consideran enlaces dativos, y los electrones se asignan a los ligandos y metales en consecuencia. No necesitamos pensar en cómo escindir los enlaces, porque escindemos los enlaces siempre heterolépticamente. Sin embargo, requiere que pensemos en las cargas en los ligandos para determinar los estados de oxidación, lo cual es un paso adicional, no trivial.
Contando electrones: contribuciones de ligandos
El paso más difícil en el conteo de electrones suele ser la determinación del número de electrones que proporciona un ligando. Por lo tanto, practiquemos esto con algunos ejemplos.
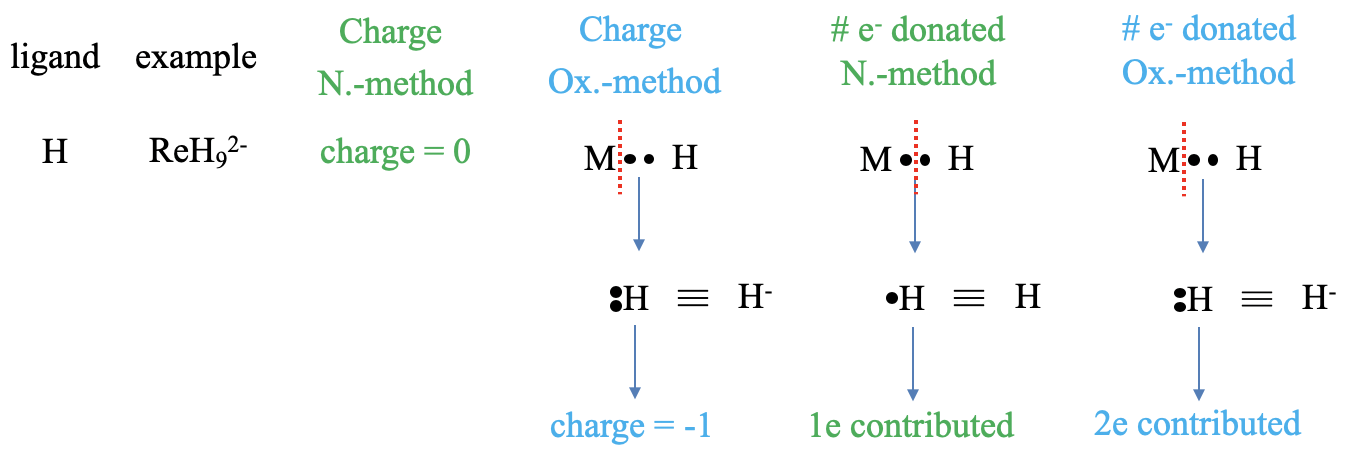
Veamos primero un ligando hidrido que está presente, por ejemplo, en el anión del complejo nonahidridorhenato (2-) (Figura\(\PageIndex{3}\)). ¿Cuál es la carga en el ligando en los dos métodos? En el método del átomo neutro, la carga siempre es cero, esto es una obviedad. En el caso del método de declaración de oxidación, necesitamos tratar el enlace como un enlace dativo, y eso significa que debemos escindir el enlace heterolépticamente, de modo que ambos electrones de unión puedan asignarse al ligando. Un átomo de H con dos electrones es un anión hidruro con una carga -1. A continuación, pensemos en el número de electrones donados. En el método del átomo neutro necesitamos producir fragmentos de ligandos neutros. Para ello debemos escindir homolépticamente el enlace M-H, porque esto creará un átomo de hidrógeno neutro. ¿Cuántos electrones aportará? Contribuirá con un electrón, porque escindimos el enlace homolépticamente asignando solo uno de los dos electrones de unión a H. En el método del estado de oxidación, el ligando hidrido aporta dos electrones porque el enlace se consideró dativo y por lo tanto se escindió heterolépticamente. Ambos electrones de unión fueron asignados al ligando, por lo tanto el ligando aporta dos electrones.
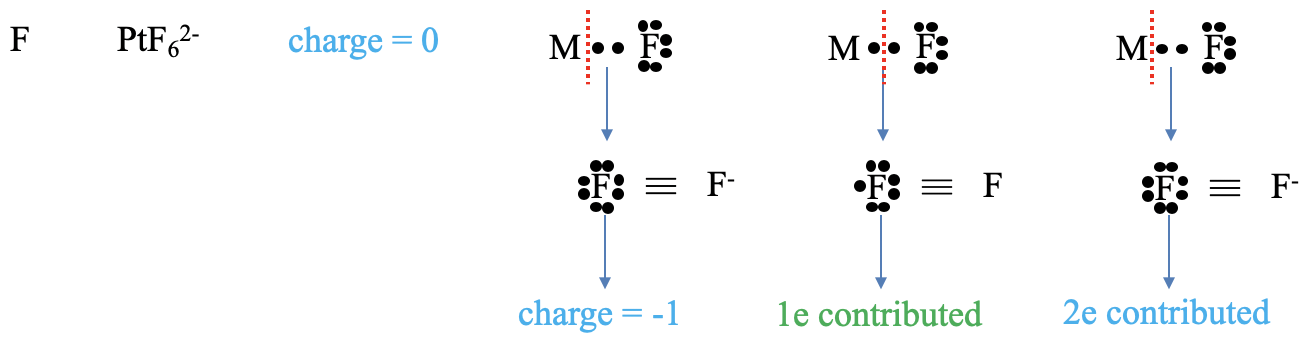
A continuación, consideremos un ligando de halogenuro (Figura\(\PageIndex{4}\)). ¿Cuál es la carga en el ligando? Para el método del átomo neutro, la respuesta es trivial, la carga siempre es cero. En el método del estado de oxidación, ambos electrones de unión en el enlace metal-ligando se asignan al ligando. Esto le da al ligando una carga -1. ¿Cuál es el número de electrones aportados? En el método del átomo neutro necesitamos pensar de nuevo cómo escindir el enlace metal-ligando para crear un fragmento de ligando neutro. Necesitamos reconocer que debemos escindir el enlace homolépticamente para producir ese fragmento. Escindir el enlace homolopeticamente significa que el ligando ha aportado un electrón. En el método del estado de oxidación, escindimos el enlace siempre heterolépticamente para que todos los electrones de unión se asignen al ligando. Así, el ligando aporta dos electrones.
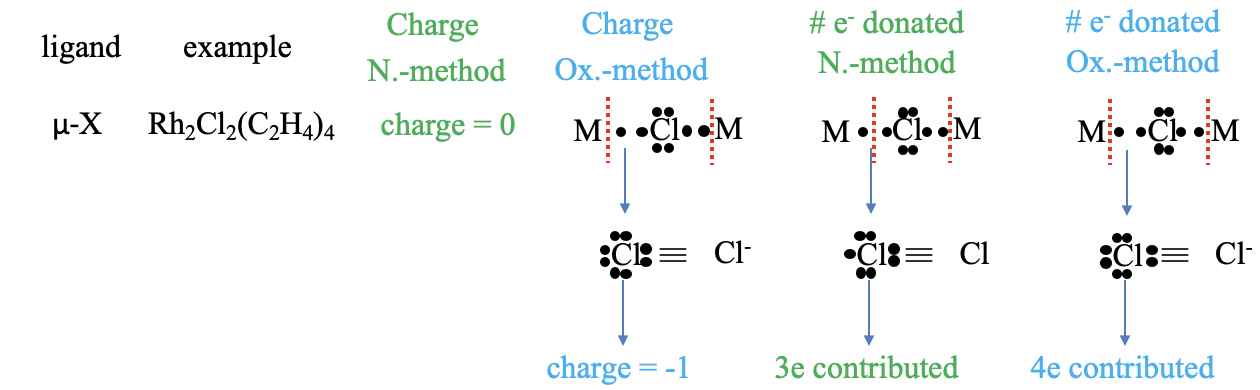
Un anión de halógenuro como ligando no solo puede ser terminal, sino también puente. Un ejemplo es el complejo μ-dicloro-bis (tetraetileno rodio (I)) en el que dos cloro-ligandos unen dos átomos de rodio. ¿Cuál es la carga en el método del átomo neutro? Por supuesto, es cero. ¿Cuál es la carga en el método del estado de oxidación? Podemos ver que si consideramos ambos enlaces metal-ligando enlaces dativos, y escinden los enlaces heterolépticamente, ese átomo de Cl está rodeado por ocho electrones no compartidos, lo que le da una carga -1. ¿Cómo, muchos electrones son aportados en el método del átomo neutro? Para responder a esta pregunta, necesitamos decidir si tenemos que escindir los enlaces homo- o heterolépticamente para producir un átomo de Cl neutro. ¿Lo puedes ver? La respuesta es: Debemos escindir un enlace homolépticamente, y el otro heterolépticamente. ¿Cuántos electrones son aportados entonces por el ligando cloro? Son los dos electrones del enlace escindido heterolepticamente, y un electrón del enlace escindido homolepticamente. Entonces en general son tres electrones. ¿Qué pasa con el método del estado de oxidación? En este caso ambos enlaces se escinden heterolépticamente, y esto significa que en general se aportan cuatro electrones.
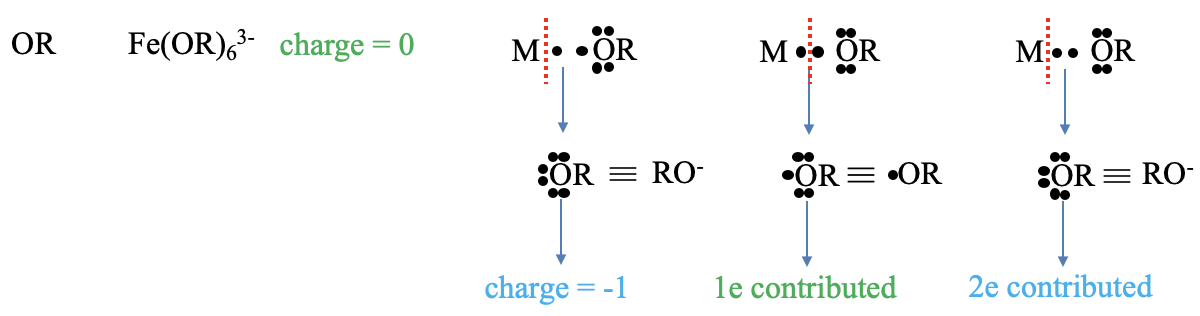
¿Cuáles son las cargas y electrones aportados por un ligando alcoxi (OR), Figura\(\PageIndex{6}\)? Un ejemplo de un complejo con tal ligando es el hexaafenoxi ferrato (3-). La carga según el método del átomo neutro es cero. En el método del estado de oxidación escindimos los enlaces heterolépticamente, y nuestro ligando se convierte en un anión alcóxido. Este anión tiene una carga de 1. ¿Cuántos electrones aporta el ligando? Para obtener un fragmento neutro debemos escindir el enlace homolépticamente. Esto en realidad produce un radical alcoxi. Este radical aporta su electrón radical, así hay un electrón aportado. En el método del estado de oxidación tratamos el enlace como un enlace dativo y escindemos el enlace heterolépticamente. Por lo tanto, se aportan dos electrones según el método del estado de oxidación.
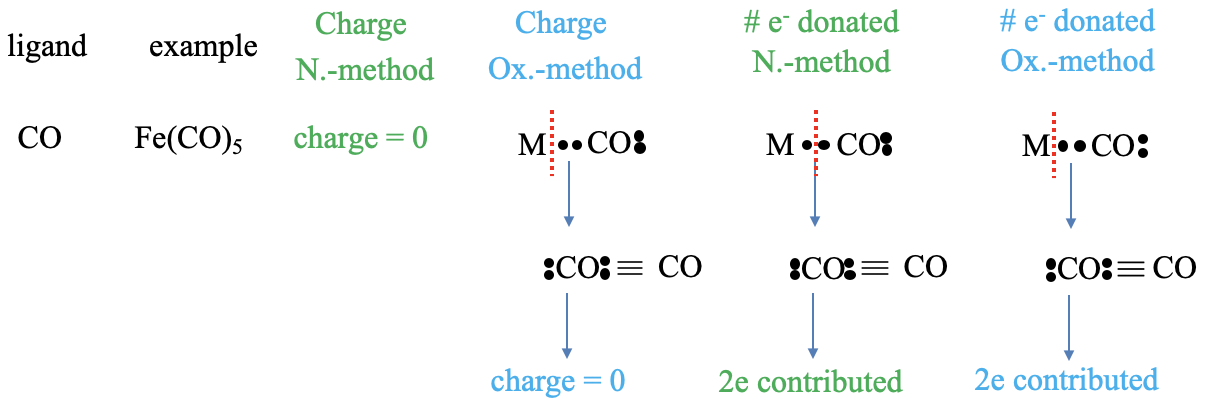
A continuación, apliquemos el conteo de electrones al ligando carbonilo. Por ejemplo, cinco moléculas de monóxido de carbono forman un complejo de pentacarbonilo de hierro con hierro. La carga en el ligando en el método del átomo neutro es cero. En el método del estado de oxidación, asignamos ambos electrones de unión al ligando, y eso produce una molécula neutra de monóxido de carbono. Obsérvese que el átomo de carbono está formalmente cargado negativamente, porque está rodeado por 5 electrones, pero el átomo de oxígeno está cargado positivamente porque está rodeado por cinco electrones. Entonces, en general, la molécula es neutra. ¿Cuál es el número de electrones aportados en el método del átomo neutro? Para producir un ligando neutro debemos escindir el enlace heterolépticamente. Esto produce una molécula neutra de monóxido de carbono. Debido a que escindimos el enlace heterolépticamente, el ligando aporta dos electrones. En el método del estado de oxidación siempre escindimos los enlaces heterolépticamente, y así dos electrones provienen del ligando, también.
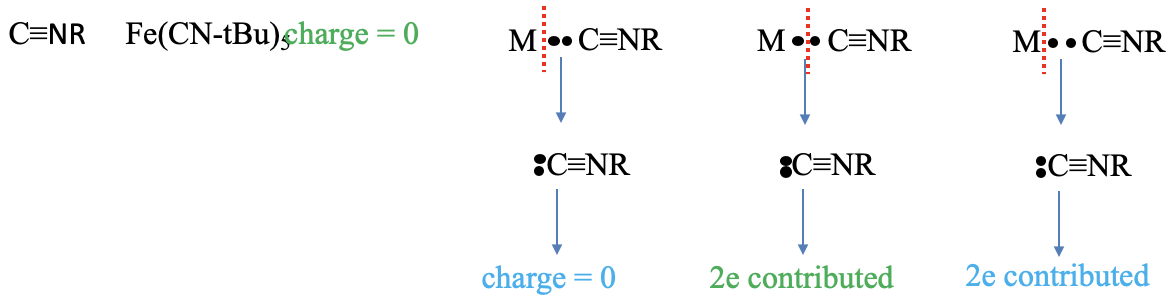
El último ligando que discutimos aquí es el ligando de isonitrilo. Un ejemplo es la molécula de pentakis- (terc-butil isonitrilo) hierro. La carga del ligando es cero en el método del átomo neutro, pero ¿qué es en el método del estado de oxidación? Veamos qué sucede a medida que asignamos ambos electrones de unión al ligando. Vemos que ahora el carbono está rodeado por cinco electrones. Tres están en el triple enlace carbono-nitrógeno y los otros dos provienen del par solitario de electrones en el átomo de carbono. Esto quiere decir que el átomo de carbono tiene una carga formal -1. Ahora, veamos el átomo de N. Vemos que está rodeada por cuatro electrones, tres procedentes del triple enlace C-N, y uno del enlace C-R. Eso quiere decir que el átomo de N tiene una carga +1. En general, la molécula es neutra y no lleva carga. ¿Y el número de electrones aportados? Podemos ver que debemos escindir el enlace heterolépticamente para producir un isonitrilo neutro, hay dos electrones que se aportan en el método del átomo neutro. El método del estado de oxidación debe escindir el enlace heterolépticamente, por lo tanto, el número de electrones aportados también es de dos.
La regla de los 18 electrones
El conteo de electrones es importante en el contexto de una regla importante en la química de coordinación: La regla de 18 electrones. La regla de 18 electrones establece que para los elementos del bloque d normalmente los complejos con 18 electrones en la cubierta (configuración ns 2 (n-1) d 10 np 6) son los más estables. Si no se alcanza este número, la especie está coordinadamente insaturada y tiende a agregar más ligandos. También tiende a reducirse porque la adición de electrones lleva el complejo a, o al menos más cerca de 18 electrones. Por lo tanto, los complejos coordinadamente insaturados tienden a tener una mayor reactividad.
Definición: Complejos coordinadamente insaturados
Un complejo es insaturado coordinadamente cuando no se alcanzan los 18 electrones en la capa (configuración ns 2 (n-1) d 10 np 6). Tiende a añadir más ligandos, y tiende a reducirse. Se asocia con mayor reactividad.
Si una especie tiene más de 18 electrones está coordinadamente sobresaturada y tiende a perder ligandos. Por lo general, se oxida fácilmente. Tanto la pérdida de ligandos como la oxidación reducen al número de electrones a o al menos más cerca de 18.
Definición: Complejos coordinadamente sobresaturados
Un complejo está sobresaturado coordinadamente cuando tiene más de 18 electrones en la cáscara (configuración ns 2 (n-1) d 10 np 6). Tiende a perder ligandos y tiende a oxidarse.
La regla de los 18 electrones tiene muchas excepciones y, por lo tanto, debe aplicarse con precaución. En particular, los complejos de los grupos 3, 4 y 10 se desvían a menudo de la regla de 18 electrones.
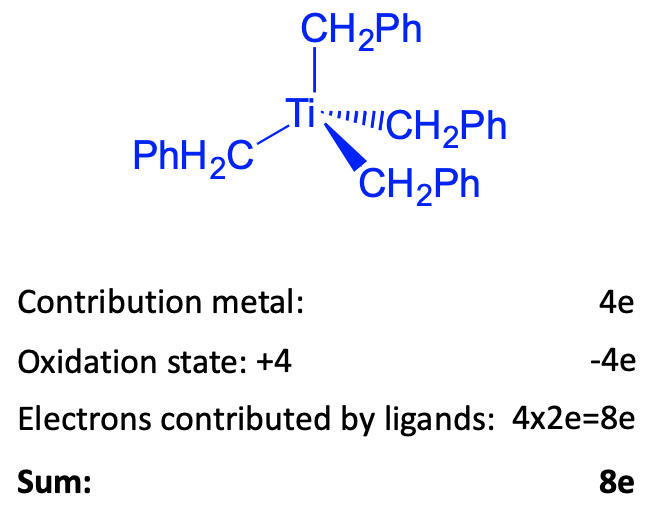
Para fines ilustrativos, contemos el número de electrones del complejo tetraédrico tetrabenciltitanio (0) mediante el método del estado de oxidación. También podríamos usar el método del átomo neutro, que daría los mismos resultados. Este complejo es un complejo del grupo 4 porque el titanio está en el grupo 4. ¿Cuántos electrones aportará el titanio? Debido a que el número de electrones es siempre el mismo que el número de grupo, aportará cuatro electrones. A continuación, ¿cuál es el estado de oxidación del Ti? Para determinarlo debemos determinar la carga en los ligandos. Para ello escindimos los enlaces heterolépticamente. Esto dará aniones bencilato con -1 carga. Hay cuatro de estos iones, y por lo tanto habrá cuatro cargas negativas en general. El complejo es de carga neutra, y por lo tanto el estado de oxidación es +4 porque -4+4=0. Por lo tanto, necesitamos restar cuatro electrones. Debido a que escindimos el enlace heterolépticamente, cada ligando aporta dos electrones, dando en general ocho electrones provenientes de los cuatro ligandos. Esto significa que tenemos en general ocho electrones, o un complejo de 8 electrones. Esto está muy, muy lejos de 18 electrones. Sin embargo, el complejo es estable. ¿Cómo podemos explicar esto? La respuesta es que para lograr 18 electrones se necesitaría agregar cinco ligandos adicionales si cada ligando es considerado un donante de 2 electrones. Esto aumentaría el número de coordinación a 9 que es demasiado alto para producir un complejo estable. Para reducir el complejo a un complejo de 18 electrones, se necesitarían agregar 10 electrones. Esto produciría un complejo con una carga -10 que es muy alta para ser estable. Los argumentos son generalizables para los complejos del grupo 3 y del grupo 4. Debido a que estos elementos solo tienen unos pocos electrones d, los ligandos necesitarían aportar muchos electrones para producir un complejo de 18 electrones. Esto requeriría simplemente demasiados ligandos para agregar. Los números de coordinación se pondrían demasiado altos. Si se agregan electrones en lugar de ligandos, la carga negativa en el complejo sería demasiado alta para ser estable en base a argumentos de repulsión electrón-electrón.
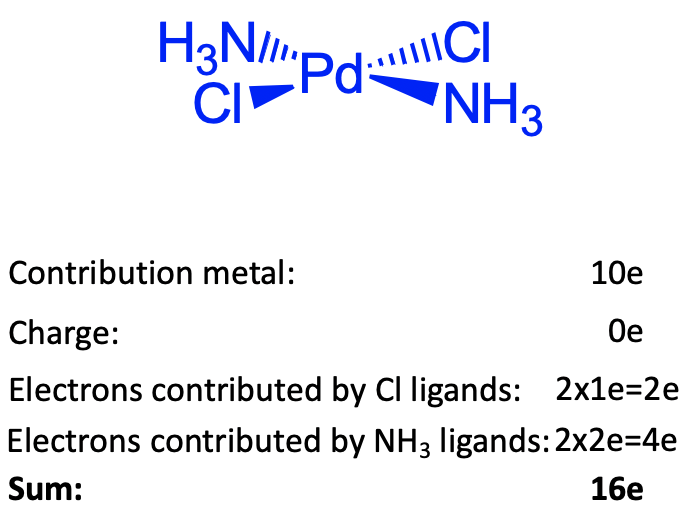
Estos argumentos no pueden aplicarse para los elementos del grupo 10, porque estos elementos tienen muchos d electrones. La explicación en este caso es que a estos elementos les gusta hacer complejos planos cuadrados cuando en el número de oxidación es +2. Los complejos planos cuadrados prefieren 16 en lugar de 18 electrones. Aprenderemos más adelante, cuando discutamos la vinculación en los compuestos de coordinación, por qué es esto. Se puede ver que el complejo de diamminedicloropaladio plano cuadrado que se muestra es plano cuadrado y tiene dieciséis electrones. Hay 10 electrones provenientes de Pd. Si usamos el método del átomo neutro, no es necesario agregar ni restar electrones debido a la carga en el complejo. El complejo es de carga neutra. Para evaluar cuántos electrones provienen de los ligandos necesitamos escindir los enlaces para que se produzcan ligandos neutros. Los enlaces Pd-Cl necesitan ser escindidos homolépticamente, los enlaces Pd-N necesitan ser escindidos heterolépticamente. Por lo tanto, los dos ligandos de cloro son donadores 1e, y los dos ligandos de amina son donantes 2e. Esto da 10+4+2 = 16 electrones.

