11.1: Complejos con múltiples enlaces Metal-Metal
- Page ID
- 70044
Consideraciones orbitales moleculares en complejos metálicos dinucleares con múltiples enlaces M-M
Comencemos un nuevo capítulo y pensemos en complejos dinucleares de metales de transición con múltiples enlaces metal-metal. ¿Cuál es la orden de fianza máxima que podríamos esperar? Los metales de transición tienen cinco orbitales d disponibles, y para determinar el orden de enlace máximo posible necesitamos ver cómo se superponen para formar orbitales moleculares (Fig. 11.1.1).
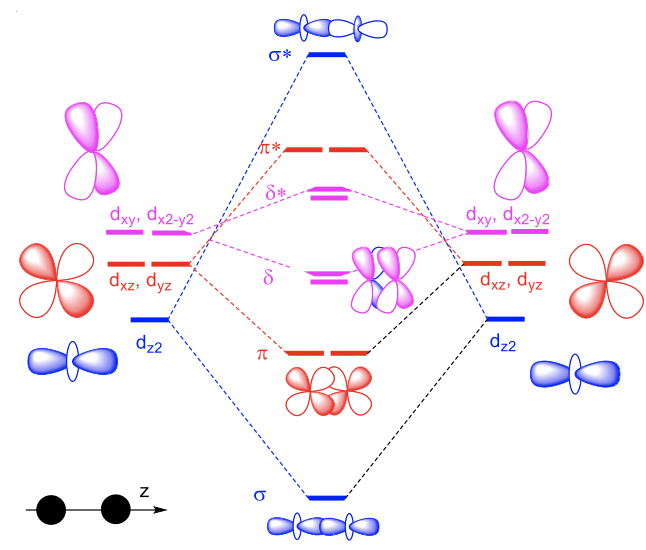
Si definimos el eje de enlace M-M como el eje z, entonces dos orbitales d z 2 pueden superponerse en forma σpara formar un orbital σmolecular de unión y un orbital σ-molecular antienlace. Un d xz, y un d yz pueden superponerse con otro d xz y otro d yz en forma π para formar dos enlaces degenerados π y dos degenerados anti-unión π*-orbitales. π-superposición es menor que σ-superposición, por lo tanto, la división en energía entre la unión y el anti- la unión π-orbitales es menor que la división entre la unión y la anti-unión σ-orbitales. El orbital d xy puede superponerse con otro orbital d xy en\(\delta\) -moda, y también lo puede hacer el d x 2 -y 2 con otro d x 2 -y 2. Esto da dos\(\delta\) orbitales de unión y dos\(\delta\) orbitales antiunión. La\(\delta\) superposición es incluso más pequeña que la superposición π, por lo tanto, la división de energía entre\(\delta\) los orbitales de unión y antiunión es incluso menor que la de los orbitales π y π*-. Entonces, ¿cuál sería la orden máxima de fianza que se podría lograr? El orden máximo de unión se lograría cuando todos los MO de unión estuvieran llenos y todos los MO antiunión estuvieran vacíos. Tenemos en general cinco MO de enlace que podríamos llenar con diez electrones de dos átomos metálicos con configuración de d-5 electrones. Por lo tanto, el orden máximo de bonos BO sería BO=5. No obstante, en la práctica sólo son bien conocidas las órdenes de fianza de hasta 4. Esto se debe a que el orbital d x 2 -y 2 suele estar demasiado involucrado en la unión con los ligandos, por lo que no está disponible para las interacciones metal-metal. El orbital d x 2 -y 2 hace las interacciones más fuertes con los ligandos porque la mayoría de los ligandos se acercan sobre o cerca de los ejes x e y.
Configuraciones de electrones y múltiples enlaces M-M
Podemos predecir fácilmente ahora qué configuración de electrones conduce a qué orden de enlace metal-metal. El orden de enlace aumenta de 1 a 4 con la configuración electrónica cambiando de d 1 a d 4. En el d 4 todos los MO de unión están llenos con ocho electrones.
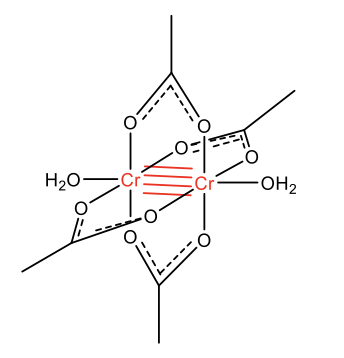
Un ejemplo de un complejo con un orden de enlace de 4 es el complejo de tetraacetatodiaquadicromio mostrado (Fig. 11.1.2). El Cr se encuentra en el estado de oxidación +2, lo que hace que el cromo sea una especie d 4. Esto lo podemos mostrar rápidamente contando los electrones de valencia. Un átomo de Cr neutro tiene 6 VE, y una configuración electrónica 3d 5 4s 1. Hay cuatro ligandos de acetato que tienen una 1- carga cada uno lo que da cuatro cargas negativas en general. El complejo es neutro global lo que significa que cada Cr debe tener formalmente una carga 2+, y la configuración electrónica es 3d 4.
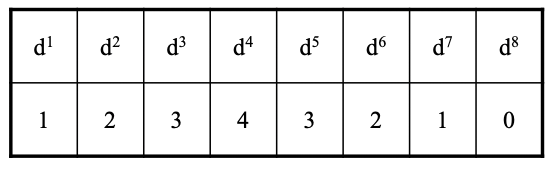
Con aún más electrones en los orbitales d metálicos, el orden de los enlaces comienza a disminuir nuevamente a medida que los MO antiunión necesitan ser llenados (Fig. 11.1.3). La combinación de dos metales con configuración de electrones d 5 conduce a un triple enlace, dos metales d 6 dan un doble enlace y dos metales d 7 dan un enlace sencillo. No debe existir un enlace metal-metal para dos metales d 8 porque entonces el orden de enlace es cero.
Evidencia de bonos múltiples M-M
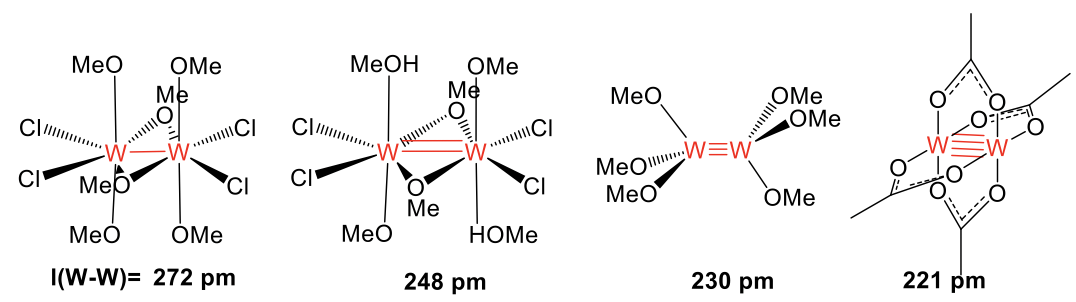
¿Qué evidencia experimental puede sustentar la existencia de una orden de fianza particular (Fig. 11.1.4)? Un argumento es la longitud del enlace que se puede obtener a través de la determinación de la estructura cristalina del complejo. Cuanto más corto sea el vínculo, mayor será el orden del bono. Por ejemplo, en los cuatro complejos de tungsteno mostrados las longitudes de enlace disminuyen de 272pm, a 248pm, a 230pm a 221pm correspondientes a un enlace simple, doble, triple y cuádruple, respectivamente.
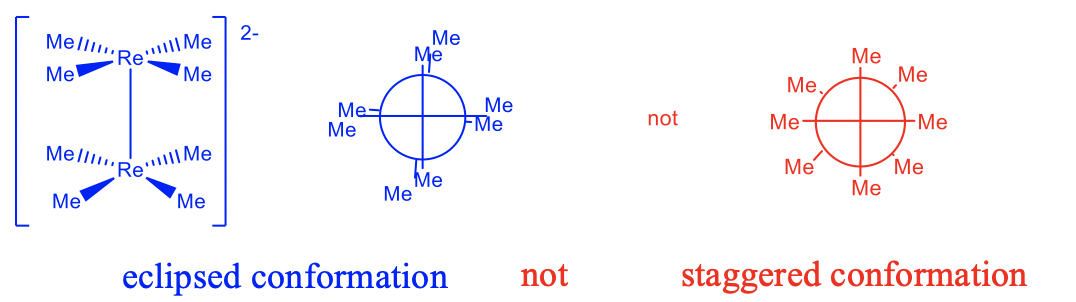
Otro indicio puede ser la conformación de una molécula (Fig. 11.1.5). Por ejemplo, las dos unidades cuadrado-planas del anión complejo Re 2 Me 8 2- muestran conformación eclipsada. Los argumentos de repulsión estérica favorecerían la conformación escalonada, por lo que debe haber una razón por la que se eclipsen las dos unidades ReMe 4. El renio se encuentra en el estado de oxidación +3, por lo que es una especie d 4, y argumentaríamos que puede haber un enlace cuádruple Re-Re. Este enlace cuádruple solo puede formarse cuando los orbitales d xy están en conformación eclipsada, y esto solo es posible cuando los dos fragmentos de ReMe 4 están en conformación eclipsada. La longitud muy corta del enlace de 218pm respalda aún más la existencia del enlace cuádruple.

