31.1: Metalocenos
- Page ID
- 73456
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El descubrimiento del ferroceno fue uno de esos accidentes fortuitos que eran totalmente imprevisibles, el tipo de descubrimiento que, una y otra vez, ha cambiado el curso de la ciencia. Pauson estaba tratando de sintetizar fulvaleno,\(1\), acoplando primero dos moléculas de bromuro de ciclopentadienilmagnesio\(\ce{FeCl_3}\) y luego deshidrogenando el producto:
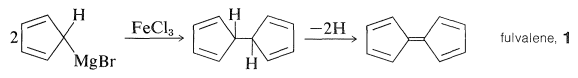
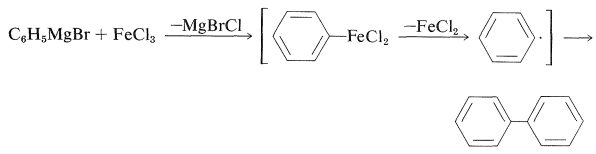
La razón para la reacción de acoplamiento fue que el bromuro de fenilmagnesio\(\ce{FeCl_3}\) da altos rendimientos de bifenilo, presumiblemente por medio de un compuesto de feniliron inestable:
El producto de reacción fue una sustancia naranja bellamente cristalina, altamente estable\(\ce{C_{10}H_{10}Fe}\), que Pauson formuló como una simple combinación de dos aniones ciclopentadienuro e ion ferroso con dos\(\ce{C-Fe}\) enlaces,\(2\). Sin embargo, el producto pronto fue mostrado por una variedad de métodos físicos para tener la estructura “sandwich”,\(3\):
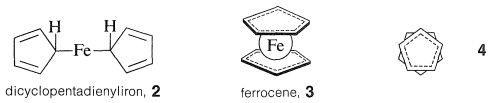
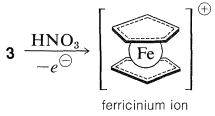
La unión entre el metal y los anillos de ciclopentadieno implica los\(\pi\) electrones de los dos anillos, estando todos los carbonos igualmente unidos al ion ferroso central. Este último, al aceptar una participación de 12\(\pi\) electrones de dos aniones de ciclopentadienilo, logra la configuración de 18 electrones de capa externa\(^1\) del gas inerte, el kriptón. El análisis de la estructura del ferroceno cristalino muestra que cuando se mira hacia abajo sobre la molécula a lo largo del eje anillo-hierro-anillo, se ve que los anillos de ciclopentadieno están escalonados entre sí, como se muestra en\(4\). El ferroceno tiene mp\(173^\text{o}\) y, aunque es estable al ácido sulfúrico, es fácilmente oxidado por el ácido nítrico al ion ferricinio menos estable:
Al igual que el benceno, el ferroceno no reacciona fácilmente por adición sino que experimenta sustitución electrófila. Por ejemplo, la acilación de Friedel-Crafts (Sección 22-4F)\(\ce{CH_3COCl}\) da tanto un monoetanoilferroceno como un dietanoilferroceno. Los dos grupos acilo se unen a dos anillos diferentes y, debido a que solo se puede aislar un dietanoilferroceno, los grupos ciclopentadienilo parecen estar libres para rotar alrededor del eje de los enlaces carbono-hierro:
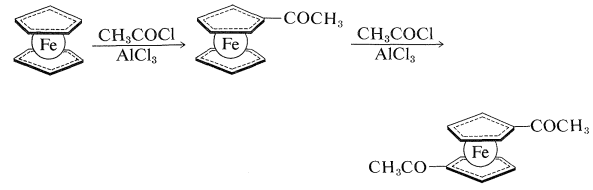
El ferroceno es solo uno de un gran número de compuestos de metales de transición con el anión ciclopentadienilo. Otros metales que forman estructuras tipo sándwich similares al ferroceno incluyen níquel, titanio, cobalto, rutenio, circonio y osmio. La estabilidad de los metalocenos varía mucho con el metal y su estado de oxidación; el ferroceno, rutenoceno y osmoceno son particularmente estables porque en cada uno el metal logra la configuración electrónica de un gas inerte. Casi lo último en resistencia al ataque oxidativo se alcanza en\(\ce{(C_2H_5)_2Co}^\oplus\), ion cobalticinio, que se puede recuperar de aqua regia hirviendo (una mezcla de ácidos nítrico y clorhídrico concentrados llamada así por su capacidad para disolver platino y oro). En el ion cobalticinio, el metal tiene los 18 electrones de capa externa característicos del kriptón.
Muchos otros compuestos orgánicos insaturados pueden formar\(\pi\) complejos con metales de transición. Una sustancia que de alguna manera es análoga al ferroceno es el complejo de dos moléculas de benceno con cromo metálico, llamado dibencenocromio. La unión implica cromo cerovalente y los\(\pi\) electrones de los dos anillos de benceno. En el dibencenocromio, la configuración electrónica del átomo de cromo es similar a la del kriptón:
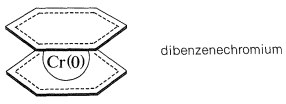
Aunque el dibencenocromio es térmicamente bastante estable, lo es menos que el ferroceno y se funde con descomposición\(285^\text{o}\) para dar benceno y cromo metálico. Además, parece carecer del carácter aromático del benceno o del ferroceno a juzgar por el hecho de que es destruido por reactivos utilizados para reacciones de sustitución electrófila.
Se han preparado varios complejos de ciclobutadieno de metal de transición, y esto es aún más notable debido a la inestabilidad del hidrocarburo parental. Las reacciones que lógicamente deberían conducir al ciclobutadieno dan en su lugar productos diméricos. Así, el 3,4-diclorociclobuteno ha sido desclorado con amalgama de litio en éter, y el producto hidrocarbonado es un dímero de ciclobutadieno,\(5\). Sin embargo, 3,4-diclorociclobuteno reacciona con el dihierro nonacarbonilo\(\ce{Fe_2(CO)_9}\),, para dar un complejo estable de hierro tricarbonilo de ciclobutadieno\(6\), cuya estructura ha sido establecida por análisis de rayos X. El sistema\(\pi\) -electrónico del ciclobutadieno se estabiliza considerablemente por la formación compleja con hierro, que nuevamente alcanza la configuración electrónica del kriptón.
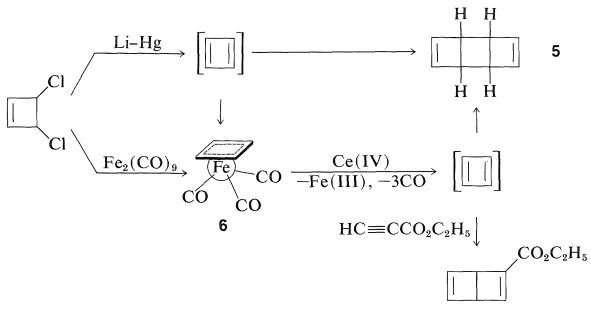
La oxidación\(6\) con hierro cérico,\(\ce{Ce}\) (IV), libera ciclobutadieno que rápidamente se dimeriza, pero puede ser atrapado por buenos dienófilos como el propinoato de etilo para dar un cicloaducto.
Se conocen muchos derivados de metaloceno de otros polienos cíclicos conjugados. Ejemplos son bis (ciclooctatetraeno) uranio (uranoceno\(7\)) y bis (pentalenilníquel),\(8\) (ver Sección 22-12B):

Muchos de los compuestos de metaloceno muestran reactividades y reacciones inusuales, de las cuales ninguna es más sorprendente que el descubrimiento por parte del químico ruso M. E. Vol'pin, de la absorción de dinitrogen\(\ce{N_2}\), por titanoceno\(\ce{(C_2H_5)_2Ti}\), para formar un complejo o complejos que pueden reducirse fácilmente para formar amoníaco. La naturaleza de estos complejos está en duda, pero J. E. Bercaw ha obtenido evidencia muy clara para la estructura del complejo\(9\) formado a partir de decametilzirconoceno y dinitrógeno:
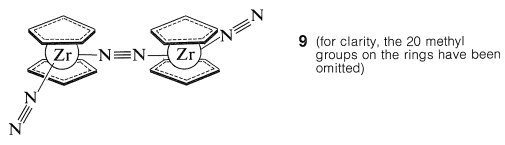
Este complejo tratado con ácidos da\(\ce{NH_2-NH_2}\) y algunos\(\ce{NH_3}\).
\(^1\)La Figura 6-4 muestra que el hierro (0) tiene 8 electrones en los\(3d\) orbitales\(4s\) y. El hierro ferroso\(\left( \ce{Fe^{2+}} \right)\) entonces tendrá 6 electrones de capa externa. Este 6 más los 12\(\pi\) electrones de los dos anillos de ciclopentadienuro hacen que el total de 18 electrones y la configuración electrónica de kriptón.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


