9.5: Hidratación- Oximercuración-Demercura
- Page ID
- 75938
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivo de aprendizaje
- aplicar los principios de regioselectividad y estereoselectividad a las reacciones de adición de alquenos
- predecir los productos, especificar los reactivos y discernir la reacción más eficiente para la hidratación de alquenos (hidratación catalizada por ácido; u oximercuración/desmercura; o hidroboración/oxidación)
Introducción
La hidratación catalizada por ácidos de alquenos está limitada por la estabilidad de carbocationes. El reordenamiento de los carbocationes puede ocurrir para formar un ion más estable como se muestra en el siguiente ejemplo.

La hidratación de alquenos mediante la vía de reacción de oximercuración-desmercura produce de manera confiable el producto Markovnikov sin reorganización de carbocationes como se muestra en el siguiente ejemplo.

La oximercuración-desmercura es una vía de dos pasos utilizada para producir alcoholes.
Mecanismo de oximercuración-demercuración
Este mecanismo es similar a las reacciones de adición electrófila previas. La diferencia principal es que un puente de iones de mercurio estabiliza el carbocatión intermedio para que no pueda reorganizarse. Los metales son electropositivos. El mercurio lleva una carga positiva parcial en el complejo de acetato y es el electrófilo. Durante el primer paso de este mecanismo, los electrones pi forman un enlace con el mercurio mientras que el par solitario en el mercurio se une simultáneamente al otro carbono vinílico creando un puente de iones de mercurio. El ion mercurio se forma junto con la pérdida de un ion acetato. El ion mercurio estabiliza el carbocatión para que no se reorganice. En el segundo paso de este mecanismo, una molécula de agua reacciona con el carbono más sustituido para abrir el puente de iones de mercurio. El tercer paso de este mecanismo es una transferencia de protones a una molécula de agua solvente para neutralizar el producto de adición. El cuarto paso de la vía de reacción es la reducción del intermedio organomercurio con borohidruro de sodio en condiciones básicas. El mecanismo del cuarto paso está más allá del alcance de la química orgánica de primer año.
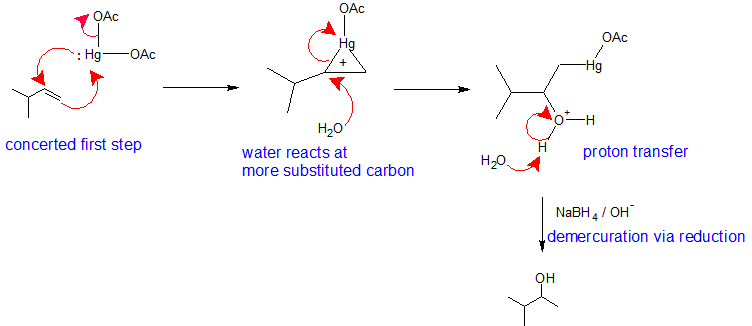
Observe que en general, el mecanismo de oximercuración-desmercura sigue la Regioselectividad de Markovnikov con el grupo OH unido al carbono más sustituido y el H unido al carbono menos sustituido. La reacción es útil, ya que no se requieren ácidos fuertes y se evitan los reordenamientos de carbocationes porque no hay formas intermedias discretas de carbocationes.
Ejercicio
1. Mostrar cómo preparar 3-metil2-pentanol a partir de 3-metil-1-penteno.
Nota: Las preguntas 2-5 no han mostrado el agua presente en la solución de ácido sulfúrico y han indicado una segunda etapa de neutralización. Algunos autores simplemente escriben H + /H 2 O como un solo paso.
2. Dibuje la estructura de línea de unión para el producto.
.bmp)
3. Dibuje la estructura de línea de unión para el producto. ¿Cómo afecta el grupo ciclopropano a la reacción?

4. Dibuje la estructura de línea de unión para el producto. (Pista: ¿Qué tiene de diferente este problema?)

5. Dibuje la estructura de línea de unión para el/los producto (s). Indicar cualquier turno así como el producto principal:

6. En cada caso, predecir el/los producto (s) de estos reactivos de oximercuración.

7. Proponer el alqueno que fue el reactivo para cada uno de estos productos de oximercuración.

- Contestar
-
1.

2. Esta reacción es hidratación electrofílica.

3. La respuesta son productos secundarios adicionales, pero el producto principal formado sigue siendo el mismo (el producto que se muestra). Dependiendo de las temperaturas utilizadas, el ciclopropano puede abrirse en una cadena recta, lo que hace poco probable que se forme el producto principal (después de la reacción, es poco probable que el carbono de 3º permanezca como tal).

4. Un desplazamiento de hidruro ocurre realmente desde la parte superior del 1-metilciclopentano hasta donde se había formado el carbocatión.
.bmp)
5. En la primera imagen que se muestra a continuación, se produce un desplazamiento de alquilo pero es posible un desplazamiento de hidruro (que ocurre más rápido). ¿Por qué no ocurre un cambio de hidruro? La respuesta es porque el desplazamiento alquilo conduce a un producto más estable. Hay una cantidad notable de producto secundario que se forma donde están los dos grupos metilo, pero el producto principal que se muestra a continuación sigue siendo el más significativo debido a la hiperconjugación que se produce al estar entre los dos ciclohexanos.
6.

7.
.png)
Referencias
- Vollhardt, K. Peter C. Estructura y función de la química orgánica. Nueva York: W.H. Freeman, 2007.
- Smith, Michael B. y Jerry March. Reacciones, mecanismos y estructura de la Química Orgánica Avanzada de March (Química Orgánica Avanzada de Marzo). Nueva York: Wiley-Interscience, 2007 2007.
- Roderic P. Quirk, Robert E. Lea, Desmercuración reductiva de bromuro hex-5-enil-1-mercúrico por hidruros metálicos. Reordenamiento, efectos isótopos y mecanismo, J. Am. Chem. Soc. , 1976, 98 (19), pp 5973—5978.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Lance Peery (UCD), Duyen Dao-Tran (UCD)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Jim Clark (Chemguide.co.uk)
Prof. Steven Farmer (Sonoma State University)


