10.6:10.6 Reducción de alquinos
- Page ID
- 76021
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivo de aprendizaje
- predecir los productos y especificar los reactivos para la reducción total o parcial de alquinos
Introducción y descripción general
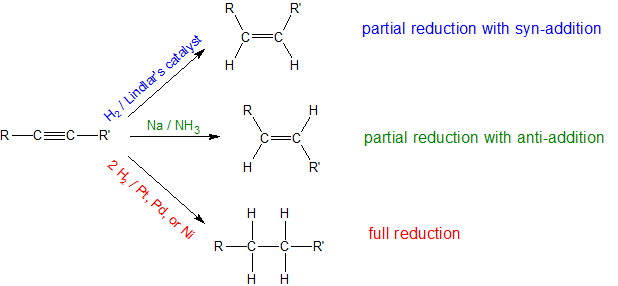
Los alquinos pueden sufrir reacciones de reducción similares a los alquenos. Estas reacciones también se denominan reacciones de hidrogenación. Con la presencia de dos enlaces pi dentro de los triples enlaces carbono-carbono, las reacciones de reducción pueden ser parciales o completas dependiendo de los reactivos. Dado que la reducción parcial de un alquino produce un alqueno, la estereoquímica del mecanismo de adición determina si se forma el alqueno cis o trans. Las tres reacciones de reducción de alquinos más significativas se resumen a continuación.
Hidrogenación y Estabilidad Relativa de Hidrocarburos
Al igual que los alquenos, los alquinos se someten fácilmente a hidrogenación catalítica parcialmente a alquenos cis o trans o completamente a alcanos dependiendo de la reacción empleada.
La adición catalítica de hidrógeno al 2-butirino proporciona datos de calor de reacción que reflejan las estabilidades termodinámicas relativas de estos hidrocarburos, como se muestra anteriormente. De los calores de hidrogenación, mostrados en azul en unidades de kcal/mol, parecería que los alquinos son termodinámicamente menos estables que los alquenos en mayor grado que los alquenos son menos estables que los alcanos. Las energías de enlace estándar para los enlaces carbono-carbono confirman esta conclusión. Así, un doble enlace es más fuerte que un enlace sencillo, pero no el doble de fuerte. La diferencia (63 kcal/mol) puede considerarse como la fuerza del componente de enlace π. De manera similar, un triple enlace es más fuerte que un doble enlace, pero no 50% más fuerte. Aquí la diferencia (54 kcal/mol) puede tomarse como la fuerza del segundo enlace π. El debilitamiento de 9 kcal/mol de este segundo enlace π se refleja en el calor de los números de hidrogenación (36.7 - 28.3 = 8.4).
Hidrogenación catalítica de un alquino
Los alquinos se pueden hidrogenar completamente en alcanos con la ayuda de un catalizador de platino, paladio o níquel. Debido a que la reacción se cataliza sobre la superficie del metal, es común que estos catalizadores se dispersen sobre carbono (Pd/C) o se dispersen finamente como níquel (Raney-Ni). La reducción total de 2-butina se muestra a continuación como ejemplo.
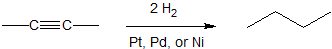
Hidrogenación de un Alquino a un Cis-Alqueno
Dado que los alquinos son termodinámicamente menos estables que los alquenos, esperamos que las reacciones de adición de alquinos sean más exotérmicas y relativamente más rápidas que las reacciones equivalentes de alquenos. Para la hidrogenación catalítica, los catalizadores de Pt, Pd o Ni son tan efectivos para promover la adición de hidrógeno a ambos enlaces carbono-carbono dobles y triples que no se puede aislar el intermedio alqueno formado por la adición de hidrógeno a un alquino. Un catalizador menos eficiente, el catalizador de Lindlar permite que los alquinos se conviertan en alquenos sin reducción adicional a alcano. El Catalizador de Lindlar transforma un alquino en un cis-alqueno porque la reacción de hidrogenación se produce en la superficie del metal. Ambos átomos de hidrógeno se agregan al mismo lado del alquino como se muestra en el mecanismo de adición sin-para la hidrogenación de alquenos en el capítulo anterior.
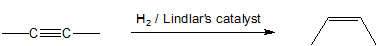
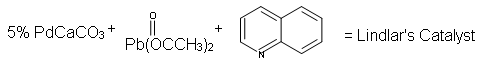
El catalizador de Lindlar se prepara desactivando (o envenenando) un catalizador de paladio convencional. El catalizador de Lindlar tiene tres componentes: paladio-carbonato cálcico, acetato de plomo y quinolina. La quinolina sirve para evitar la hidrogenación completa del alquino a un alcano. Este enfoque es similar al utilizado para la hidratación de alquinos utilizando un dialquil borano para la hidroboración. Un reactivo fuerte se modifica en una forma menos reactiva.
Hidrogenación de un Alquino a un Trans-Alqueno
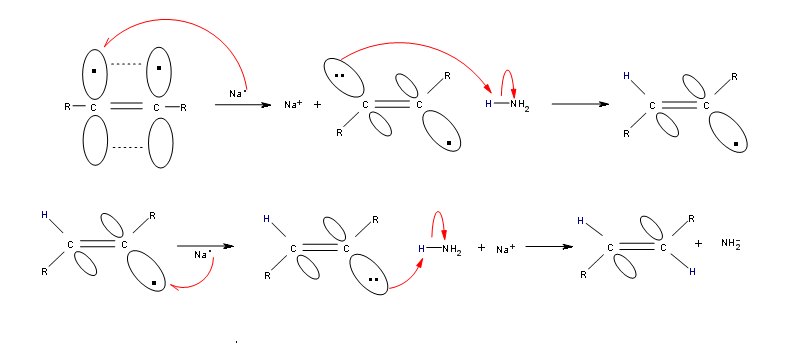
Los alquinos se pueden reducir a trans-alquenos con el uso de sodio disuelto en un disolvente de amoníaco. Un radical sodio dona un electrón a uno de los orbitales p en el triple enlace carbono-carbono. Esta reacción forma un anión que puede ser protonado por un átomo de hidrógeno en el disolvente de amoníaco que incita a otro radical de sodio a donar un electrón al segundo orbital p. El anión resultante también es protonado por un hidrógeno del disolvente de amoníaco para producir un trans-alqueno de acuerdo con el mecanismo que se muestra a continuación.
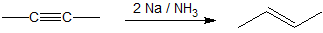
Mecanismo de Hidrogenación de Alquinos a Transalquenos
Ejercicio
1. Usando cualquier alquino cómo prepararías los siguientes compuestos: pentano, trans -4-metil-2-penteno, cis- 4-metil-2-penteno.
- Responder
-
1.

Colaboradores
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

