2.2: Átomos y Química Básica
- Page ID
- 53931
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)A. Visión general de los elementos y los átomos
La diferencia entre elementos y átomos suele confundirse en una conversación casual. Ambos términos describen materia, sustancias con masa. Diferentes elementos son diferentes tipos de materia que se distinguen por diferentes propiedades físicas y químicas. A su vez, el átomo es la unidad fundamental de la materia..., es decir, de un elemento.
El número de protones cargados positivamente y neutrones neutros en un núcleo atómico representan la mayor parte de la masa de un átomo. Cada electrón cargado negativamente que orbita un núcleo es aproximadamente 1/2000 de la masa de un protón o neutrón. Así, no agregan mucho a la masa de un átomo. Los electrones permanecen en órbitas atómicas debido a las fuerzas electromagnéticas, es decir, su atracción hacia los núcleos cargados positivamente. El tamaño nuclear (masa) y la nube de electrones alrededor de su núcleo definen la estructura de un átomo. Y esa estructura dicta las distintas propiedades de los elementos.
Recordemos que los átomos son químicamente más estables cuando están eléctricamente descargados, con igual número de protones y electrones. Los isótopos del mismo elemento son átomos con el mismo número de protones y electrones, pero un número diferente de neutrones. Por lo tanto, los isótopos también son químicamente estables, pero pueden no ser físicamente estables. Por ejemplo, el isótopo más abundante de hidrógeno contiene un protón, un electrón y ningún neutrones. El núcleo del isótopo deuterio de hidrógeno contiene un neutrón y el de tritio contiene dos neutrones. Ambos isótopos se pueden encontrar en moléculas de agua. El deuterio es estable. Por el contrario, el átomo de tritio es radiactivo, sujeto a desintegración nuclear con el tiempo. Ya sean físicamente estables o no, todos los isótopos de un elemento comparten las mismas propiedades químicas y electromagnéticas y se comportan de la misma manera en las reacciones químicas.
Las fuerzas electromagnéticas que mantienen a los electrones orbitando sus núcleos permiten la formación de enlaces químicos en las moléculas. Modelamos átomos para ilustrar la ubicación física promedio de los electrones (el modelo orbital) por un lado, y sus niveles de energía potencial (el modelo Bohr o shell) por el otro. Mira los modelos para helio ilustrados a continuación.
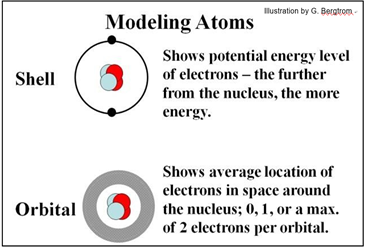
Hasta dos electrones se mueven en un espacio definido como orbital. Además de ocupar diferentes áreas alrededor del núcleo, los electrones existen a diferentes niveles de energía, moviéndose con diferente energía cinética. Los electrones también pueden absorber o perder energía, saltando o cayendo de un nivel de energía a otro.
Un número atómico único (número de protones) y masa atómica (generalmente medida en Daltons, o Da) caracterizan diferentes elementos. Un símbolo único con un número atómico superíndice y un número de masa atómica subíndice define cada elemento. Tomemos el isótopo más común de carbono (C) por ejemplo. Su número atómico es 6 (el número de protones en su núcleo) y su masa es de 12 Da (¡6 protones y 6 neutrones a 1 Da cada uno!). ¡Recuerda que la masa de los electrones en un átomo de carbono (C) es insignificante!
Encuentra el átomo de C y mira algunos de los otros átomos de elementos en la tabla periódica parcial a continuación.
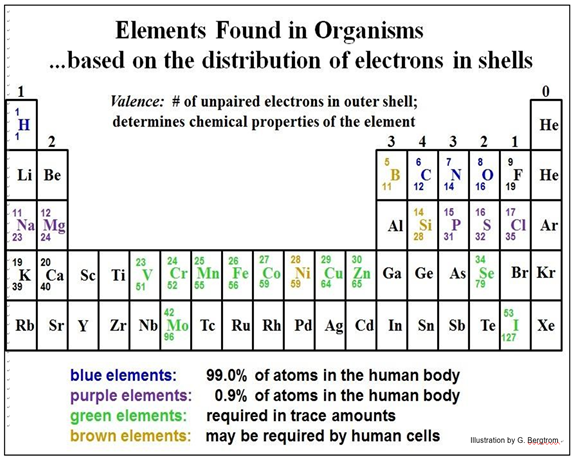
Esta tabla periódica parcial muestra los elementos esenciales para toda la vida en mayores o menores cantidades, así como algunos que también pueden ser esenciales en los humanos.
B. Configuración de electrones: conchas y subcáscaras
El modelo Bohr del átomo revela cómo los electrones pueden absorber y liberar energía. Las conchas indican los niveles de energía de los electrones. Los electrones pueden absorber diferentes tipos de energía (radiación, luz, eléctrica). Por ejemplo, la luz UV radiante en los átomos puede excitar electrones. Si un electrón absorbe un cuántico completo de energía (o un fotón de energía radiante), se impulsará desde el estado fundamental (el caparazón que normalmente ocupa) a un caparazón superior, un estado excitado. Los electrones excitados se mueven a mayor velocidad alrededor del núcleo, con más energía cinética que en tierra. Los electrones excitados también tienen más energía potencial que los electrones de estado fundamental. Esto se debe a que son inestables, liberando parte de la energía ganada durante la excitación a medida que regresan a tierra, es decir, su nivel de energía inicial (caparazón), como se muestra a continuación.
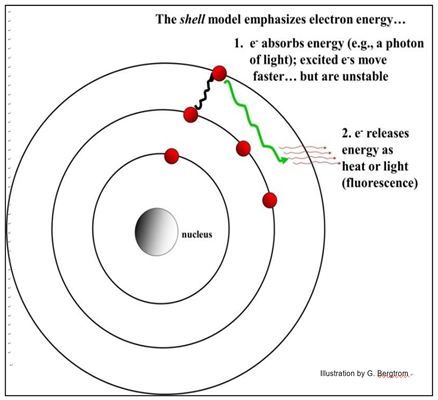
Los electrones que caen de nuevo a tierra normalmente liberan energía de excitación como calor. Átomos cuyos electrones excitados liberan su energía como fluorescencia de la luz; son fluorescentes. Una luz fluorescente es un ejemplo de este fenómeno; la energía eléctrica excita electrones fuera de los orbitales atómicos en moléculas que recubren la superficie interior de la bombilla. A medida que todos esos electrones excitados regresan al estado fundamental, ellos fluorescen, liberando luz. Estos átomos pueden ser excitados repetidamente por la electricidad. Como veremos, biólogos y químicos han convertido la fluorescencia en herramientas de bioquímica, biología molecular y microscopía. Al estado fundamental también se le llama estado de reposo, ¡pero los electrones en tierra no descansan de ninguna manera! Simplemente se mueven con menos electrones excitados por energía cinética.


