2.5: Alguna Bioquímica Básica- Carbono, Monómeros, Polímeros y la Síntesis y Degradación de Macromoléculas
- Page ID
- 53933
Al igual que la evolución, el origen de la vida implicó alguna 'selección natural' prebiótica de químicos en el ambiente. Al igual que con la evolución, esta selección química favorecería la expansión de posibilidades y diversidad. En términos simples, los átomos que podrían interactuar con un número máximo de otros átomos para formar el mayor número de moléculas estables habrían tenido más probabilidades de acumularse en el ambiente. El átomo de C tetravalente cumplió con estos criterios para la selección química, demostrando ser perfecto para construir un conjunto de química orgánica.
Al mismo tiempo, el agua resultó ser el lugar perfecto para lanzar experimentos de selección química prebiótica. El agua persiste como el solvente universal de la vida, lo que por cierto, es por lo que la evidencia de agua en lugares más allá de nuestra tierra nos emociona a todos!
A. Isomería en moléculas orgánicas y diversidad de formas
El esqueleto de carbono es una plataforma perfecta de diversidad de moléculas orgánicas. Las diferencias en la disposición de los átomos y grupos químicos funcionales alrededor del átomo de C resultan en isomería. Los isómeros de una molécula orgánica tienen la misma fórmula química pero diferentes formas (y así, potencialmente diferentes propiedades químicas y función bioquímica). Cuanto mayor sea el esqueleto de carbono de una molécula orgánica, mayor será la diversidad de formas moleculares disponibles para la selección química.
Mira los ejemplos de isómeros estructurales e isómeros geométricos a continuación.
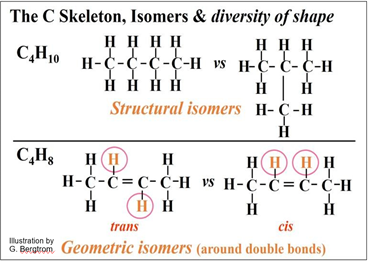
Es fácil ver que los isómeros estructurales de C4H10 (arriba izquierda y derecha) tienen diferentes formas. No se puede convertir un isómero estructural al otro sin romper los enlaces covalentes. En los isómeros geométricos de C4H8 en el panel inferior, los átomos de H en los átomos de C de doble enlace pueden estar en el mismo lado (cis) u opuesto (trans) del doble enlace plano. Los isómeros geométricos también no pueden ser interconvertidos sin romper los enlaces químicos. Los isómeros ópticos son todavía un tercer tipo de isómero. Existen alrededor de carbonos ópticamente activos (asimétricos o quirales). Un C quiral es aquel que está unido covalentemente a cuatro átomos y/o grupos moleculares diferentes. A continuación se ilustra el principio de quiralidad.
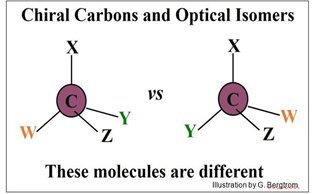
Los isómeros ópticos (también llamados enantiómeros) también difieren en forma, y al igual que los isómeros estructurales y geométricos, no se pueden convertir de uno a otro sin romper y volver a hacer enlaces covalentes. Decimos que los isómeros ópticos son ópticamente activos porque se doblan, o giran la luz en direcciones opuestas en un polarímetro. La luz que pasa a través de una solución de un isómero óptico se gira en una dirección mientras que la luz que pasa a través del otro isómero se gira en la dirección opuesta. Estas direcciones se conocen como l, o levo (que significa izquierda) y d o dextro (que significa derecha). Si una molécula tiene más de un C quiral (la glucosa por ejemplo tiene cuatro carbonos quirales), su comportamiento en un polarímetro se basará en la suma de actividades ópticas de todos los carbonos quirales. El isómero común de la glucosa en nuestra dieta es la d-glucosa. Los isómeros d y l de la glucosa se ilustran a continuación (mostrando los carbonos quirales en rojo).
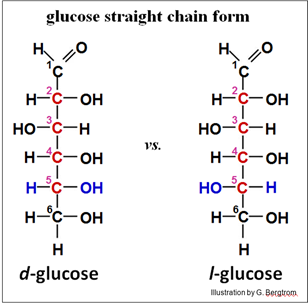
Los enantiómeros de glucosa también se denominan D y L respectivamente. Esta es una convención basada en la configuración de los cuatro átomos o grupos diferentes alrededor del último carbono ópticamente activo en una molécula (5C en glucosa). Para la glucosa, d y l de hecho corresponden a D y L respectivamente. Como veremos para algunas moléculas, la designación en mayúsculas de una molécula quiral no siempre indica cómo dobla la luz en un polarímetro, mientras que las minúsculas d y l siempre lo hacen!
Recuerde que la forma y las propiedades químicas de cualquier molécula dictan su función. El isomería en moléculas orgánicas (basadas en carbono) incrementó la diversidad de formas moleculares disponibles para la selección química. Una selección temprana de isómeros (y isómeros ópticos específicos en particular) durante la evolución química contribuyó en gran medida a las funciones químicas y reacciones que reconocemos en las células... incluso antes de que hubiera vida en la tierra. ¡Que toda la vida utilice los mismos isómeros de glucosa en reacciones energéticas y los mismos isómeros de aminoácidos para construir proteínas confirma la selección prebiótica de esos isómeros!
B. Monómeros a Polímeros y Espalda: Deshidratación Síntesis e Hidrólisis
Todos los seres vivos construyen y descomponen polímeros (macromoléculas) por síntesis de deshidratación (reacciones de condensación) e hidrólisis, respectivamente. La síntesis de deshidratación y las reacciones de hidrólisis son esencialmente la inversa entre sí, como se ilustra a continuación:
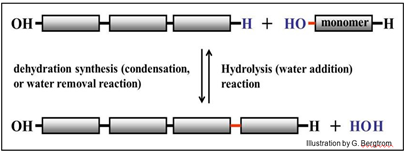
Las reacciones de condensación construyen macromoléculas al eliminar una molécula de agua de los monómeros que interactúan. El 'enlace' que se forma en una reacción de condensación no es un enlace sencillo, ¡sino un enlace que involucra varios enlaces! Los enlaces se forman eliminando un OH de un monómero y un grupo H del otro para formar una molécula de agua.
126 moléculas orgánicas Monómeros y polímeros
Reacciones de condensación repetidas como la que se muestra a continuación entre dos aminoácidos forman los enlaces peptídicos que construyen polipéptidos durante la traducción.
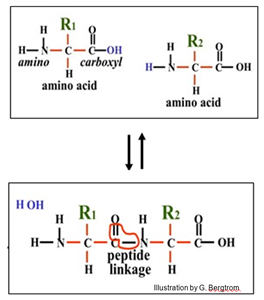
Las células realizan reacciones de condensación repetidas para construir otros polímeros, incluyendo polisacáridos y polinucleótidos (los ácidos nucleicos de ARN y ADN). Considera la polimerización de monómeros de glucosa en polisacáridos de almacenamiento o estructurales por ejemplo. Las células usan solo (d) la glucosa es utilizada por las células para elaborar polisacáridos. La glucosa de cadena lineal (d) con cuatro carbonos quirales se vuelve cíclica cuando se disuelve en agua, donde la molécula cíclica adquiere un quinto carbono quiral, que se muestra a continuación.
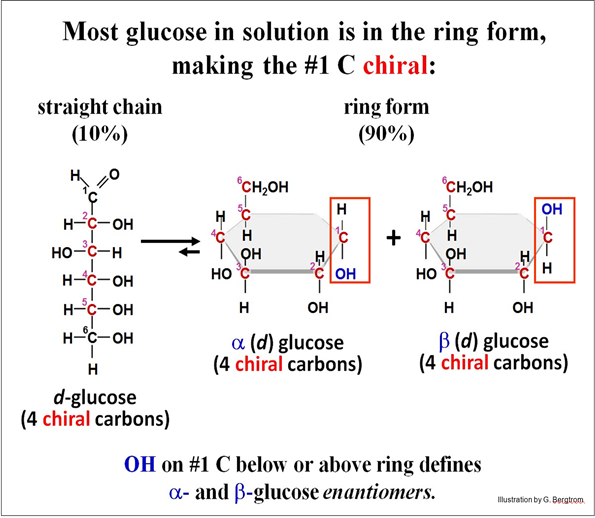
El quinto par de enantiómeros en solución se denominan a y b, o más correctamente, a (d) glucosa y b (d) glucosa. Habiendo seleccionado la d-glucosa para la mayor parte del metabolismo energético celular, la vida luego explotó el carbono quiral adicional en la d-glucosa cíclica para hacer los diferentes polímeros polisacáridos que ahora encontramos en plantas y animales.
Las reacciones de condensación que se muestran a continuación vinculan monómeros de glucosa, formando polisacáridos de almacenamiento y estructurales.
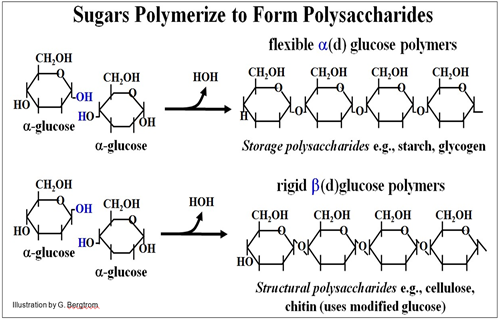
Los grupos -OH (hidroxilo) en el #1 C de la glucosa a (d) están por debajo de los anillos de glucosa. La reacción de condensación elimina una molécula de agua, uniendo los azúcares por un enlace a 1,4 glucósido en el dímero, conectándolos por sus carbonos # 1 y # 4. Otros enlaces son posibles; diversos enlaces a-glucósido caracterizan polisacáridos ramificados de almacenamiento como el glucógeno en animales y los almidones en plantas. Cuando los enantiómeros b (d) de glucosa polimerizan, forman polisacáridos estructurales rígidos como los de la celulosa en las paredes celulares vegetales. Una b-glucosa modificada llamada N-acetil glucosamina (no mostrada) polimeriza para formar quitina, el componente principal de las paredes celulares fúngicas y del exoesqueleto duro de artrópodos (insectos, crustáceos). En otro capítulo, revisaremos la vinculación de los aminoácidos en el proceso de traducción para construir un polipéptido, ¡usando solo L aminoácidos para hacer sus proteínas! También veremos los detalles de replicación y transcripción que las células utilizan para catalizar reacciones de condensación para sintetizar ADN y ARN a partir de monómeros de nucleótidos.
Para resumir:
- ¡Los vínculos en estos biopolímeros se rompen y se forman diariamente en nuestras vidas! Después de una comida que contiene proteínas y carbohidratos, la digestión, la hidrólisis de los enlaces glucósidos y peptídicos, comienza en la boca y continúa en el estómago y el intestino delgado. ¡Entonces nuestras células usan reacciones de condensación para completar el trabajo de convertir monómeros derivados de zanahoria y vaca en ti o en mí!
- La evolución química prebiótica ha seleccionado solo uno de los isómeros ópticos (enantiómeros) de glucosa, aminoácidos y otros monómeros con los que construir polímeros. Esto es así a pesar de que algunos de los diferentes isómeros están disponibles e incluso se utilizan para diferentes propósitos. El polímero flexible de glucosa a (d) se seleccionó para ser los polisacáridos de almacenamiento que utilizamos para la energía, una selección probablemente hecha por las propias células. Los polisacáridos de almacenamiento incluyen los almidones vegetales y el glucógeno animal. Asimismo, se habría seleccionado la inflexibilidad rígida de los polímeros de glucosa b (d) para reforzar la estructura celular y la estabilidad. Dado que todos los organismos almacenan energía de carbohidratos en polímeros de glucosa a (d) y dado que los polímeros de glucosa b (d) se utilizan casi universalmente para fortalecer la estructura celular, estas selecciones deben haber ocurrido temprano en la historia de la vida.
127 Carbohidratos: Azúcares y polisacáridos
128 Lípidos: Triglicéridos y Fosfolípidos
129Proteínas: Aminoácidos y Polipéptidos
130 ADN y ARN: nucleótidos y ácidos nucleicos
Para concluir este capítulo y enfatizar el significado de la quiralidad para la vida, esto es lo que puede suceder cuando el isómero equivocado termina en el lugar equivocado en el momento equivocado...
C. Un cuento de quiralidad que salió mal
Consideremos la historia de la talidomida, un trágico ejemplo de lo que sucede si desconocemos las posibilidades enantioméricas. Introducida en 1957, la talidomida se vendió como un medicamento de venta libre contra las náuseas para tratamientos contra el cáncer y como un remedio muy efectivo para las náuseas matutinas para las mujeres embarazadas. Sin embargo, a principios de la década de 1960, el nacimiento de alrededor de 10 mil infantes con extremidades severamente deformadas estaba conectado a la droga. La mitad de los infantes afectados que sobrevivieron también lo hicieron con otros defectos. Por supuesto, la respuesta fue sacar a la talidomida del mercado.
La talidomida es un teratógeno. Los teratógenos son sustancias o afecciones (fármacos, químicos, radiación, enfermedades durante el embarazo, etc.) que causan deformidades durante la embriogénesis y el desarrollo fetal. La base química de los efectos de la talidomida se basa en su estructura enantiomérica (quiral) en la que un anillo que contiene amina puede existir delante o detrás del resto de la molécula.
A continuación se muestra la estructura de la talidomida.
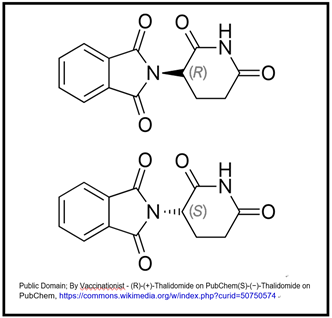
Los dos isómeros se denominan 'S' y 'R'. De estos, el isómero S es el teratógeno. Si bien es posible la síntesis de R puro, cuando se usa en tratamiento, R y S se interconvierten fácilmente, creando una mezcla racémica. En la madre, el S se transfiere al embrión o feto, con sus terribles consecuencias. Notablemente, hubo relativamente pocos casos de deformidades de nacimiento inducidas por talidomida en Estados Unidos debido a que nuestra FDA (Food and Drug Administration) aún no había aprobado el medicamento para uso clínico. Por supuesto, ya sabíamos que las células sintetizaban polímeros a partir de isómeros ópticos específicos de sus monómeros precursores. Por lo que la triste historia de la talidomida resultó de los efectos no probados de un isómero óptico inesperado. Muchos países rápidamente endurecieron sus regulaciones de pruebas de drogas previas a la aprobación debido a esta tragedia.
En un giro más esperanzador de la historia, la talidomida ha resultado ser efectiva en el tratamiento del cáncer, la lepra, la artritis reumatoide y otras enfermedades autoinmunes. Dichos beneficios terapéuticos pueden deberse a sus efectos antiinflamatorios. Sus efectos sobre el crecimiento tumoral parecen deberse a su inhibición de la angiogénesis (desarrollo de vasos sanguíneos) en los tumores. Irónicamente, el bloqueo de la angiogénesis también podría haber contribuido al fracaso del crecimiento adecuado de las extremidades durante el embarazo.
Para concluir, cuando todo es normal, las formas de las moléculas, particularmente las macromoléculas, son esenciales para la especificidad de las reacciones esenciales para la vida.


