8.5: Estructura y Organización del ADN en Bacterias
- Page ID
- 54676
La reproducción sexual permite que géneros compatibles (piense en hombres y mujeres) compartan genes, una estrategia que aumenta la diversidad de especies. Resulta que las bacterias y otros organismos unicelulares también pueden compartir genes... y propagar diversidad. Cerraremos este capítulo con una mirada al sexo (¡al estilo E. coli!) , y experimentos de mapeo de genes que muestran genes dispuestos linealmente en una molécula de ADN bacteriano circular (el 'cromosoma' bacteriano).
El sexo con E. coli comienza cuando las células F+ y F- se encuentran. Estas células son tipos de apareamiento “opuestos” que pueden compartir ADN durante la conjugación. Las células F+ contienen el plásmido F, una pequeña molécula circular de ADN que está separada del cromosoma de E. coli. El plásmido F (fertilidad) tiene genes que codifican pili sexuales en F+, así como factores necesarios para formar un puente de apareamiento, o tubo de conjugación. A continuación se muestra el comportamiento del plásmido F durante la conjugación.
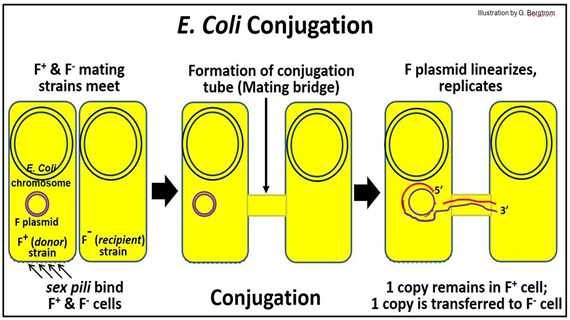
Cuando una célula F+ (donante) se encuentra con una célula F- (receptora), los pili sexuales en la célula donante inician el reconocimiento. A continuación, se forma un tubo de conjugación, que une los citoplasmas de las dos células. Después de mella una hebra del ADN plasmídico F, la mella comienza a rodar en el tubo de conjugación y en la célula receptora (F-). La cadena de ADN que ingresa a la célula receptora se replica, al igual que el círculo intacto que queda en la célula donante (el ADN replicante se muestra en rojo en la ilustración).
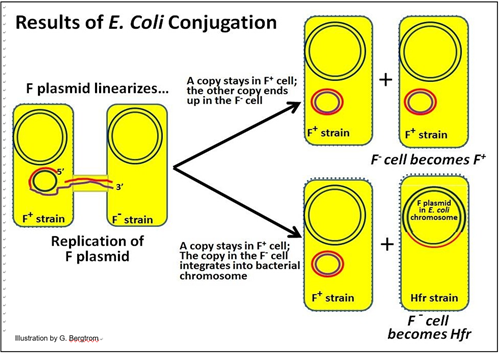
La conjugación de E. coli puede tener diferentes resultados:
1. Un resultado es que uno de los dos plásmidos F replicados semi-conservadoramente permanece en la célula donante y otro está ahora en la célula receptora. En este caso, ¡la célula receptora se convierte en una nueva célula donante F+!
2. El otro resultado es la integración del plásmido F en el ADN cromosómico de la célula receptora. La inserción es típicamente en sitios específicos en el ADN donde hay suficiente similitud de secuencia entre el plásmido y el ADN cromosómico para permitir la inserción por recombinación. El resultado es que la célula receptora se convierte en una célula Hfr (recombinación de alta frecuencia). Esta célula producirá células de progenie de la cepa Hfr.
Estos dos posibles resultados de conjugación en E. coli se ilustran a continuación.
Las células Hfr expresan fácilmente sus genes plasmídicos F integrados y, al igual que las células F+, desarrollan pili sexuales y forman un tubo de conjugación con una célula F. Una cadena del ADN cromosómico bacteriano se cortará en el sitio de inserción original del plásmido F.
Los siguientes eventos son paralelos a la transferencia replicativa de un plásmido F durante la conjugación F+/F-, excepto que solo se transfiere parte del ADN cromosómico donante Hfr, como se muestra a continuación.
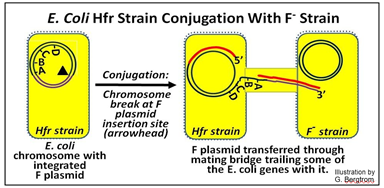
En esta ilustración, el plásmido F ha insertado 'frente' a 'un gen A para que al entrar en el tubo de conjugación, lleve consigo varios genes cromosómicos de E. coli Debido al tamaño del cromosoma bacteriano, solo unos pocos genes bacterianos ingresan al gen receptor antes de la transferencia se aborta. Pero en el breve tiempo de la transferencia de ADN, al menos algunos genes sí ingresaron a la cepa F- receptora donde se pueden expresar. Aquí hay un esquema de un experimento que permitió mapear genes bacterianos en un cromosoma circular de ADN:
1. Las células Hfr que contenían genes funcionales A, B, C, D se aparearon con células receptoras que contenían mutantes del gen A, B, C o D.
2. La conjugación se interrumpió mecánicamente en diferentes momentos después de la formación de un tubo de conjugación.
3. Las células receptoras de cada una de las conjugaciones interrumpidas se cultivaron en cultivo y se analizaron para determinar la función génica específica.
En este ejemplo hipotético, los resultados fueron que una célula receptora con un gen A mutante adquirió un gen A de tipo silvestre (y por lo tanto la función del gen A) después de poco tiempo antes de la interrupción de la conjugación. Se requirieron tiempos de conjugación progresivamente más largos (medidos en experimentos separados) para transferir los genes B, C y D (respectivamente) a la célula receptora. Así, el orden de estos genes en el cromosoma bacteriano fue
-A-B-C-D-
El momento de la conjugación que llevó a que los mutantes F- adquieran un gen funcional de la cepa Hfr fue tan refinado que no solo se pudo determinar el locus génico, ¡sino incluso el tamaño) la longitud) de los genes! Así, el tiempo para transferir un gen completo a una célula F- refleja el tamaño (longitud) del gen. La otra conclusión importante es que los genes están dispuestos linealmente en el ADN bacteriano.
Recordemos que los genes ya mapeados a lo largo de los cromosomas eucariotas implicaban un orden lineal de los genes. Sin embargo, poco se sabía sobre la estructura cromosómica eucariota en ese momento, y no se apreció el papel del ADN como “materia de genes”. Estos experimentos de apareamiento bacteriano demostraron por primera vez que los genes están dispuestos linealmente no solo a lo largo de un cromosoma, sino también a lo largo de la molécula de ADN.
Con el tiempo, se mapearon muchos genes bacterianos a lo largo del cromosoma de E. coli aislando muchas cepas diferentes de Hfr en las que se había insertado un plásmido F en diferentes sitios alrededor del círculo de ADN. Estas cepas de Hfr se aparearon con bacterias F-, cada una con mutaciones en uno u otro gen bacteriano conocido. Al igual que en el experimento original 'ABCD', se determinó el orden de muchos genes, e incluso se demostró que estaban vinculados a mayor o menor distancia a esos genes ABCD y entre sí.
El mapa que resulta de dicho estudio se esquematiza a continuación.
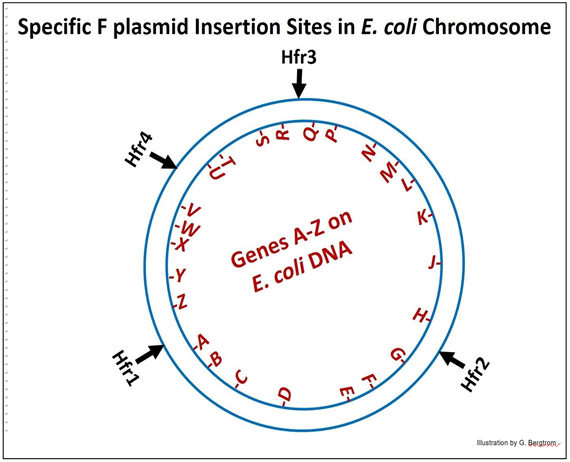
Usando las diferentes cepas de Hfr (numeradas en el diagrama) en experimentos de conjugación, se demostró que de hecho, las diferentes células Hfr transfirieron diferentes genes a las células receptoras en el orden implícito en el diagrama. Además, cuando el experimento se realizó con Hfr4 (en este diagrama genérico); el orden de los genes transferidos después de tiempos más largos de conjugación se encontró que era:
V-W-X-Y-Z-A-B...
La conclusión obvia de experimentos como estos fue que la molécula de ADN de E. coli (su 'cromosoma') era un círculo cerrado! Veremos evidencia visual de cromosomas circulares de E. coli en el próximo capítulo, con alguna discusión sobre cómo esta evidencia informó nuestra comprensión de la replicación del ADN.


