12.9: Motilidad Celular
- Page ID
- 53357
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hay una serie de formas en las que una celda puede moverse de un punto en el espacio a otro. En un medio líquido, ese método puede ser algún tipo de natación, utilizando movimiento ciliar o flagelar para impulsar la célula. En superficies sólidas, esos mecanismos claramente no funcionarán de manera eficiente, y la celda se somete a un proceso de rastreo. En esta sección, comenzamos con una discusión sobre el movimiento ciliar/flagelar, para luego considerar los requisitos más complicados del rastreo celular.
Los cilios y flagelos, que difieren principalmente en longitud y no en construcción, son orgánulos a base de microtúbulos que se mueven con un movimiento de ida y vuelta. Esto se traduce en “remar” por los cilios relativamente cortos, pero en los flagelos más largos, la flexibilidad de la estructura hace que el movimiento de ida y vuelta se propague como una ola, por lo que el movimiento flagelar es más ondulado o similar a un látigo (considere lo que sucede cuando mueve una manguera de jardín rápidamente de lado a lado en comparación con una pieza corta de la misma manguera). El núcleo de cualquiera de las estructuras se llama axonema, que está compuesto por 9 dobletes de microtúbulos conectados entre sí por proteínas motoras de dineína ciliar, y rodeando un núcleo central de dos microtúbulos separados.
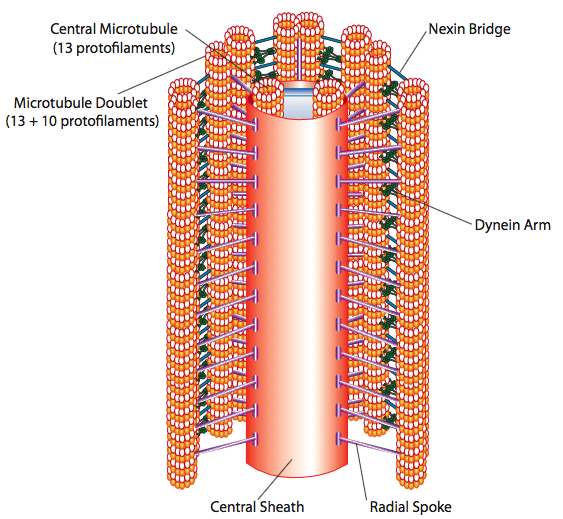
Esto se conoce como la formación “9+2”, aunque los nueve dobletes no son lo mismo que los dos microtúbulos centrales. El túbulo A es un total de 13 protofilamentos, pero el túbulo B fusionado a él contiene sólo 10 protofilamentos. Cada uno de los microtúbulos centrales es un total de 13 protofilamentos. El axonema 9+2 extiende la longitud del cilio o flagelo desde la punta hasta llegar a la base, y se conecta al cuerpo celular a través de un cuerpo basal, que está compuesto por 9 trillizos de microtúbulos dispuestos en un barril corto, al igual que los centriolos de los que se derivan.
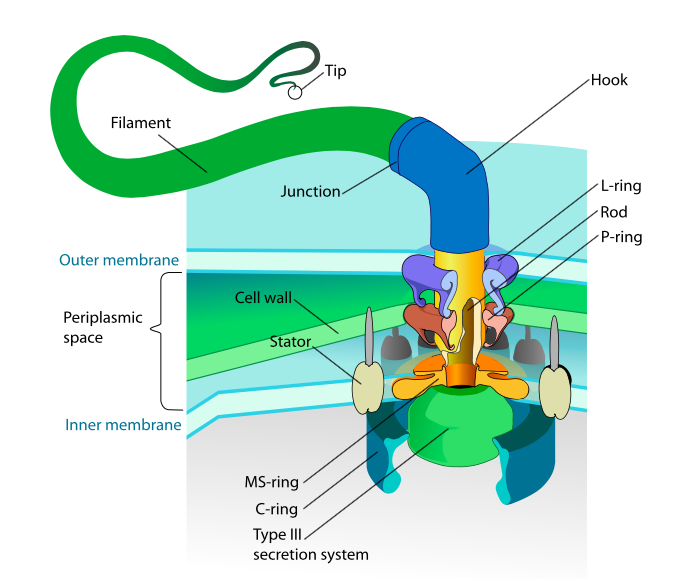
Esta sección se refiere únicamente a los eucariotas. Algunos procariotas también tienen apéndices móviles llamados flagelos, pero son completamente diferentes tanto en estructura como en mecanismo. Los flagelos en sí son polímeros helicoidales largos de la proteína flagelina, y la base de las fibras de flagelina está conectada a una proteína motora rotacional, no a un motor traslacional. Este motor (Figura\(\PageIndex{18}\)) utiliza iones (H + o Na + dependiendo de la especie) en un gradiente electroquímico para proporcionar la energía para rotar hasta 100000 revoluciones por minuto. Se piensa que la rotación es impulsada por cambios conformacionales en el anillo del estator, enclavado en la membrana celular.
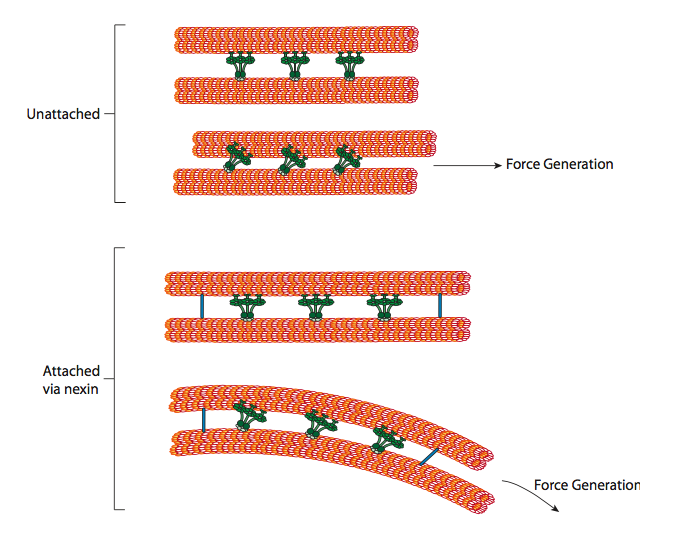
Las dineínas ciliares proporcionan la capacidad motora, pero también hay otras dos proteínas ligantes en el axonema. Hay nexínas que unen el túbulo A de un doblete al túbulo B de su doblete adyacente, conectando así el anillo exterior. Y, hay radios radiales que se extienden desde el túbulo A de cada doblete hasta el par central de microtúbulos en el núcleo del axonema. Ninguno de estos tiene actividad motora alguna. Sin embargo, son cruciales para el movimiento de cilios y flagelos porque ayudan a transformar un movimiento deslizante en un movimiento de flexión. Cuando la dineína ciliar (muy similar a las dineínas citoplásmicas pero tiene tres cabezas en lugar de dos) se acopla, se une a un microtúbulo A en un lado, un microtúbulo B del doblete adyacente, y se mueve uno relativo al otro. Una línea de estos dineínes moviéndose en concierto deslizaría así un doblete relativo al otro, si (y es un gran “si”) los dos dobletes tuvieran total libertad de movimiento. Sin embargo, dado que los dobletes están interconectados por las proteínas de nexina, lo que sucede cuando un doblete intenta deslizarse es que dobla la estructura conectada en su lugar (Figura\(\PageIndex{17}\)). Esta curva explica el movimiento de remo de los cilios, que son relativamente cortos, así como el movimiento de azotes de los flagelos largos, que propagan el movimiento de flexión por el axonema.
Si bien pensamos en el movimiento ciliar y flagelar como métodos para la propulsión de una célula, como la natación flagelar de espermatozoides hacia un óvulo, también hay una serie de lugares importantes en los que la célula es estacionaria, y los cilios se utilizan para mover el líquido más allá de la célula. De hecho, hay células con cilios en la mayoría de los órganos principales del cuerpo. Se han reportado varias discinesias ciliares, de las cuales la más destacada, la discinesia ciliar primaria (PCD), que incluye el síndrome de Kartagener (KS), se debe a la mutación del gen DNAI1, que codifica una subunidad (cadena intermedia 1) de dineína axonemal (ciliar). La PCD se caracteriza por dificultad respiratoria por infección recurrente, y el diagnóstico de KS se realiza si también existe situs inversus, condición en la que se invierte la asimetría normal izquierda-derecha del cuerpo (por ejemplo, estómago a izquierda, hígado a derecha). El primer síntoma se debe a la inactividad de los numerosos cilios de las células epiteliales en los pulmones. Su función normal es mantener constantemente en movimiento el moco en la vía respiratoria. Normalmente el moco ayuda a mantener los pulmones húmedos para facilitar la función, pero si el moco se vuelve estacionario, se convierte en un caldo de cultivo para las bacterias, además de convertirse en un irritante y obstáculo para el correcto intercambio de gases.
Situs inversus es una malformación interesante porque surge en el desarrollo embrionario, y afecta solo al 50% de los pacientes con PCD porque la alteración de la función ciliar provoca aleatorización de asimetría izquierda-derecha, no reversión. En términos muy simples, durante el desarrollo embrionario temprano, la asimetría izquierda-derecha se debe en parte al movimiento de señales moleculares en un ow hacia la izquierda a través del nodo embrionario. Este flujo es causado por el latido coordinado de los cilios, por lo que cuando no funcionan, el flujo se interrumpe y se produce la aleatorización.
Otros síntomas de los pacientes con PCD también señalan el trabajo de los cilios y flagelos en el cuerpo. La infertilidad masculina es común debido a los espermatozoides inmóviles. La infertilidad femenina, aunque menos común, también puede ocurrir, debido a la disfunción de los cilios del oviducto y las trompas de Falopio que normalmente mueven el óvulo a lo largo del ovario al útero. Curiosamente también existe una baja asociación de hidrocefalia interna (sobrellenado de los ventrículos del cerebro con líquido cefalorraquídeo, provocando su agrandamiento que comprime el tejido cerebral que los rodea) con PCD. Esto probablemente se deba a la disfunción de los cilios en las células ependimales que recubren los ventrículos, y que ayudan a circular el LCR, pero aparentemente no son completamente necesarios. Dado que se cree que el flujo a granel de LCR es impulsado principalmente por el cambio de sístole o diástole en la presión arterial en el cerebro, algunos plantean la hipótesis de que los cilios pueden estar involucrados principalmente en ow a través de algunos de los canales más estrechos en el cerebro.
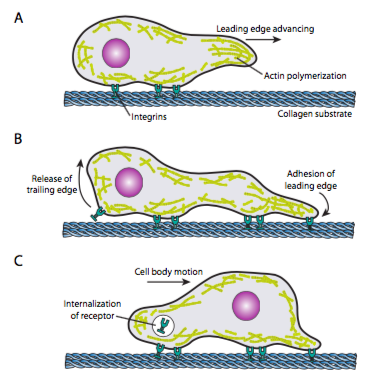
El rastreo celular (Figura\(\PageIndex{19}\)) requiere el reordenamiento coordinado de la red de microfilamentos del borde de ataque, extendiéndose (tanto por polimerización como por deslizamiento de filamentos) y luego formando adherencias en el nuevo punto más adelante. Esto puede tomar la forma de filopodios o lamellipodios, y a menudo ambos simultáneamente. Los filopodios son proyecciones largas y muy delgadas con haces centrales de microfilamentos paralelos y altas concentraciones de receptores de superficie celular. Su propósito es principalmente sentir el entorno. Lamellipodia a menudo se extiende entre dos lopodios y es más un volante ancho que un dedo. Internamente, la actina se forma más en mallas que en haces, y el borde más ancho permite que se hagan más adherencias al sustrato. Luego, la red de microfilamentos se reorganiza nuevamente, esta vez abriendo un espacio en el citoplasma que actúa como canal para el movimiento de los microtúbulos hacia el frente de la célula. Esto coloca la red de transporte en su lugar para ayudar a mover el material a granel intracelular hacia adelante. A medida que esto ocurre, se liberan las viejas adherencias en el extremo de la cola de la célula. Esta liberación puede ocurrir a través de dos mecanismos primarios: la endocitosis del receptor o la desactivación del receptor por señalización/cambio conformacional. Por supuesto, esta simplificación excesiva desmiente las complejidades de coordinar y controlar todas estas acciones para lograr el movimiento dirigido de una célula.
Un modelo de generación de fuerza de microfilamentos, el Modelo de Trinquete Browniano Elástico (Mogilner y Oster, 1996), propone que debido al movimiento browniano de la membrana celular resultante de la fluctuación térmica minuto continua, los filamentos de actina que empujan hacia los bordes de la membrana se flexionan para variar grados. Si el flex es lo suficientemente grande, un nuevo monómero de actina puede encajar entre la membrana y la punta del filamento, y cuando el filamento ahora más largo se flexiona hacia atrás, puede ejercer un mayor empuje sobre la membrana. Obviamente un solo filamento no genera mucha fuerza, pero la extensión coordinada de muchos filamentos puede empujar la membrana hacia adelante.
Una vez que una célula recibe una señal para moverse, la respuesta citoesquelética inicial es polimerizar actina, construyendo más microfilamentos para incorporarlos al borde de ataque. Dependiendo de la señal (atractiva o repulsiva), la polimerización puede ocurrir en el mismo lado u opuesto de la célula desde el punto de activación de señal-receptor. Significativamente, la polimerización de la nueva f-actina por sí sola puede generar suficiente fuerza para mover la membrana hacia adelante, ¡incluso sin la participación de los motores de miosina! Se están debatiendo modelos de generación de fuerza, pero generalmente comienzan con la incorporación de nueva g-actina a un filamento en su punta; es decir, en la interfaz filamento-membrana. Aunque técnicamente eso pudiera ser suficiente, en una célula viva, las miofinas están involucradas, y ayudan a empujar y disponer los filamentos direccionalmente con el fin de establecer el nuevo borde de ataque. Además, algunos filamentos y redes deben cortarse rápidamente, y hacer nuevas conexiones, tanto entre filamentos como entre filamentos y otras proteínas como moléculas de adhesión o microtúbulos.
¿Cómo se controla la polimerización y el reordenamiento de actina? Los receptores que señalan la locomoción celular pueden iniciar vías algo diferentes, pero muchos comparten algunos puntos en común en la activación de uno o más miembros de la familia Ras de GTPasas pequeñas. Estas moléculas de señalización, como Rac, Rho y cdc42 pueden ser activadas por tirosina quinasas receptoras (ver rutas de activación de RTK-ras, capítulo 14). Cada uno de estos tiene un papel ligeramente diferente en la motilidad celular: la activación de cdc42 conduce a la formación de filopodios, Rac activa una vía que incluye Arp2/3 y cofilina a la formación de lamellipodios, y Rho activa la miosina II para controlar la adhesión focal y la formación de fibras de estrés. Un tipo diferente de cascada de receptores, la cascada de señalización de proteínas G (también Capítulo 14), puede conducir a la activación de PLC y posterior escisión de PIP 2 y aumento del Ca 2+ citosólico. Estos cambios, como se señaló anteriormente, también pueden activar la miosina II, así como las enzimas remodeladoras gelsolina, cofilina y profilina. Esto descompone las estructuras de actina existentes para hacer que la célula sea más fluida, al tiempo que contribuye con más g-actina para formar el nuevo citoesqueleto de borde de ataque.
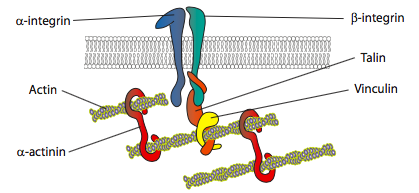
Los experimentos in vitro muestran que a medida que la membrana avanza, se hacen nuevos contactos adhesivos a través de moléculas de adhesión o receptores que se unen al sustrato (a menudo los portaobjetos o placas de cultivo celular se recubren con colágeno, filaminina u otras proteínas de la matriz extracelular). Los contactos luego reclutan elementos citoesqueléticos para una mayor estabilidad para formar una adhesión focal (Figura\(\PageIndex{20}\)). Sin embargo, la formación de adherencias focales parece ser un artefacto del cultivo celular, y no está claro si los tipos de adherencias que se forman in vivo reclutan los mismos tipos de componentes citoesqueléticos.
El tercer paso para la locomoción celular es el movimiento masivo del contenido celular hacia adelante. Los mecanismos para esta fase no están claros, pero hay cierta evidencia de que usando enlaces entre el citoesqueleto de actina en el borde de ataque y partes delanteras del citoesqueleto de microtúbulos, los microtúbulos se reordenan para formar una ruta de transporte eficiente para el movimiento masivo. Otro aspecto de esto puede ser un efecto de “acorralamiento” de las redes de actina, que abren direccionalmente el espacio hacia el borde de ataque. Luego, los microtúbulos ingresan a ese espacio más fácilmente que trabajar a través de una malla de actina apretada, forzando el flujo en la dirección adecuada.
Gran parte del trabajo sobre las interacciones microtúbulo-actina en la motilidad celular se ha realizado a través de investigaciones sobre el cono de crecimiento neuronal, al que a veces se le conoce como una célula con correa, ya que actúa casi independientemente como una célula rastrera, buscando la vía adecuada para llevar su axón desde el cuerpo celular hasta su conexión sináptica apropiada (A.W. Schaefer et al, Dev. Celda 15:146-62, 2008).
Finalmente, la celda debe deshacer sus viejas adherencias en el borde de salida. Esto puede suceder de varias maneras diferentes. In vitro, se ha observado que las células rastreras se arrancan del sustrato, dejando atrás pequeños trozos de membrana y proteínas de adhesión asociadas en el proceso. Se presume que la fuerza generada proviene de fibras de estrés actina-miosina que conducen a las adherencias focales más avanzadas. Sin embargo, hay menos mecanismos destructivos disponibles para las células. En algunos casos, la adhesividad del receptor celular para el sustrato extracelular puede regularse internamente, quizás por fosforilación o desfosforilación de un receptor. Otra posibilidad es la endocitosis del receptor, sacándolo de la superficie celular. Simplemente podría reciclarse hasta el borde de ataque donde se necesita (es decir, transcitosis), o si ya no se necesita o se daña, se puede descomponer en un lisosoma.

