23.2: Construcción de modelos
- Page ID
- 54641
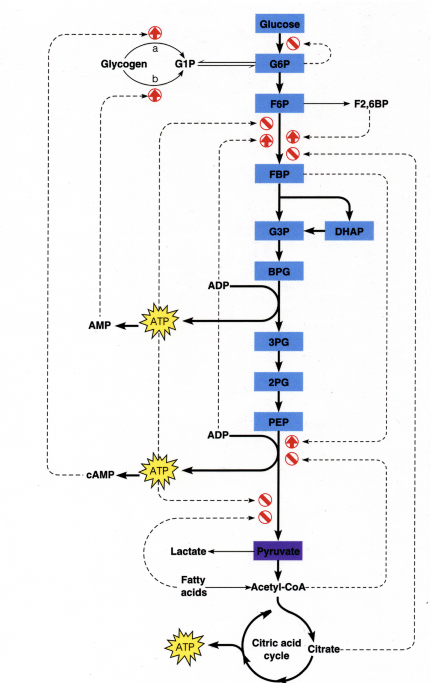
Un objetivo general del modelado metabólico es la capacidad de tomar una representación esquemática de una ruta y cambiarla en una fórmula matemática que modela la ruta. Por ejemplo, convertir la siguiente vía en un modelo matemático sería de increíble utilidad.
Reacciones Químicas
En los modelos metabólicos, nos preocupa modelar reacciones químicas que son catalizadas por enzimas. Las enzimas actúan actuando sobre un estado de transición del complejo enzima-sustrato que disminuye la energía de activación de una reacción química. El diagrama de la diapositiva 5 de la página 1 de las diapositivas de la conferencia demuestra este fenómeno. Una ecuación de velocidad típica (que describe la conversión de los sustratos S de la reacción enzimática en sus productos P) puede ser descrita por una ley de tasa de Michaelis-Menten:
\[\frac{V}{V_{\max }}=\frac{[S]}{K_{\mathrm{m}}+[S]}\nonumber\]
En esta ecuación, V es la tasa de la ecuación en función de la concentración de sustrato [S]. Es claro que los parámetros K m y V max son necesarios para caracterizar la ecuación.
La inclusión de múltiples sustratos, productos y relaciones regulatorias aumenta rápidamente el número de parámetros necesarios para caracterizar tales ecuaciones. Las figuras de las diapositivas 1, 2 y 3 de la página 2 de las notas de la conferencia demuestran la complejidad de las vías bioquímicas. El modelado cinético rápidamente se vuelve inviable: los parámetros necesarios son difíciles de medir y también varían entre organismos [10]. Así, nos interesa un método de modelado que nos permita utilizar un pequeño número de parámetros determinados con precisión. Para ello, recordamos la maquinaria básica de la estequiometría de la química general. ¡Considera la ecuación química A+2B! 3C, que dice que una unidad de reactivo A se combina con 2 unidades de reactivo B para formar 3 unidades de reactivo C. La velocidad de formación del compuesto X viene dada por la derivada temporal de [X]. Obsérvese que C se forma tres veces más rápido que A. Por lo tanto, debido a la estequiometría de la reacción, vemos que la velocidad de reacción (o flujo de reacción) viene dada por
\[f l u x=\frac{d[A]}{d t}=\frac{1}{2} \frac{d[B]}{d t}=\frac{1}{3} \frac{d[C]}{d t} \nonumber \]
Esto será útil en las secciones subsiguientes. Ahora debemos exponer los supuestos simplificadores que hacen que nuestro modelo sea manejable.
Asunción de Estado Constante
La suposición del estado estacionario supone que no hay acumulación de ningún metabolito en el sistema. Esto nos permite representar las reacciones completamente en términos de su química (es decir, las relaciones estequiométricas entre los componentes de la reacción enzimática). Tenga en cuenta que esto no implica la ausencia de flujo a través de ninguna reacción dada. Más bien, el estado estacionario implica en realidad dos supuestos que son críticos para simplificar el modelado metabólico. La primera es que las concentraciones internas de metabolitos son constantes, y la segunda es que los flujos, es decir, los flujos de entrada y salida, también son constantes.
Una analogía es una serie de cascadas que aportan agua a las piscinas. A medida que el agua cae de una alberca a otra, los niveles de agua no cambian a pesar de que el agua sigue fluyendo (ver página 2 diapositiva 5). Este marco nos impide ser obstaculizados por la cinética transitoria demasiado complicada que puede resultar de las perturbaciones del sistema. Dado que generalmente nos interesan las capacidades metabólicas a largo plazo (funciones en una escala superior a milisegundos o segundos), la dinámica del estado estacionario puede darnos toda la información que necesitamos.
La suposición de estado estacionario hace que la capacidad de generalizar entre especies y reutilizar vías conservadas en modelos sea mucho más factible. Las estequiometrías de reacción a menudo se conservan en todas las especies, ya que solo implican la conservación de la masa. La biología de la catálisis enzimática, y los parámetros que la caracterizan, no se conservan de manera similar. Estos incluyen parámetros dependientes de especies como la energía de activación de una reacción, la anidad del sustrato de una enzima y las constantes de velocidad para diversas reacciones. Sin embargo, ninguno de estos es requerido para el modelado en estado estacionario.
También es de interés señalar que, dado que las constantes de tiempo para las reacciones metabólicas suelen ser del orden de los milisegundos, la mayoría de las tecnologías de medición utilizadas hoy en día no son capaces de capturar estas dinámicas extremadamente rápidas. Este es el caso de mediciones basadas en espectrometría de masas metabolómica, por ejemplo. En este método, las cantidades de todos los metabolitos internos en un sistema se miden en un momento dado, pero las mediciones se pueden tomar en el mejor de los casos cada hora. En la mayoría de las circunstancias, todo lo que se mide es el estado estacionario.
Reconstrucción de vías metabólicas
Existen varias bases de datos que pueden proporcionar la información necesaria para reconstruir vías metabólicas in silico. Estas bases de datos permiten acceder a la estequiometría de reacción usando números de Enzyme Commission. Las estequiometrías de reacción son las mismas en todos los organismos que utilizan una enzima dada. Entre las bases de datos de interés se encuentran ExPASY [5], MetaCyC [16] y KEGG [14]. Estas bases de datos a menudo contienen vías organizadas por función que se pueden descargar en formato SBML, lo que hace que la reconstrucción de vías sea muy fácil para vías bien caracterizadas.


