19.2C: Antibióticos
- Page ID
- 57015
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Los humanos, y nuestros animales domésticos, pueden servir como hospedadores de una amplia variedad de organismos causantes de enfermedades (patógenos) incluyendo bacterias, virus, hongos, protozoos, helmintos (gusanos). En esta página se examinarán únicamente aquellos agentes químicos que se utilizan para combatir patógenos bacterianos.
EL PROBLEMA
Hay muchos químicos que son letales para las bacterias -el cianuro hace un buen trabajo- pero no se pueden usar para curar infecciones porque también son letales para el huésped. El problema, entonces, es encontrar sustancias que ataquen una vía metabólica que se encuentra en la bacteria pero no en el huésped. Este no es un problema insuperable para los patógenos bacterianos porque difieren en muchos aspectos de los eucariotas.
La Solución
Productos naturales. Se han descubierto una serie de productos naturales, penicilina por ejemplo, que son antibióticos adecuados para la terapia. Originalmente fueron descubiertos como secreciones de hongos o bacterias del suelo. Los suelos son ecosistemas complejos, y no es de extrañar que sus habitantes hayan desarrollado defensas químicas entre sí.

La foto (cortesía de Merck & Co., Inc.) muestra cómo el crecimiento de bacterias en el agar en una placa de cultivo ha sido inhibido por las tres colonias circulares del hongo Penicillium notatum. El antibiótico penicilina, que se difunde hacia afuera de las colonias, es el responsable de este efecto. Hoy en día, la penicilina se elabora a partir de cultivos de Penicillium chrysogenum que ha sido especialmente adaptado para altos rendimientos.
- Productos semisintéticos. Se trata de productos naturales que han sido modificados químicamente en el laboratorio (e instalación farmacéutica) para
- mejorar la eficacia del producto natural
- reducir sus efectos secundarios
- evitar el desarrollo de resistencia por las bacterias objetivo
- ampliar la gama de bacterias que se pueden tratar con él
- Productos completamente sintéticos. Los sulfa son ejemplos.
Sulfa y Análogos de Ácido Fólico
Sulfa
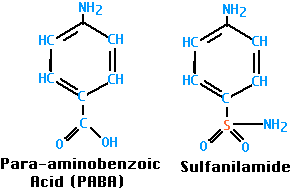
La sulfanilamida fue el primer agente antibacteriano. Muchos otros medicamentos sulfa (como el sulfametoxazol) han entrado en uso desde entonces.
Tanto las bacterias como sus huéspedes humanos requieren ácido fólico para la síntesis de ácidos nucleicos (se convierte en purinas y timidina) así como la síntesis de proteínas (precursor de los aminoácidos metionina y glicina). No obstante, las bacterias sintetizan su ácido fólico partiendo del ácido para-aminbenzoico (PABA), mientras que debemos ingerir nuestro ácido fólico ya formado; es decir, para nosotros es una vitamina.
La sulfanilamida, y las demás sulfamidas, son análogos de PABA; compiten con PABA y, cuando se eligen, bloquean la síntesis de ácido fólico. Los mamíferos ignoran el PABA y sus análogos y, por lo tanto, pueden tolerar sulfa
Análogos de Acido
Estas moléculas sintéticas bloquean el paso final en la conversión de PABA en ácido fólico por lo que también bloquean la síntesis de nucleótidos y proteínas en bacterias pero no en mamíferos. La trimetoprima es una de varias en uso actual. Estos análogos de ácido fólico se utilizan a menudo en combinación con un fármaco sulfa.
Las Beta-Lactamas
Las beta-lactamas incluyen las
- penicilinas como
- penicilina G (un producto natural) producida por el hongo Penicillium chrysogenum
- ampicilina (un semisintético)
- amoxicilina (semisintética)
- cefalosporinas Hay más de dos docenas de ellas en uso actual. La mayoría son semisintéticos derivados de la secreción del moho Cephalosporium. Algunos ejemplos:
- cefalexina (por ejemplo, Keflex®)
- cefaclor (p. ej., Ceclor®)
- cefixima (por ejemplo, Suprax®)
- carbapenémicos como
- meropenem (Merrem®)
- ertapenem (Invanz®)
Todas las beta-lactamas funcionan interfiriendo con la síntesis de la pared celular bacteriana, una estructura que no se encuentra en los eucariotas. Las paredes de las bacterias están hechas de un material polimérico complejo llamado peptidoglicano.

El peptidoglicano contiene tanto aminoácidos como aminoazúcares. Los aminoazúcares son de dos tipos
- N-acetilglucosamina (NAG) y su pariente cercano
- Ácido N-acetilmurámico (NAM).
Estos dos forman un polímero lineal de NAG alternando con NAM. Están unidos por un enlace glicosídico entre los carbonos #1 y #4 (este es el enlace atacado por la lisozima) y están orientados de la misma manera que están en la celulosa. Cadenas laterales que contienen 4 o 5 aminoácidos están unidas a cada NAM. Estos forman enlaces covalentes con aminoácidos en cadenas adyacentes. Los enlaces pueden ser directos a la siguiente cadena o incluir puentes cruzados peptídicos adicionales (por ejemplo, 5 residuos de glicina) que se extienden a cadenas en el mismo plano (mostrado aquí) así como a cadenas por encima y por debajo.
Esta estructura elaborada, reticulada covalentemente proporciona la gran resistencia de la pared celular. También lleva a la notable conclusión de que la pared celular bacteriana cumple con la definición de ¡una sola molécula!
Los antibióticos beta-lactámicos se unen e inhiben las enzimas necesarias para la síntesis de la pared del peptidoglicano. Si bien tienen poco efecto sobre las bacterias en reposo, son letales para dividir las bacterias ya que las paredes defectuosas no pueden proteger al organismo de forma que estalla en un entorno hipotónico.
Aminoglucósidos
Estos son productos de actinomicetos (bacterias del suelo) o derivados semisintéticos de los productos naturales.
Los ejemplos son:
- estreptomicina
- kanamicina
- neomicina
- gentamicina
El ribosoma bacteriano de los años 70 difiere en varias formas del ribosoma eucariota de los 80. Los aminoglucósidos se unen a la subunidad 30S del ribosoma bacteriano e interfieren con la formación del complejo de iniciación. También provocan una mala lectura del ARNm. Aunque el ribosoma eucariota en el citosol no se ve relativamente afectado por estos fármacos, los ribosomas en las mitocondrias son 70 y son sensibles a sus efectos.
Tetraciclinas
Se trata de productos naturales derivados de actinomicetos del suelo o sus derivados semisintéticos. Ejemplos:
- clortetraciclina (aureomicina®)
- oxitetraciclina (terramycin®)
- doxiciclina
- tigeciclina (Tygacil®)
Las tetraciclinas se unen a la subunidad 30S del ribosoma bacteriano. Evitan la transferencia de aminoácidos activados al ribosoma por lo que se detiene la síntesis de proteínas.
Macrólidos, Lincosamidas, Estreptograminas y Cetolidos
La grieta en la armadura = el ribosoma bacteriano
Estos antibióticos se unen a la subunidad grande (50S) del ribosoma bacteriano donde bloquean la creciente cadena peptídica para que no salga del ribosoma, lo que dificulta severamente la síntesis de proteínas. Debido a su acción similar, el desarrollo de resistencia antibiótica a uno generalmente se extiende a todos los demás.
Macrólidos
Los macrólidos también son productos de actinomicetos (bacterias del suelo) o derivados semisintéticos de los mismos. La eritromicina, la azitromicina (Zithromax®) y la claritromicina (Biaxin®) son macrólidos comúnmente recetados.
Lincosamidas
El primer miembro de este grupo también se aisló de un actinomiceto del suelo (encontrado cerca de Lincoln, Nebraska). Un derivado semisintético, llamado clindamicina (Cleocin®), ahora es ampliamente utilizado contra bacterias Gram-positivas.
Estreptograminas
Quinupristin y dalfopristina son ejemplos. A partir del 1 de octubre de 1999, se venderán como mezcla bajo el nombre comercial Synercid. Combinados, muestran una gran promesa en el tratamiento de ciertas infecciones resistentes a la vancomicina, actualmente el antibiótico de último recurso para algunas infecciones adquiridas en el hospital.
Cetolidos
Los cetólidos son derivados de macrólidos. La telitromicina (Ketek®) es un ejemplo. Los cetólidos también se unen a la subunidad 50S del ribosoma bacteriano. Al hacerlo hacen que induzca cambios de marco durante la traducción. Las bacterias que se han vuelto resistentes a macrólidos, lincosamidas y estreptograminas siguen siendo susceptibles a los cetólidos.
Fluoroquinolonas
Ciprofloxacino (Cipro®), levofloxacino y norfloxacino son ejemplos. Cipro es el antibiótico preferido para las personas que han estado expuestas intencionalmente al ántrax, aunque algunos otros antibióticos parecen ser igualmente efectivos.
La grieta en la armadura = ADN topoisomerasas
Las fluoroquinolonas bloquean la acción de dos topoisomerasas bacterianas, enzimas que alivian las bobinas que se forman en el ADN cuando se abre la hélice en preparación para la replicación o transcripción o reparación. Las topoisomerasas en eucariotas no se ven afectadas.
polipeptidos
El más común de estos es la polimixina E (también conocida como colistina). Se comporta como un detergente, aumentando la permeabilidad de las membranas que encierra las bacterias y provocando que el contenido de la célula bacteriana se escape.
Rifampina
Este antibiótico semisintético se une a la ARN polimerasa bacteriana y le impide desempeñar su papel en la transcripción. Su afinidad por la enzima eucariota equivalente es mucho menor. La rifampicina también se conoce como rifampicina.
Mupirocina
Este antibiótico bloquea la acción de la isoleucina ARNt sintetasa bacteriana, la enzima responsable de unir el aminoácido isoleucina (Ile) a su ARNt en preparación para la síntesis de proteínas, por lo que se inhibe la síntesis de proteínas. Se ahorra la enzima eucariota equivalente.
Cicloserina
La cicloserina inhibe la síntesis de la pared celular bacteriana pero por un mecanismo diferente al de los antibióticos beta-lactámicos discutidos anteriormente. La cicloserina es un análogo de D-alanina y bloquea la incorporación de D-alanina en los puentes peptídicos en la pared celular bacteriana. Se deriva de un actinomiceto.
Aminociclitoles
Estos productos de otro actinomiceto logran su efecto al interferir con la subunidad 30S del ribosoma bacteriano. Espectinomicina (nombre comercial = Trobicin®) es un ejemplo. Es particularmente eficaz contra el gonococo, la bacteria que causa la gonorrea de la enfermedad de transmisión sexual (ETS).
Glucopéptidos
Los glicopéptidos también interfieren con la síntesis de la pared celular bacteriana pero por un mecanismo diferente al de las beta-lactamas.
La vancomicina es un glicopéptido ampliamente utilizado en Estados Unidos. Se une a las D-alaninas en los precursores de los puentes cruzados de peptidoglicano impidiendo su reticulación. Se ha convertido en el antibiótico de último recurso ya que la resistencia a los otros antibióticos se ha vuelto cada vez más común.
Oxazolidinonas
El primero de estos nuevos antibióticos, el linezolid (Zyvox®), fue aprobado por la Administración de Alimentos y Medicamentos de Estados Unidos el 19 de abril de 2000. Es eficaz contra muchas bacterias Gram-positivas que han desarrollado resistencia a los antibióticos más viejos.
Linezolid ataca una grieta previamente no explotada en la armadura de la bacteria: el ensamblaje adecuado de las dos subunidades ribosómicas (30S y 50S). No afecta a los ribosomas eucariotas, y por lo tanto la traducción de los ARNm en el citosol. Sin embargo, sí afecta a los ribosomas mitocondriales similares a bacterias y puede interferir con la síntesis de esas proteínas mitocondriales sintetizadas por ellos.
Lipopéptidos
Se trata de compuestos naturales derivados de una especie de Streptomyces. El que se encuentra en uso clínico es la daptomicina (Cubicin®). Es eficaz contra bacterias Gram-positivas. Ataca otra grieta previamente no explotada en la armadura bacteriana: la integridad de sus membranas celulares.
Hasta el momento no hay evidencia de bacterias que desarrollen resistencia contra ella.
Resistencia a Antibióticos
Ninguno de los antibióticos discutidos anteriormente es efectivo contra todos los patógenos bacterianos.
Resistencia intrínseca
Algunas bacterias son intrínsecamente resistentes a ciertos antibióticos. Ejemplo: Las bacterias Gram-positivas son mucho menos susceptibles a las polimixinas que las bacterias Gram-negativas. [Las designaciones “Gram” se refieren al comportamiento de las bacterias cuando se tiñen con la tinción de Gram; este comportamiento es un reflejo de la organización muy diferente de sus paredes celulares.]
Resistencia adquirida
Muchas bacterias adquieren resistencia a uno o más de los antibióticos a los que antes eran susceptibles.
Ejemplo: En Estados Unidos en la década de 1985 a 1995, la resistencia de Shigella (que causa enfermedad gastrointestinal) a la ampicilina creció de 32% a 67%. Y, si bien solo 7% de estos aislamientos eran resistentes a la combinación de sulfametoxazol y trimetoprima al inicio de la década, esa cifra había crecido a 35% al final de la década.
Las bacterias desarrollan resistencia al adquirir genes que codifican proteínas que las protegen de los efectos del antibiótico. En algunos casos los genes surgen por mutación; en otros, se adquieren de otras bacterias que ya son resistentes al antibiótico. Los genes se encuentran a menudo en plásmidos que se propagan fácilmente de una bacteria a otra, incluso de una especie de bacteria a otra.
Ejemplos:
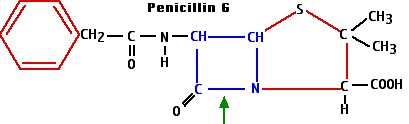
- La síntesis de la enzima penicilinasa - u otras beta-lactamasas - proporciona protección contra los antibióticos beta-lactámicos. Estas enzimas rompen el anillo beta-lactámico en la posición mostrada con la flecha verde en el diagrama de penicilina G.
- De igual manera la síntesis de cefalosporinasas derrota a las cefalosporinas.
- Derrotar a las quinolonas:
- Algunas bacterias hacen esto modificando su ADN girasa.
- Otros, por ejemplo, Mycobacterium tuberculosis, desarrollan resistencia a quinolonas sintetizando una proteína que se asemeja a una longitud corta de ADN. Esta proteína se une a la girasa por lo que no puede formar el complejo ADN/girasa que es el objetivo de la acción de la quinolona.
- Algunas bacterias sintetizan “bombas” en su membrana plasmática a través de las cuales eliminan antibióticos como las tetraciclinas del interior de la célula.
- Las bacterias pueden metilar sus ribosomas ocultando la diana de antibióticos (por ejemplo, eritromicina) que normalmente se unen e inactivan el ribosoma, o a la inversa
- pueden modificar enzimáticamente el antibiótico (por ejemplo, kanamicina) para que ya no pueda “ver” su diana ribosómica.
- Las bacterias pueden modificar la estructura de su pared de peptidoglicano y así evitar los efectos inhibitorios de antibióticos como la cicloserina.
Un número alarmante de patógenos humanos han adquirido genes para combatir todos los antibióticos utilizados actualmente, excepto la vancomicina y recientemente han aparecido bacterias resistentes a la vancomicina. Estas cepas multirresistentes son particularmente comunes en hospitales donde el uso de antibióticos es intenso, y los pacientes a menudo tienen sistemas inmunitarios debilitados.
Medición de la resistencia a antibióticos

La figura ilustra el método más simple de los varios disponibles para medir la resistencia a antibióticos.
- Una suspensión de las bacterias a ensayar (por ejemplo, cultivadas del paciente infectado) se extiende sobre la superficie de una placa de Petri que contiene un medio de cultivo sólido.
- Se presionan discos de varios antibióticos diferentes sobre la superficie del agar. La concentración de antibiótico en cada tipo de disco está estandarizada.
- Incubar durante la noche.
- La bacteria crecerá hasta convertirse en un “césped” excepto donde un antibiótico al que son sensibles se haya difundido fuera de su disco.
- Mida el diámetro de cualquier zona de inhibición que se forme.
¿Qué se puede hacer para retrasar la propagación de la resistencia a los antibióticos?
- No le pidas a tu médico un antibiótico para tratar una enfermedad viral (por ejemplo, un resfriado) para la cual los antibióticos son inútiles. (Sin embargo, tu médico puede recetarte un antibiótico si estás infectado por un virus de la influenza, no para combatir el virus sino para protegerte contra una infección bacteriana secundaria de tus pulmones dañados).
- Mantente el rumbo. Use todas las dosis recetadas aunque se sienta mejor. Esto minimizará la oportunidad de seleccionar por resistencia entre las bacterias que permanecen tarde en la infección.
- No guarde los antibióticos no utilizados para la automedicación posterior.
Los agricultores también pueden ayudar evitando el uso de antibióticos en su ganado que son similares a los que se usan en humanos. Los antibióticos son ampliamente utilizados en ganado sano para mejorar su tasa de crecimiento (por un mecanismo desconocido).
Un artículo publicado en la edición del 20 de mayo de 1999 de The New England Journal of Medicine documenta el reciente desarrollo de la resistencia a quinolonas en Campylobacter jejuni, la causa bacteriana más frecuente de gastroenteritis en humanos. El aumento coincide con la aprobación en 1995 del uso de quinolonas por los avicultores estadounidenses (los pollos también se infectan por C. jejuni). Se han reportado aumentos recientes similares en C. jejuni resistente a fluoroquinolonas en los Países Bajos y también en España (donde hasta el 50% de las infecciones humanas son ahora causadas por bacterias resistentes al antibiótico). En cada país, la aparición de cepas resistentes siguió a la introducción generalizada del tratamiento con quinolonas para animales.
Perspectivas de futuro
Las compañías farmacéuticas -después de muchos años de complacencia- están respondiendo ahora a la amenaza de las bacterias resistentes a los antibióticos. Se están desarrollando más de una docena de nuevos antibióticos y algunos ya han llegado a ensayos clínicos. Muchas de estas son modificaciones semisintéticas de antibióticos ya existentes, incluyendo nuevos
- beta-lactamas
- macrólidos
- glicopéptidos
- quinolonas
- modificaciones de vancomicina
Otros son completamente nuevos, atacando chinks previamente no explotados en la armadura bacteriana.
- Hidroxamatos de urea, que bloquean la enzima (péptido deformilasa) que elimina fMet de la proteína terminada para que pueda comenzar su trabajo. (Los eucariotas no comienzan la traducción con fMet.)
- Policíclos heteroaromáticos (HARP) que se unen a promotores bacterianos impidiendo la transcripción génica.


