2.2: Átomos, isótopos, iones y moléculas - número atómico y número másico
- Page ID
- 57687
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Determinar la relación entre el número másico de un átomo, su número atómico, su masa atómica y su número de partículas subatómicas
Número atómico
Los átomos neutros de un elemento contienen un número igual de protones y electrones. El número de protones determina el número atómico de un elemento (Z) y distingue un elemento de otro. Por ejemplo, el número atómico del carbono (Z) es 6 porque tiene 6 protones. El número de neutrones puede variar para producir isótopos, que son átomos del mismo elemento que tienen diferentes números de neutrones. El número de electrones también puede ser diferente en átomos del mismo elemento, produciendo así iones (átomos cargados). Por ejemplo, el hierro, el Fe, puede existir en su estado neutro, o en los estados iónicos +2 y +3.
Número Masivo
El número de masa de un elemento (A) es la suma del número de protones y el número de neutrones. La pequeña contribución de masa de los electrones no se tiene en cuenta en el cálculo del número de masa. Esta aproximación de masa se puede utilizar para calcular fácilmente cuántos neutrones tiene un elemento simplemente restando el número de protones del número de masa. Tanto los protones como los neutrones pesan alrededor de una unidad de masa atómica o amu. Los isótopos del mismo elemento tendrán el mismo número atómico pero diferentes números de masa.
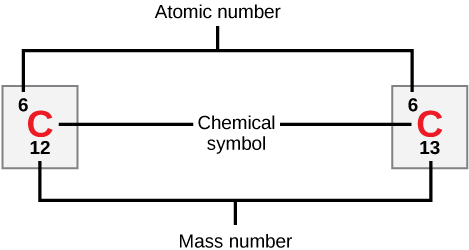
Los científicos determinan la masa atómica calculando la media de los números de masa para sus isótopos naturales. A menudo, el número resultante contiene un decimal. Por ejemplo, la masa atómica del cloro (Cl) es de 35.45 amu porque el cloro está compuesto por varios isótopos, algunos (la mayoría) con una masa atómica de 35 amu (17 protones y 18 neutrones) y algunos con una masa atómica de 37 amu (17 protones y 20 neutrones).
Dado un número atómico (Z) y un número másico (A), se puede encontrar el número de protones, neutrones y electrones en un átomo neutro. Por ejemplo, un átomo de litio (Z=3, A=7 amu) contiene tres protones (encontrados de Z), tres electrones (ya que el número de protones es igual al número de electrones en un átomo) y cuatro neutrones (7 — 3 = 4).
Puntos Clave
- Los átomos neutros de cada elemento contienen un número igual de protones y electrones.
- El número de protones determina el número atómico de un elemento y se utiliza para distinguir un elemento de otro.
- El número de neutrones es variable, dando como resultado isótopos, que son diferentes formas del mismo átomo que varían sólo en el número de neutrones que poseen.
- Juntos, el número de protones y el número de neutrones determinan el número de masa de un elemento.
- Dado que los isótopos de un elemento tienen números de masa ligeramente diferentes, la masa atómica se calcula obteniendo la media de los números de masa para sus isótopos.
Términos Clave
- número de masa: La suma del número de protones y el número de neutrones en un átomo.
- número atómico: El número de protones en un átomo.
- masa atómica: La masa promedio de un átomo, teniendo en cuenta todos sus isótopos naturales.


