2.9: Átomos, isótopos, iones y moléculas - enlaces covalentes y otros enlaces e interacciones
- Page ID
- 57678
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Comparar la fuerza relativa de diferentes tipos de interacciones de unión
La regla del octeto puede satisfacerse compartiendo electrones entre átomos para formar enlaces covalentes. Estos enlaces son más fuertes y mucho más comunes que los enlaces iónicos en las moléculas de los organismos vivos. Los enlaces covalentes se encuentran comúnmente en moléculas orgánicas basadas en carbono, como el ADN y las proteínas. Los enlaces covalentes también se encuentran en moléculas inorgánicas como H 2 O, CO 2 y O 2. Uno, dos o tres pares de electrones pueden ser compartidos entre dos átomos, haciendo enlaces simples, dobles y triples, respectivamente. Cuantos más enlaces covalentes entre dos átomos, más fuerte es su conexión. Así, los enlaces triples son los más fuertes.
La fuerza de los diferentes niveles de enlace covalente es una de las principales razones por las que los organismos vivos tienen dificultades para adquirir nitrógeno para su uso en la construcción de moléculas nitrogenadas, aunque el nitrógeno molecular, N 2, es el gas más abundante en la atmósfera. El nitrógeno molecular consiste en dos átomos de nitrógeno triples unidos entre sí. El triple enlace fuerte resultante dificulta que los sistemas vivos rompan este nitrógeno para usarlo como constituyentes de biomoléculas, como proteínas, ADN y ARN.
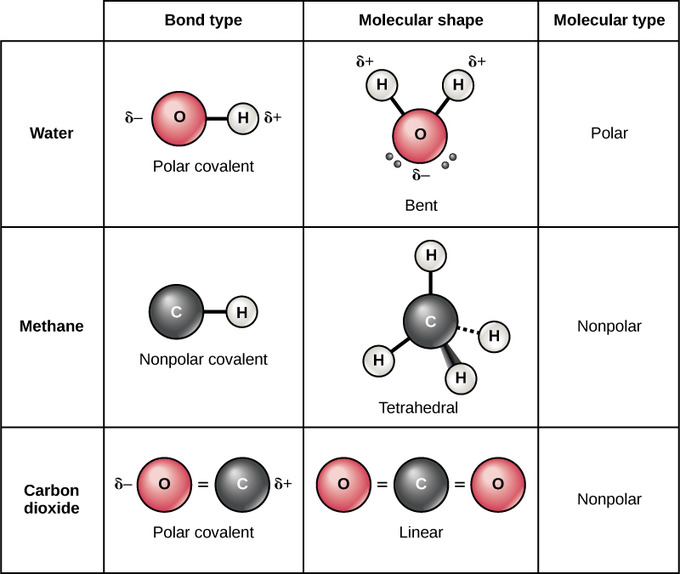
La formación de moléculas de agua es un ejemplo de unión covalente. Los átomos de hidrógeno y oxígeno que se combinan para formar moléculas de agua están unidos por enlaces covalentes. El electrón del hidrógeno divide su tiempo entre la capa externa incompleta del átomo de hidrógeno y la capa externa incompleta del átomo de oxígeno. A cambio, el átomo de oxígeno comparte uno de sus electrones con el átomo de hidrógeno, creando un enlace covalente sencillo de dos electrones. Para llenar completamente la capa externa de oxígeno, que tiene seis electrones en su capa externa, se necesitan dos electrones (uno de cada átomo de hidrógeno). Cada átomo de hidrógeno solo necesita un solo electrón para llenar su capa exterior, de ahí la conocida fórmula H 2 O. Los electrones que se comparten entre los dos elementos llenan la capa exterior de cada uno, haciendo que ambos elementos sean más estables.
Enlaces covalentes polares
Existen dos tipos de enlaces covalentes: polares y no polares. En un enlace covalente polar, los electrones son desigualmente compartidos por los átomos porque son más atraídos por un núcleo que por el otro. La atracción relativa de un átomo hacia un electrón se conoce como su electronegatividad: los átomos que son más atraídos por un electrón se consideran más electronegativos. Debido a la distribución desigual de electrones entre los átomos de diferentes elementos, se desarrolla una carga ligeramente positiva (δ+) o ligeramente negativa (δ-). Esta carga parcial se conoce como dipolo; esta es una propiedad importante del agua y da cuenta de muchas de sus características. El dipolo en el agua ocurre porque el oxígeno tiene una electronegatividad mayor que el hidrógeno, lo que significa que los electrones compartidos pasan más tiempo en las proximidades del núcleo de oxígeno que cerca del núcleo de los átomos de hidrógeno.
Enlaces covalentes no polares
Se forman enlaces covalentes no polares entre dos átomos del mismo elemento o entre diferentes elementos que comparten electrones por igual. Por ejemplo, el oxígeno molecular (O 2) es no polar porque los electrones estarán igualmente distribuidos entre los dos átomos de oxígeno. Los cuatro enlaces del metano también se consideran no polares porque las electronegativias de carbono e hidrógeno son casi idénticas.
Enlaces de hidrógeno e interacciones de Van Der Waals
No todos los enlaces son iónicos o covalentes; también se pueden formar enlaces más débiles entre las moléculas. Dos tipos de enlaces débiles que ocurren frecuentemente son los enlaces de hidrógeno y las interacciones de van der Waals. Sin estos dos tipos de vínculos, la vida como la conocemos no existiría.
Los enlaces de hidrógeno proporcionan muchas de las propiedades críticas de mantenimiento de la vida del agua y también estabilizan las estructuras de las proteínas y el ADN, el bloque de construcción de las células. Cuando se forman enlaces covalentes polares que contienen hidrógeno, el átomo de hidrógeno en ese enlace tiene una carga ligeramente positiva (δ+) porque los electrones compartidos son arrastrados más fuertemente hacia el otro elemento y lejos del átomo de hidrógeno. Debido a que el hidrógeno tiene una carga ligeramente positiva, se siente atraído por las cargas negativas vecinas. La débil interacción entre la carga δ+ de un átomo de hidrógeno de una molécula y la carga δ- de un átomo más electronegativo se denomina enlace de hidrógeno. Los enlaces individuales de hidrógeno son débiles y se rompen fácilmente; sin embargo, ocurren en cantidades muy grandes en agua y en polímeros orgánicos, y la fuerza aditiva puede ser muy fuerte. Por ejemplo, los enlaces de hidrógeno son los responsables de comprimir la doble hélice del ADN.

Al igual que los enlaces de hidrógeno, las interacciones de van der Waals son interacciones débiles entre moléculas. Las atracciones de Van der Waals pueden ocurrir entre dos o más moléculas cualesquiera y dependen de ligeras fluctuaciones de las densidades de electrones, lo que puede conducir a ligeros dipolos temporales alrededor de una molécula. Para que estas atracciones sucedan, las moléculas necesitan estar muy cerca unas de otras. Estos enlaces, junto con los enlaces de hidrógeno, ayudan a formar las estructuras tridimensionales de las proteínas en nuestras células que se requieren para su correcto funcionamiento.
Interacciones entre diferentes tipos de moléculas: En este interactivo, puedes explorar cómo diferentes tipos de moléculas interactúan entre sí en función de sus enlaces.
Puntos Clave
- Un enlace covalente polar surge cuando dos átomos de diferente electronegatividad comparten dos electrones de manera desigual.
- Un enlace covalente no polar es aquel en el que los electrones se comparten por igual entre dos átomos.
- Los enlaces de hidrógeno y Van Der Waals son responsables del plegamiento de proteínas, la unión de ligandos a proteínas y muchos otros procesos entre moléculas.
Términos Clave
- enlace de hidrógeno: Un enlace débil en el que un átomo de hidrógeno en una molécula es atraído por un átomo electronegativo (generalmente nitrógeno u oxígeno) en la misma o diferente molécula.
- enlace covalente: Un tipo de enlace químico donde dos átomos están conectados entre sí por la compartición de dos o más electrones.
- dipolo: Cualquier objeto (como un imán, molécula polar o antena), que esté cargado de manera opuesta en dos puntos (o polos).


