6.5: Energía Potencial, Cinética, Libre y de Activación - Energía Libre
- Page ID
- 57893
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Discutir el concepto de energía libre.
Energía Libre
Dado que las reacciones químicas liberan energía cuando se rompen los enlaces de almacenamiento de energía, ¿cómo se cuantifica y expresa la energía asociada a las reacciones químicas? ¿Cómo se puede comparar la energía liberada de una reacción con la de otra reacción?
Se utiliza una medición de la energía libre para cuantificar estas transferencias de energía. La energía libre se llama energía libre de Gibbs (G) después de Josiah Willard Gibbs, el científico que desarrolló la medición. Recordemos que según la segunda ley de la termodinámica, todas las transferencias de energía implican la pérdida de alguna cantidad de energía en una forma inutilizable como el calor, resultando en entropía. La energía libre de Gibbs se refiere específicamente a la energía asociada con una reacción química que está disponible después de contabilizar la entropía. En otras palabras, la energía libre de Gibbs es energía utilizable o energía que está disponible para hacer el trabajo.
Cálculo ∆G
Cada reacción química implica un cambio en la energía libre, llamada delta G (∆G). El cambio en la energía libre se puede calcular para cualquier sistema que sufra un cambio, como una reacción química. Para calcular ∆G, restar la cantidad de energía perdida a la entropía (denotada como ∆S) del cambio de energía total del sistema. Este cambio de energía total en el sistema se llama entalpía y se denota como ∆H La fórmula para calcular ∆G es la siguiente, donde el símbolo T se refiere a la temperatura absoluta en Kelvin (grados Celsius + 273): G=ΔH−TΔS.
El cambio estándar de energía libre de una reacción química se expresa como una cantidad de energía por mol del producto de reacción (ya sea en kilojulios o kilocalorías, kJ/mol o kcal/mol; 1 kJ = 0.239 kcal) bajo condiciones estándar de pH, temperatura y presión. Las condiciones estándar de pH, temperatura y presión generalmente se calculan a pH 7.0 en sistemas biológicos, 25 grados Celsius y 100 kilopascales (1 atm de presión), respectivamente. Es importante señalar que las condiciones celulares varían considerablemente de estas condiciones estándar; por lo tanto, los valores estándar calculados ∆G para las reacciones biológicas serán diferentes dentro de la célula.
Reacciones endergónicas y exergónicas
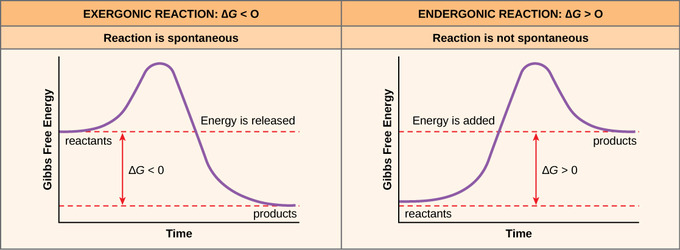
Si se libera energía durante una reacción química, entonces el valor resultante de la ecuación anterior será un número negativo. Es decir, las reacciones que liberan energía tienen un ∆G < 0. Un ∆G negativo también significa que los productos de la reacción tienen menos energía libre que los reactivos porque emitieron algo de energía libre durante la reacción. Las reacciones que tienen un ∆G negativo y, en consecuencia, liberan energía libre, se denominan reacciones exergónicas. Exergónico significa que la energía está saliendo del sistema. Estas reacciones también se denominan reacciones espontáneas porque pueden ocurrir sin la adición de energía al sistema. Comprender qué reacciones químicas son espontáneas y liberan energía libre es extremadamente útil para los biólogos porque estas reacciones pueden aprovecharse para realizar trabajos dentro de la célula. Se debe hacer una distinción importante entre el término espontáneo y la idea de una reacción química que se produce de inmediato. Contrario al uso cotidiano del término, una reacción espontánea no es aquella que ocurre súbita o rápidamente. La oxidación del hierro es un ejemplo de una reacción espontánea que se produce lentamente, poco a poco, a lo largo del tiempo.
Si una reacción química requiere un aporte de energía en lugar de liberar energía, entonces el ∆G para esa reacción será un valor positivo. En este caso, los productos tienen más energía libre que los reactivos. Por lo tanto, los productos de estas reacciones pueden considerarse como moléculas almacenadoras de energía. Estas reacciones químicas se denominan reacciones endergónicas; son no espontáneas. Una reacción endergónica no tendrá lugar por sí sola sin la adición de energía libre.
Energía Libre y Procesos Biológicos
En una célula viva, las reacciones químicas se mueven constantemente hacia el equilibrio, pero nunca lo alcanzan. Una célula viva es un sistema abierto: los materiales entran y salen, la célula recicla los productos de ciertas reacciones químicas en otras reacciones y nunca se alcanza el equilibrio químico. De esta manera, los organismos vivos se encuentran en una constante batalla cuesta arriba que requiere energía contra el equilibrio y la entropía.
Cuando las moléculas complejas, como los almidones, se construyen a partir de moléculas más simples, como los azúcares, el proceso anabólico requiere energía. Por lo tanto, las reacciones químicas involucradas en los procesos anabólicos son reacciones endergónicas. Por otro lado, el proceso catabólico de descomponer el azúcar en moléculas más simples libera energía en una serie de reacciones exergónicas. Al igual que en el ejemplo de la roya anterior, la descomposición del azúcar implica reacciones espontáneas, pero estas reacciones no ocurren instantáneamente. Un concepto importante en el estudio del metabolismo y la energía es el del equilibrio químico. La mayoría de las reacciones químicas son reversibles. Pueden proceder en ambas direcciones, liberando energía a su entorno en una dirección, y absorbiéndola del ambiente en la otra dirección.

Puntos Clave
- Cada reacción química implica un cambio en la energía libre, llamada delta G (∆G).
- Para calcular ∆G, restar la cantidad de energía perdida a la entropía (∆S) del cambio de energía total del sistema; este cambio de energía total en el sistema se llama entalpía (∆H): ΔG=ΔH−TΔS.
- Las reacciones endergónicas requieren un aporte de energía; el ∆G para esa reacción será un valor positivo.
- Las reacciones exergónicas liberan energía libre; el ∆G para esa reacción será un valor negativo.
Términos Clave
- reacción exergónica: Una reacción química donde el cambio en la energía libre de Gibbs es negativo, lo que indica una reacción espontánea
- Reacción endergónica: Una reacción química en la que el cambio estándar en la energía libre es positivo, y la energía es absorbida
- Energía libre de Gibbs: La diferencia entre la entalpía de un sistema y el producto de su entropía y temperatura absoluta


