3.8: Proteínas - Aminoácidos
- Page ID
- 57147
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir la estructura de un aminoácido y las características que confieren sus propiedades específicas
Estructura de un aminoácido
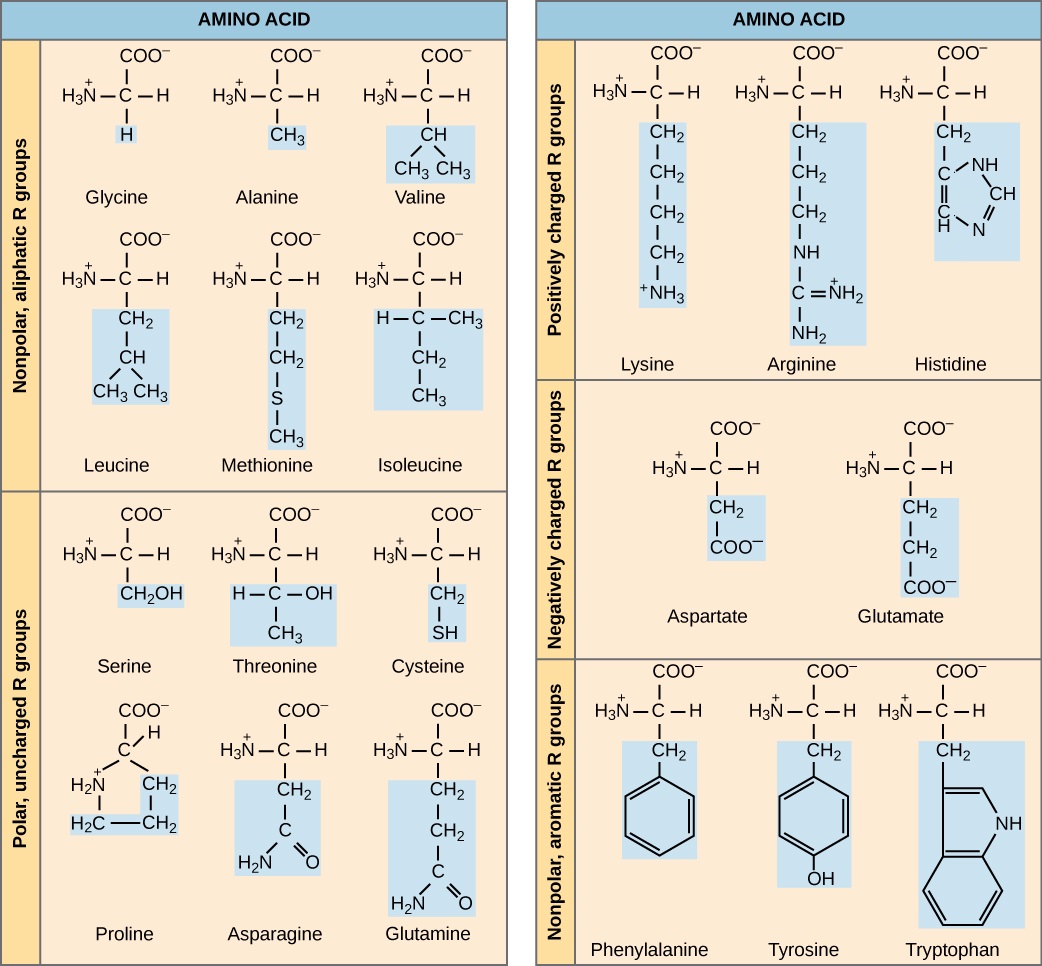
Los aminoácidos son los monómeros que componen las proteínas. Cada aminoácido tiene la misma estructura fundamental, la cual consiste en un átomo de carbono central, también conocido como el carbono alfa (α), unido a un grupo amino (NH 2), un grupo carboxilo (COOH) y a un átomo de hidrógeno. En el ambiente acuoso de la célula, tanto el grupo amino como el grupo carboxilo se ionizan bajo condiciones fisiológicas, y así lo tienen las estructuras -NH 3 + y -COO —, respectivamente. Cada aminoácido también tiene otro átomo o grupo de átomos unidos al átomo central conocido como el grupo R. Este grupo R, o cadena lateral, da a cada proteína de aminoácido características específicas, incluyendo tamaño, polaridad y pH.

Tipos de Aminoácidos
El nombre “aminoácido” se deriva del grupo amino y del grupo carboxilo-ácido en su estructura básica. Hay 21 aminoácidos presentes en las proteínas, cada una con un grupo R específico o cadena lateral. Diez de estos son considerados aminoácidos esenciales en humanos porque el cuerpo humano no puede producirlos y deben obtenerse de la dieta. Todos los organismos tienen diferentes aminoácidos esenciales en función de su fisiología.
Características de los Aminoácidos
¿Qué categorías de aminoácidos esperarías encontrar en la superficie de una proteína soluble y cuáles esperarías encontrar en el interior? ¿Qué distribución de aminoácidos esperarías encontrar en una proteína incrustada en una bicapa lipídica?
La composición química de la cadena lateral determina las características del aminoácido. Los aminoácidos como la valina, la metionina y la alanina son no polares (hidrófobos), mientras que los aminoácidos como la serina, la treonina y la cisteína son polares (hidrófilos). Las cadenas laterales de lisina y arginina están cargadas positivamente por lo que estos aminoácidos también se conocen como aminoácidos básicos (pH alto). La prolina es una excepción a la estructura estándar de un aminoácido porque su grupo R está unido al grupo amino, formando una estructura similar a un anillo.
Los aminoácidos están representados por una sola letra mayúscula o una abreviatura de tres letras. Por ejemplo, la valina se conoce por la letra V o el símbolo de tres letras val.
Enlaces peptídicos
La secuencia y el número de aminoácidos determinan finalmente la forma, el tamaño y la función de la proteína. Cada aminoácido está unido a otro aminoácido por un enlace covalente, conocido como enlace peptídico. Cuando dos aminoácidos están unidos covalentemente por un enlace peptídico, el grupo carboxilo de un aminoácido y el grupo amino del aminoácido entrante se combinan y liberan una molécula de agua. Cualquier reacción que combine dos monómeros en una reacción que genere H 2 O como uno de los productos se conoce como reacción de deshidratación, por lo que la formación de enlaces peptídicos es un ejemplo de una reacción de deshidratación.

Cadenas Polipeptídicas
La cadena resultante de aminoácidos se llama cadena polipeptídica. Cada polipéptido tiene un grupo amino libre en un extremo. Este extremo se llama el N terminal, o el amino terminal, y el otro extremo tiene un grupo carboxilo libre, también conocido como el C o carboxilo terminal. Al leer o informar la secuencia de aminoácidos de una proteína o polipéptido, la convención es usar la dirección N-a-C. Es decir, se supone que el primer aminoácido de la secuencia es uno en el extremo N y se supone que el último aminoácido es el que está en el extremo C.
Aunque los términos polipéptido y proteína a veces se usan indistintamente, un polipéptido es técnicamente cualquier polímero de aminoácidos, mientras que el término proteína se usa para un polipéptido o polipéptidos que se han plegado correctamente, combinado con cualquier componente adicional necesario para un correcto funcionamiento, y ahora es funcional.
Puntos Clave
- Cada aminoácido contiene un átomo de C central, un grupo amino (NH2), un grupo carboxilo (COOH) y un grupo R específico.
- El grupo R determina las características (tamaño, polaridad y pH) para cada tipo de aminoácido.
- Se forman enlaces peptídicos entre el grupo carboxilo de un aminoácido y el grupo amino de otro a través de la síntesis por deshidratación.
- Una cadena de aminoácidos es un polipéptido.
Términos Clave
- aminoácido: Cualquiera de los 20 α-aminoácidos naturales (que tienen los grupos amino y ácido carboxílico en el mismo átomo de carbono), y una variedad de cadenas laterales, que se combinan, a través de enlaces peptídicos, para formar proteínas.
- Grupo R: El grupo R es una cadena lateral específica para cada aminoácido que confiere propiedades químicas particulares a ese aminoácido.
- polipéptido: Cualquier polímero de aminoácidos (iguales o diferentes) unidos a través de enlaces peptídicos.


