1.2: Estilos de Vida y Química Básica
- Page ID
- 55453
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La vida obtiene energía de diferentes maneras: (1) de la luz solar (fototrofia); (2) de reacciones químicas con materia inorgánica (litotrofia); (3) de romper moléculas orgánicas en moléculas inorgánicas, típicamente dióxido de carbono y agua (organotrofia). Para hacer su cuerpo, los seres vivos obtienen bloques de construcción ya sea por (a) a partir de la asimilación del dióxido de carbono (autotrofia), o de otros seres vivos (heterotrofia).
Estas formas se combinan en seis estilos de vida. Por ejemplo, las plantas\(_1\) son por definición fotoautótrofos. La mayoría de las plantas también\(_2\) son fotoautótrofos, pero hay excepciones: parásitos completos (ver arriba). Las plantas carnívoras (como el sundew, Drosera o el Papamoscas Venus, Dionaea) son todas fotoautótrofas. Ellos “comen” animales para obtener nitrógeno y fósforo, por lo que los cadáveres no sirven como alimento sino como fertilizante. Tenga en cuenta que las plantas también son organoheterótrofos como los animales porque además de la fotosíntesis, todas las células vegetales pueden respirar.
Para entender la vida de las plantas se necesita un conocimiento básico de la química. Esto incluye el conocimiento de átomos (y sus componentes como protones, neutrones y electrones), peso atómico, isótopos, elementos, la tabla periódica, enlaces químicos (iónicos, covalentes e hidrógeno), valencia, moléculas y peso molecular. Por ejemplo, es fundamental saber que los protones tienen una carga de\(+1\), los neutrones no tienen carga, y los electrones tienen una carga de\(-1\). El peso atómico es igual al peso de protones y neutrones. Los isótopos tienen el mismo número de protones pero diferente número de neutrones; algunos isótopos son inestables (radiactivos).
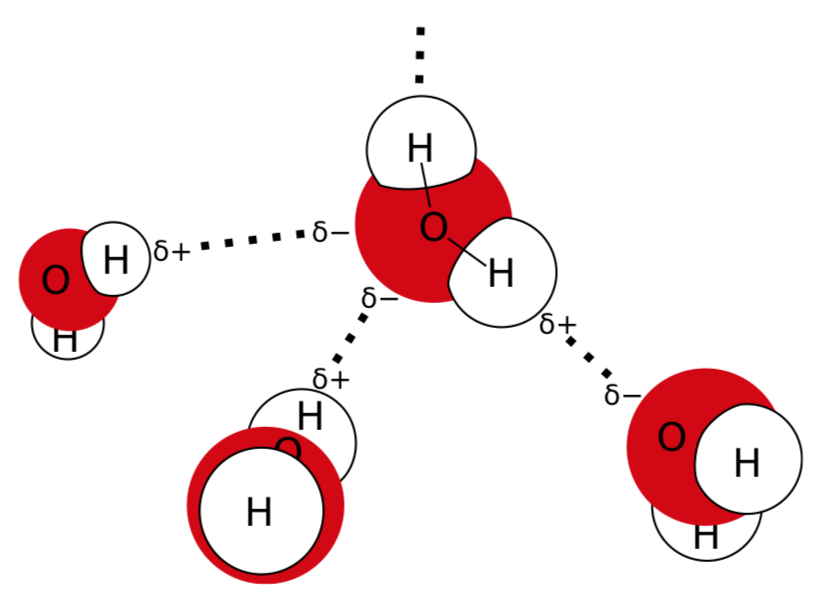
Una de las moléculas más destacadas es el agua. Teóricamente, el agua debería hervir a una temperatura mucho más baja, pero hierve a 100\(^\circ\) C solo por los enlaces de hidrógeno que sellan las moléculas de agua. Estos enlaces surgen porque una molécula de agua es polar: los hidrógenos están ligeramente cargados positivamente y el oxígeno está ligeramente cargado negativamente (Figura\(\PageIndex{1}\)).
Otro concepto importante relacionado con el agua es la acidez. Si en una solución de agua, la molécula saca protón (H\(^+\)), es un ácido. Un ejemplo de esto sería el ácido clorhídrico (HCl) que se disocia en H\(^+\) y Cl\(^-\). Si la molécula saca OH\(^-\) (ion hidróxido), esta es una base.
Un ejemplo de esto sería el hidróxido de sodio (NaOH) que se disocia en Na\(^+\) e ion hidróxido.
Para planificar adecuadamente las reacciones químicas, necesitamos conocer la masa molar y la concentración molar. La masa molar es un gramo equivalente de peso molecular. Esto significa que (por ejemplo) el peso molecular de la sal (NaCl) podría estimarse como\(23 + 35\), lo que equivale a 58 unidades. En consecuencia, un mol de sal es aproximadamente 58 gramos. Un mol de cualquier materia (de estructura molecular) siempre contiene\(6.02214078 \times 10^{23}\) moléculas (número de Avogadro).
La densidad de una sustancia disuelta es la concentración. Si en 1 litro de agua destilada se diluyen 58 gramos de sal, tenemos 1M (un molar) de concentración de sal. La concentración no cambiará si tomamos alguna cantidad de este líquido (cuchara, gota, o medio litro).
Dependiendo de la concentración de protones en una sustancia, una solución puede ser muy ácida. La acidez de una solución se puede determinar a través del pH. Por ejemplo, si la concentración de protones es 0.1 M (\(1 \times 10^{-1}\), que 0.1 gramos de protones en 1 litro de agua), esta es una solución extremadamente ácida. El pH de la misma es solo 1 (el logaritmo negativo, o grado negativo de diez de concentración de protones). Otro ejemplo es el agua destilada. La concentración de protones allí es igual a\(1 \times 10^{-7}\) M, y por lo tanto el pH del agua destilada es de 7. El agua destilada es mucho menos ácida porque las moléculas de agua se disocian raramente.
Cuando dos o más átomos de carbono están conectados, forman un esqueleto de carbono. Todas las moléculas orgánicas están hechas de algún esqueleto orgánico. Aparte de C, los elementos que participan en moléculas orgánicas (elementos biogénicos) son H, O, N, P y S. Estos seis elementos forman cuatro tipos de biomoléculas: (1) lípidos, moléculas orgánicas hidrófobas que no se disuelven fácilmente en agua; (2) carbohidratos o azúcares, como la glucosa (las pasas contienen mucha glucosa) y fructosa (miel); por definición, los carbohidratos tienen múltiples grupos\(-\) OH, también hay carbohidratos poliméricos (polisacáridos) como celulosa y almidón; (3) aminoácidos (componentes de proteínas) que siempre contienen N, C, O y H; y (4) nucleótidos combinados del ciclo del carbono con nitrógeno ( ej., heterocíclo), azúcar y ácido fosfórico; los nucleótidos poliméricos son ácidos nucleicos como el ADN y el ARN.


