16.6: Superantígenos
- Page ID
- 55396
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Definir superantígeno.
- Describa brevemente el mecanismo por el cual los superantígenos causan daño al cuerpo.
- Nombrar 2 superantígenos y dar un ejemplo de una bacteria que produce cada uno.
Como se aprendió anteriormente bajo Patogenicidad Bacteriana, los superantígenos son toxinas tipo I que pueden desencadenar una respuesta inmune dañina. Las exotoxinas son toxinas, a menudo proteínas en la naturaleza, secretadas por una bacteria viva pero también liberadas tras la lisis bacteriana. Además, algunas bacterias utilizan un sistema de secreción tipo 3 o un sistema de secreción tipo 4 para inyectar toxinas directamente en las células humanas. Hay tres tipos principales de exotoxinas:
- Superantígenos (toxinas Tipo I),
- Exotoxinas que dañan las membranas de las células huésped (toxinas Tipo II)
- Toxinas A-B y otras toxinas que interfieren con la función de la célula hospedadora (toxinas tipo III).
Analizaremos los superantígenos y su papel en la hipersensibilidad.
Objetivos de aprendizaje
- Definir superantígeno.
- Describa brevemente el mecanismo por el cual los superantígenos causan daño al cuerpo.
- Nombrar 2 superantígenos y dar un ejemplo de una bacteria que produce cada uno.
Bacteria Destacada
- Lea la descripción de Streptococcus pyogenes y haga coincidir la bacteria con la descripción del organismo y la infección que causa.
Los superantígenos son toxinas bacterianas inusuales que interactúan con un número extremadamente grande de linfocitos T4. Se unen a la superficie de la célula diana pero no ingresan a la célula.

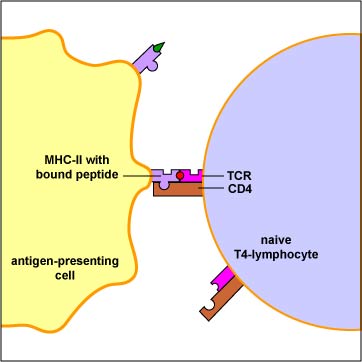
Los antígenos convencionales son engullidos por células presentadoras de antígeno (APC), degradados en epítopos, se unen al surco peptídico de las moléculas de MHC-II, y se ponen en la superficie de la APC (Figura\(\PageIndex{1}\)). Aquí son reconocidos por linfocitos T4 específicos que tienen un TCR con una forma correspondiente (Figura\(\PageIndex{2}\)).
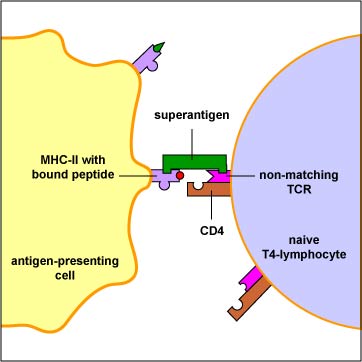
Los superantígenos, sin embargo, se unen directamente al exterior de las moléculas de MHC-II y activan un gran número de linfocitos T4 (Figura\(\PageIndex{3}\)). Esta activación de un gran número de linfocitos T4 da como resultado la secreción de cantidades excesivas de una citocina llamada interleucina-2 (IL-2) así como la activación de linfocitos T autorreactivos. La respuesta normal a un antígeno convencional da como resultado la activación de tal vez 1 de cada 10,000 linfocitos T; los superantígenos pueden activar hasta 1 de cada 5 linfocitos T.
La producción de niveles altos de IL-2 puede resultar en la circulación de IL-2 en la sangre, lo que lleva a síntomas como fiebre, náuseas, vómitos, diarrea y malestar general. Sin embargo, el exceso de estimulación de la secreción de IL-2 también puede conducir a la producción de citocinas inflamatorias como el factor de necrosis tumoral alfa (TNF-alfa), interleucina-1 (IL-1), quimiocinas inflamatorias como IL-8 y factor activador de plaquetas (PAF), y puede conducir al mismo daño endotelial, respiratorio agudo síndrome de distrés, coagulación intravascular diseminada, shock y falla del sistema de múltiples órganos vistos anteriormente con LPS y otros factores de la pared celular bacteriana. La activación de linfocitos T autorreactivos también puede conducir a un ataque autoinmune.
Los siguientes son ejemplos de superantígenos.
- Síndrome de choque tóxico toxina-1 (TSST-1), producido por algunas cepas de Staphylococcus aureus. Esta exotoxina provoca el síndrome de choque tóxico (SST). La producción excesiva de citocinas conduce a fiebre, sarpullido y shock.
- Exotoxina pirogénica estreptocócica (Spe), producida por cepas invasivas raras y cepas de escarlatina de Streptococcus pyogenes (los estreptococos beta del grupo A). Los piogenes producen una serie de SPEs citotóxicas, pirogénicas, potencian los efectos letales de las endotoxinas y contribuyen al daño inflamatorio inducido por citocinas. Las SPEs son responsables de causar el síndrome de choque tóxico estreptocócico (STSS), por lo que la producción excesiva de citocinas conduce a fiebre, sarpullido y desencadenar la cascada de choque. Las SPEs también parecen ser responsables de inducir fascitis necrotizante, una enfermedad que puede destruir la piel, la grasa y el tejido que cubre el músculo (la fascia). La SPE B también es un precursor de una cisteína proteasa que puede destruir el tejido muscular.
Lee la descripción de Streptococcus pyogenes, y poder hacer coincidir la bacteria con su descripción en un examen.
- Enterotoxinas estafilocócicas (SE), producidas por muchas cepas de Staphylococcus aureus. Estas exotoxinas causan intoxicación alimentaria estafilocócica. La producción excesiva de IL-2 produce fiebre, náuseas, vómitos y diarrea. El vómito también puede deberse a que estas toxinas estimulan el nervio vago en el revestimiento estomacal que controla el vómito.
- Enterotoxina ETEC, producida por E. coli enterotoxogénica (ETEC), una de las causas más comunes de diarrea del viajero.
Ejercicio: Preguntas de Pensar-Par-Compartir
¿Cuál es el mecanismo por el cual los superantígenos conducen finalmente al SIRS?
Resumen
- Los antígenos convencionales solo son reconocidos por células T4 específicas que tienen un TCR con una forma correspondiente.
- Los superantígenos son toxinas bacterianas inusuales que interactúan con un número extremadamente grande de linfocitos T4.
- La activación de un gran número de linfocitos T4 da como resultado la secreción de cantidades excesivas de una citocina llamada interleucina-2 (IL-2).
- El exceso de estimulación de la secreción de IL-2 también puede conducir a la producción de inflamación y puede conducir al mismo daño endotelial, síndrome de dificultad respiratoria aguda, coagulación intravascular diseminada, shock y falla del sistema de múltiples órganos visto con inflamación inducida por PAM.
- Ejemplos de superantígenos incluyen el síndrome de choque tóxico toxina-1 (TSST-1), exotoxinas pirogénicas estreptocócicas (SPE), enterotoxinas estafilocócicas (SE) y enterotoxina enterotoxogénica de E. coli (ETEC).
Preguntas
Estudie el material en esta sección y luego escriba las respuestas a estas preguntas. No se limite a hacer clic en las respuestas y escríbelas. Esto no pondrá a prueba tu comprensión de este tutorial.
- Definir superantígeno (ans).
- Describa brevemente el mecanismo por el cual los superantígenos causan daño al cuerpo. (ans)
- Nombrar 2 superantígenos y dar un ejemplo de una bacteria que produce cada uno.
- (ans)
- (ans)
- Opción múltiple (ans)


