6.2: El Ciclo de Vida Viral
- Page ID
- 54446
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Describir los ciclos de vida lítico y lisogénico
- Describir el proceso de replicación de virus animales
- Describir características únicas de retrovirus y virus latentes
- Discutir los virus humanos y sus interacciones virus-célula hospedadora
- Explicar el proceso de transducción
- Describir el proceso de replicación de virus vegetales
Todos los virus dependen de las células para la reproducción y los procesos metabólicos. Por sí mismos, los virus no codifican todas las enzimas necesarias para la replicación viral. Pero dentro de una célula hospedadora, un virus puede apoderarse de la maquinaria celular para producir más partículas virales. Los bacteriófagos se replican sólo en el citoplasma, ya que las células procariotas no tienen núcleo ni orgánulos. En las células eucariotas, la mayoría de los virus de ADN pueden replicarse dentro del núcleo, con una excepción observada en los virus de ADN grandes, como los poxvirus, que pueden replicarse en el citoplasma. Los virus de ARN que infectan células animales a menudo se replican en el citoplasma.
El ciclo de vida de los virus con hospedadores procariotas
El ciclo de vida de los bacteriófagos ha sido un buen modelo para entender cómo los virus afectan a las células que infectan, ya que se han observado procesos similares para los virus eucariotas, los cuales pueden provocar la muerte inmediata de la célula o establecer una infección latente o crónica. Los fagos virulentos típicamente conducen a la muerte de la célula a través de la lisis celular. Los fagos templados, por otro lado, pueden formar parte de un cromosoma huésped y se replican con el genoma celular hasta el momento en que son inducidos a producir virus recién ensamblados, o virus de la progenie.
El ciclo lítico
Durante el ciclo lítico del fago virulento, el bacteriófago toma el control de la célula, reproduce nuevos fagos y destruye la célula. El fago T-even es un buen ejemplo de una clase bien caracterizada de fagos virulentos. Hay cinco etapas en el ciclo lítico del bacteriófago (ver Figura\(\PageIndex{1}\)). La unión es la primera etapa en el proceso de infección en la que el fago interactúa con receptores específicos de superficie bacteriana (por ejemplo, lipopolisacáridos y proteína OmpC en las superficies del huésped). La mayoría de los fagos tienen un rango de hospedadores estrecho y pueden infectar una especie de bacteria o una cepa dentro de una especie. Este reconocimiento único puede explotarse para el tratamiento dirigido de la infección bacteriana mediante terapia con fagos o para la tipificación de fagos para identificar subespecies o cepas bacterianas únicas. La segunda etapa de la infección es la entrada o penetración. Esto ocurre a través de la contracción de la vaina de la cola, que actúa como una aguja hipodérmica para inyectar el genoma viral a través de la pared celular y la membrana. La cabeza del fago y los componentes restantes permanecen fuera de la bacteria.
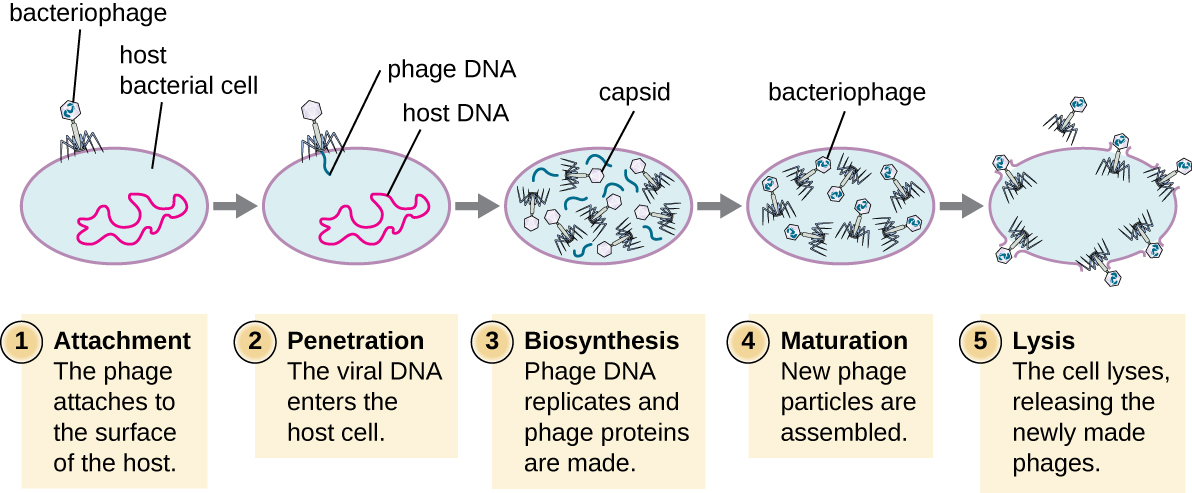
La tercera etapa de la infección es la biosíntesis de nuevos componentes virales. Después de ingresar a la célula hospedadora, el virus sintetiza endonucleasas codificadas por virus para degradar el cromosoma bacteriano. Luego secuestra la célula hospedadora para replicar, transcribir y traducir los componentes virales necesarios (capsómeros, vaina, placas base, fibras de cola y enzimas virales) para el ensamblaje de nuevos virus. Los genes de la polimerasa generalmente se expresan temprano en el ciclo, mientras que las proteínas de la cápside y la cola se expresan posteriormente. Durante la fase de maduración, se crean nuevos viriones. Para liberar fagos libres, la pared celular bacteriana es alterada por proteínas fágicas como holina o lisozima. La etapa final es la liberación. Los virus maduros salen de la célula hospedadora en un proceso llamado lisis y los virus de la progenie se liberan al ambiente para infectar nuevas células.
El ciclo lisogénico
En un ciclo lisogénico, el genoma del fago también ingresa a la célula a través de la unión y penetración. Un excelente ejemplo de un fago con este tipo de ciclo de vida es el fago lambda. Durante el ciclo lisogénico, en lugar de matar al huésped, el genoma del fago se integra en el cromosoma bacteriano y se convierte en parte del huésped. El genoma integrado del fago se llama profago. Un huésped bacteriano con un profago se llama lisógeno. El proceso en el que una bacteria es infectada por un fago templado se llama lisogenia. Es típico de los fagos templados estar latentes o inactivos dentro de la célula. A medida que la bacteria replica su cromosoma, también replica el ADN del fago y lo transmite a nuevas células hijas durante la reproducción. La presencia del fago puede alterar el fenotipo de la bacteria, ya que puede traer genes adicionales (por ejemplo, genes de toxina que pueden aumentar la virulencia bacteriana). Este cambio en el fenotipo del huésped se denomina conversión lisogénica o conversión de fagos. Algunas bacterias, como Vibrio cholerae y Clostridium botulinum, son menos virulentas en ausencia del profago. Los fagos que infectan estas bacterias portan los genes de la toxina en su genoma y potencian la virulencia del huésped cuando se expresan los genes de la toxina. En el caso de V. cholera, la toxina codificada por fagos puede causar diarrea severa; en C. botulinum, la toxina puede causar parálisis. Durante la lisogenia, el profago persistirá en el cromosoma huésped hasta la inducción, lo que resulta en la escisión del genoma viral del cromosoma huésped. Después de que se haya producido la inducción, el fago templado puede proceder a través de un ciclo lítico y luego someterse a lisogenia en una célula recién infectada (ver Figura\(\PageIndex{2}\)).
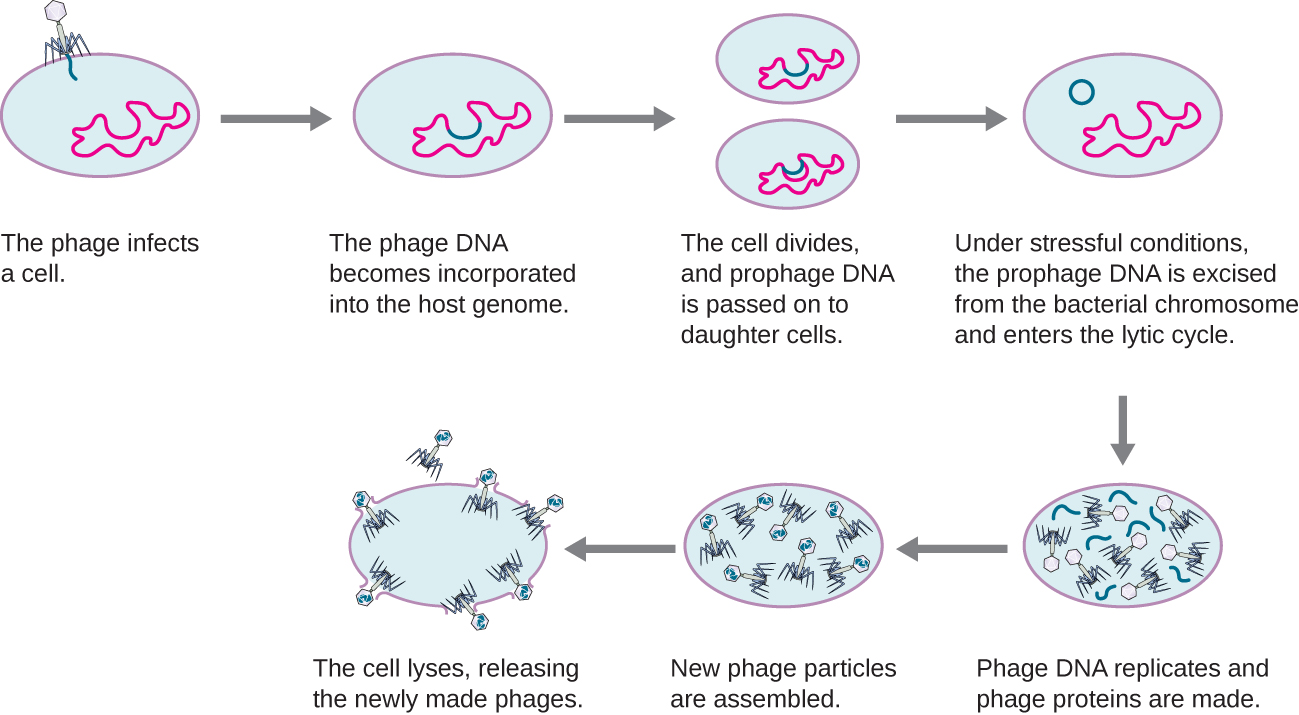
Este video ilustra las etapas del ciclo de vida lisogénico de un bacteriófago y la transición a una fase lítica.
Ejercicio\(\PageIndex{1}\)
¿Un fago latente es indetectable en una bacteria?
Transducción
La transducción ocurre cuando un bacteriófago transfiere ADN bacteriano de una bacteria a otra durante infecciones secuenciales. Existen dos tipos de transducción: la transducción generalizada y la especializada. Durante el ciclo lítico de replicación viral, el virus secuestra la célula huésped, degrada el cromosoma huésped y produce más genomas virales. Al ensamblar y empaquetar ADN en la cabeza del fago, el empaque ocasionalmente comete un error. En lugar de empaquetar el ADN viral, toma una pieza aleatoria de ADN del huésped y la inserta en la cápside. Una vez liberado, este virión inyectará entonces el ADN del ex huésped en un huésped recién infectado. La transferencia asexual de información genética puede permitir que se produzca la recombinación del ADN, proporcionando así al nuevo huésped nuevos genes (por ejemplo, un gen de resistencia a antibióticos o un gen metabolizador de azúcar). La transducción generalizada ocurre cuando un fragmento aleatorio de ADN cromosómico bacteriano es transferido por el fago durante el ciclo lítico. La transducción especializada ocurre al final del ciclo lisogénico, cuando se extirpa el profago y el bacteriófago entra en el ciclo lítico. Dado que el fago está integrado en el genoma del huésped, el profago puede replicarse como parte del hospedador. Sin embargo, algunas condiciones (por ejemplo, exposición a luz ultravioleta o exposición química) estimulan que el profago sufra inducción, haciendo que el fago se escinda del genoma, entre en el ciclo lítico y produzca nuevos fagos para dejar las células hospedadoras. Durante el proceso de escisión del cromosoma huésped, un fago ocasionalmente puede eliminar algo de ADN bacteriano cerca del sitio de integración viral. El fago y el ADN del huésped de un extremo o ambos extremos del sitio de integración se empaquetan dentro de la cápside y se transfieren al nuevo huésped infectado. Dado que el ADN transferido por el fago no se empaqueta aleatoriamente sino que es una pieza específica de ADN cerca del sitio de integración, este mecanismo de transferencia génica se denomina transducción especializada (ver Figura\(\PageIndex{3}\)). El ADN puede entonces recombinarse con el cromosoma huésped, dando a este último nuevas características. La transducción parece jugar un papel importante en el proceso evolutivo de las bacterias, dándoles un mecanismo de intercambio asexual de información genética.
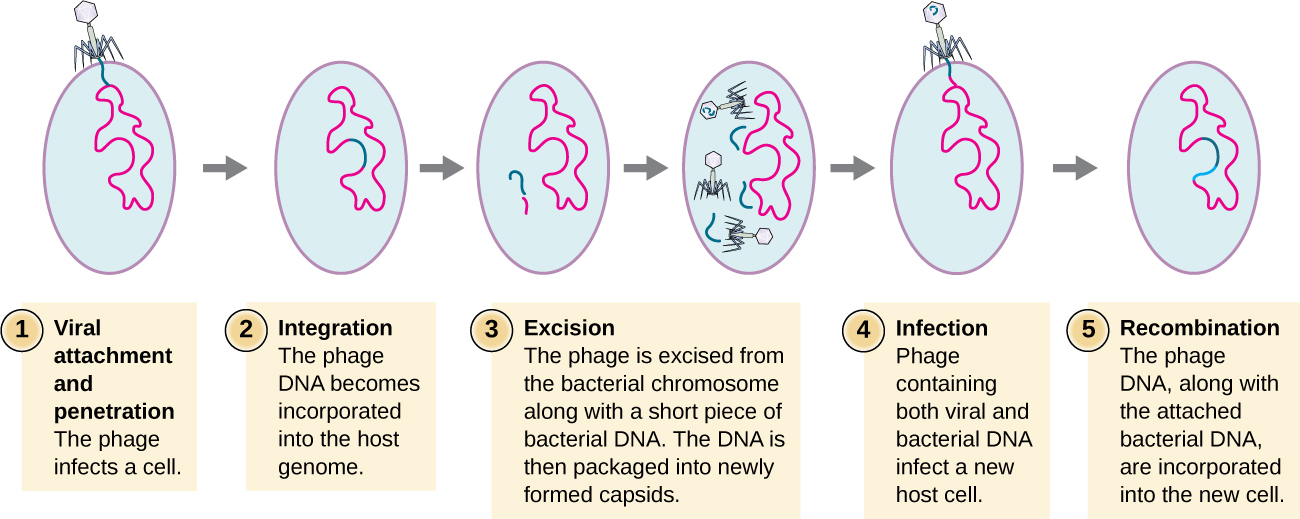
Ejercicio\(\PageIndex{2}\)
¿Qué ciclo de vida del fago está asociado con qué formas de transducción?
Ciclo de vida de los virus con hospedadores animales
Los virus líticos animales siguen estadios de infección similares a los bacteriófagos: unión, penetración, biosíntesis, maduración y liberación (ver Figura\(\PageIndex{4}\)). Sin embargo, los mecanismos de penetración, biosíntesis de ácidos nucleares y liberación difieren entre virus bacterianos y animales. Después de unirse a los receptores del huésped, los virus animales ingresan a través de endocitosis (engullido por la célula hospedadora) o a través de fusión de membrana (envoltura viral con la membrana de la célula huésped). Muchos virus son específicos del huésped, lo que significa que solo infectan a cierto tipo de hospedador; y la mayoría de los virus solo infectan ciertos tipos de células dentro de los tejidos. Esta especificidad se llama tropismo tisular. Ejemplos de esto lo demuestran el poliovirus, que exhibe tropismo por los tejidos del cerebro y médula espinal, o el virus de la influenza, que tiene un tropismo primario para el tracto respiratorio.
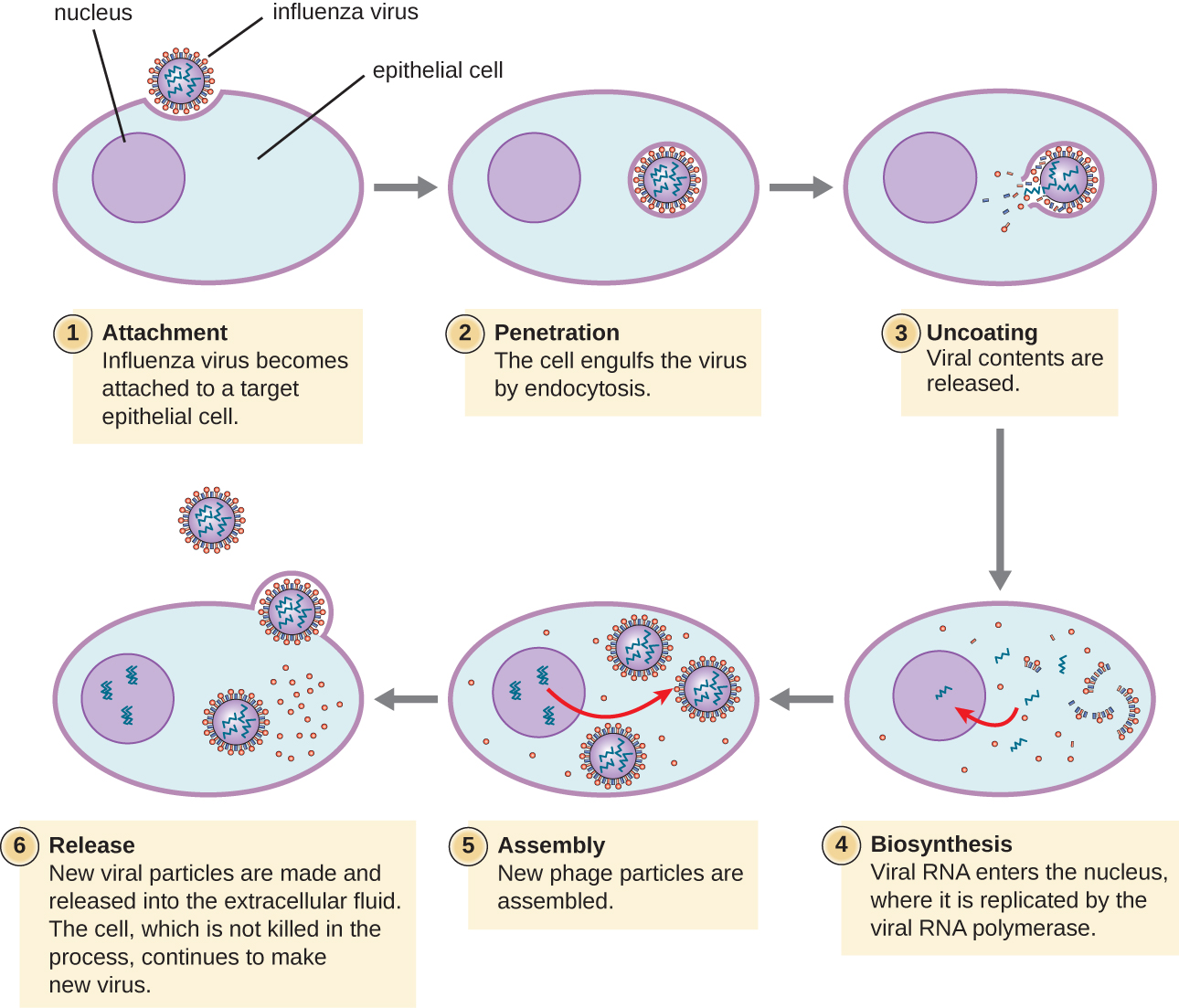
Los virus animales no siempre expresan sus genes usando el flujo normal de información genética, desde el ADN hasta el ARN y la proteína. Algunos virus tienen un genoma de ADNbc como los organismos celulares y pueden seguir el flujo normal. Sin embargo, otros pueden tener genomas de ssDNA, dsRNA o ssRNA. La naturaleza del genoma determina cómo se replica el genoma y se expresa como proteínas virales. Si un genoma es ssDNA, se usarán enzimas hospedadoras para sintetizar una segunda cadena que es complementaria a la cadena del genoma, produciendo así dsDNA. El ADNbc ahora se puede replicar, transcribir y traducir de manera similar al ADN del huésped.
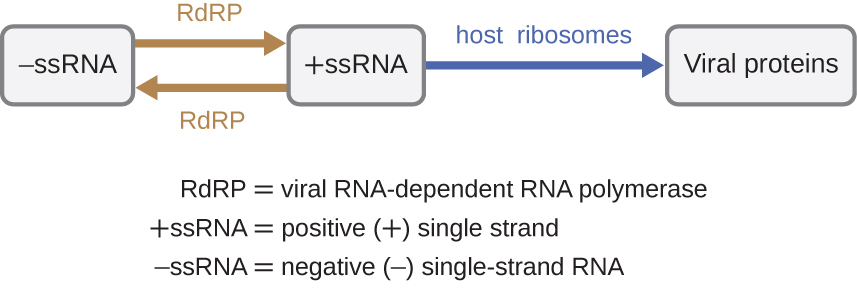
Si el genoma viral es ARN, se debe utilizar un mecanismo diferente. Hay tres tipos de genoma de ARN: ARNds, ARN monocatenario positivo (+) (+ARNss) o negativo (−) ARN monocatenario (−ARNss). Si un virus tiene un genoma +ARNmc, puede traducirse directamente para producir proteínas virales. El ARNss genómico viral actúa como ARNm celular. Sin embargo, si un virus contiene un genoma de -ARNss, los ribosomas del huésped no pueden traducirlo hasta que el ARNssARN se replica en +ARNss por la ARN polimerasa dependiente de ARN viral (RdRP) (ver Figura\(\PageIndex{5}\)). La RdRP es traída por el virus y puede ser utilizada para hacer +ARNss a partir del genoma original del ARNss. La RdRP también es una enzima importante para la replicación de virus de ARNbc, ya que utiliza la cadena negativa del genoma bicatenario como molde para crear +ARNmc. Las copias de ARNss recién sintetizadas pueden ser traducidas por ribosomas celulares.
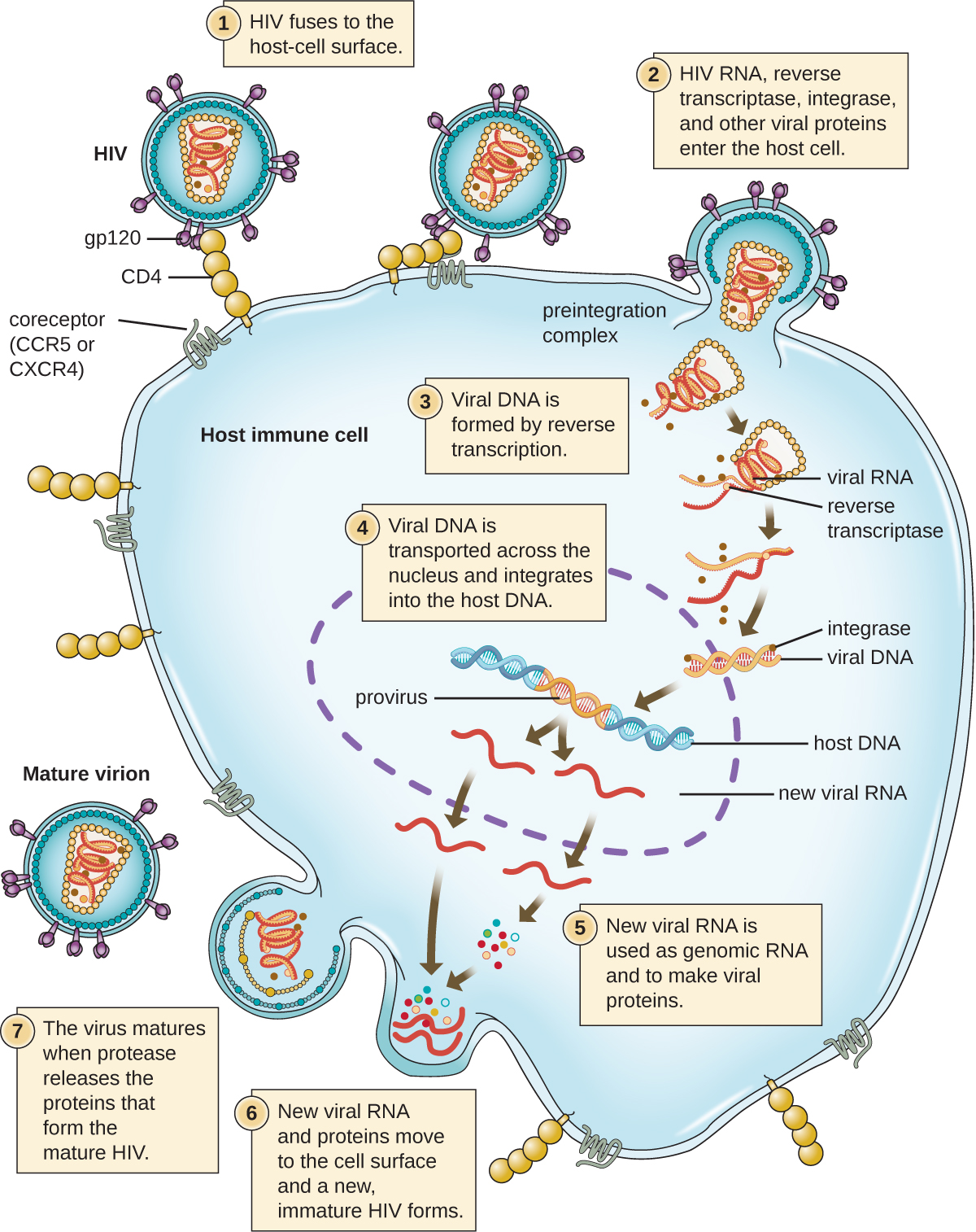
Se observa un mecanismo alternativo para la síntesis de ácidos nucleicos virales en los retrovirus, que son virus +ARNmc (ver Figura\(\PageIndex{6}\)). Los virus de ARN monocatenario como el VIH portan una enzima especial llamada transcriptasa inversa dentro de la cápside que sintetiza una copia complementaria de ADNss (ADNc) usando el genoma de ARNss como molde. El ADNss se convierte entonces en ADNds, que puede integrarse en el cromosoma huésped y convertirse en una parte permanente del huésped. El genoma viral integrado se llama provirus. El virus ahora puede permanecer en el huésped durante mucho tiempo para establecer una infección crónica. La etapa provirus es similar a la etapa del profago en una infección bacteriana durante el ciclo lisogénico. Sin embargo, a diferencia del profago, el provirus no se somete a escisión después de empalmar en el genoma.
Ejercicio\(\PageIndex{3}\)
¿La ARN polimerasa dependiente de ARN está hecha de un gen viral o de un gen huésped?
Infecciones Persistentes
La infección persistente ocurre cuando un virus no se elimina completamente del sistema del huésped sino que permanece en ciertos tejidos u órganos de la persona infectada. El virus puede permanecer en silencio o sufrir una infección productiva sin dañar o matar seriamente al huésped. Los mecanismos de infección persistente pueden implicar la regulación de las expresiones génicas virales o del huésped o la alteración de la respuesta inmune del huésped. Las dos categorías principales de infecciones persistentes son la infección latente y la infección crónica. Los ejemplos de virus que causan infecciones latentes incluyen el virus del herpes simple (herpes oral y genital), el virus varicela-zóster (varicela y culebrilla) y el virus de Epstein-Barr (mononucleosis). El virus de la hepatitis C y el VIH son dos ejemplos de virus que causan infecciones crónicas a largo plazo.
Infección latente
No todos los virus animales experimentan replicación por el ciclo lítico. Hay virus que son capaces de permanecer ocultos o inactivos dentro de la célula en un proceso llamado latencia. Estos tipos de virus se conocen como virus latentes y pueden causar infecciones latentes. Los virus capaces de latencia pueden causar inicialmente una infección aguda antes de quedarse latentes.
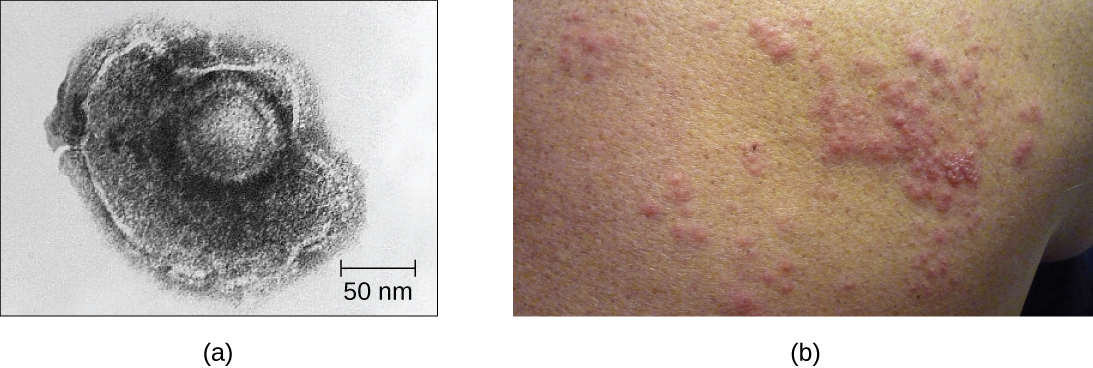
Por ejemplo, el virus varicela-zóster infecta muchas células en todo el cuerpo y causa varicela, caracterizado por una erupción de ampollas que cubren la piel. Alrededor de 10 a 12 días después de la infección, la enfermedad se resuelve y el virus se queda latente, viviendo dentro de los ganglios nerviosos durante años. Durante este tiempo, el virus no mata las células nerviosas ni continúa replicándose. No está claro por qué el virus deja de replicarse dentro de las células nerviosas y expresa pocas proteínas virales pero, en algunos casos, típicamente después de muchos años de latencia, el virus se reactiva y provoca una nueva enfermedad llamada culebrilla (Figura\(\PageIndex{7}\)). Mientras que la varicela afecta a muchas áreas del cuerpo, el herpes zóster es una enfermedad específica de las células nerviosas que emerge de los ganglios en los que el virus estaba latente.
Los virus latentes pueden permanecer latentes al existir como moléculas circulares del genoma viral fuera del cromosoma huésped. Otros se convierten en provirus al integrarse en el genoma del huésped. Durante la latencia, los virus no causan ningún síntoma de enfermedad y pueden ser difíciles de detectar. Un paciente puede no darse cuenta de que es portador del virus a menos que se le haya realizado una prueba de diagnóstico viral.
Infección Crónica
Una infección crónica es una enfermedad con síntomas recurrentes o persistentes durante mucho tiempo. Algunas infecciones virales pueden ser crónicas si el cuerpo es incapaz de eliminar el virus. El VIH es un ejemplo de un virus que produce una infección crónica, a menudo después de un largo periodo de latencia. Una vez que una persona se infecta con el VIH, el virus se puede detectar en los tejidos continuamente a partir de entonces, pero los pacientes no tratados a menudo no experimentan síntomas durante años. Sin embargo, el virus mantiene la persistencia crónica a través de varios mecanismos que interfieren con la función inmune, incluyendo la prevención de la expresión de antígenos virales en la superficie de las células infectadas, la alteración de las propias células inmunes, la restricción de la expresión de genes virales y el cambio rápido de antígenos virales a través mutación. Finalmente, el daño al sistema inmune da como resultado la progresión de la enfermedad que conduce al síndrome de inmunodeficiencia adquirida (SIDA). Los diversos mecanismos que utiliza el VIH para evitar ser aclarados por el sistema inmunitario también son utilizados por otros virus que infectan crónicamente, entre ellos el virus de la hepatitis C.
Ejercicio\(\PageIndex{4}\)
¿De qué dos maneras puede lograr un virus para mantener una infección persistente?
Ciclo de Vida de los Virus con Huésped Vegetal
Los virus vegetales son más similares a los virus animales que a los bacteriófagos. Los virus vegetales pueden estar envueltos o no envueltos. Al igual que muchos virus animales, los virus vegetales pueden tener un genoma de ADN o ARN y ser monocatenarios o bicatenarios. Sin embargo, la mayoría de los virus vegetales no tienen un genoma de ADN; la mayoría tienen un genoma +ARNmc, que actúa como ARN mensajero (ARNm). Sólo una minoría de virus vegetales tiene otro tipo de genomas.
Los virus vegetales pueden tener un rango de hospedadores estrecho o amplio. Por ejemplo, el virus de la tristeza de los cítricos infecta solo unas pocas plantas del género Citrus, mientras que el virus del mosaico del pepino infecta a miles de plantas de diversas familias de plantas. La mayoría de los virus vegetales se transmiten por contacto entre plantas, o por hongos, nematodos, insectos u otros artrópodos que actúan como vectores mecánicos. Sin embargo, algunos virus solo pueden ser transferidos por un tipo específico de vector de insecto; por ejemplo, un virus en particular podría ser transmitido por pulgones pero no por moscas blancas. En algunos casos, los virus también pueden ingresar a plantas sanas a través de heridas, como podría ocurrir debido a podas o daños climáticos.
Los virus que infectan a las plantas son considerados parásitos biotróficos, lo que significa que pueden establecer una infección sin matar al huésped, similar a lo que se observa en los ciclos de vida lisogénicos de los bacteriófagos. La infección viral puede ser asintomática (latente) o puede provocar la muerte celular (infección lítica). El ciclo de vida comienza con la penetración del virus en la célula hospedadora. A continuación, el virus no se recubre dentro del citoplasma de la célula cuando se retira la cápside. Dependiendo del tipo de ácido nucleico, los componentes celulares se utilizan para replicar el genoma viral y sintetizar proteínas virales para el ensamblaje de nuevos viriones. Para establecer una infección sistémica, el virus debe ingresar a una parte del sistema vascular de la planta, como el floema. El tiempo requerido para la infección sistémica puede variar de unos días a algunas semanas dependiendo del virus, la especie vegetal y las condiciones ambientales. El ciclo de vida del virus se completa cuando se transmite de una planta infectada a una planta sana.
Ejercicio\(\PageIndex{5}\)
¿Cuál es la estructura y el genoma de un virus vegetal típico?
Curva de Crecimiento Viral
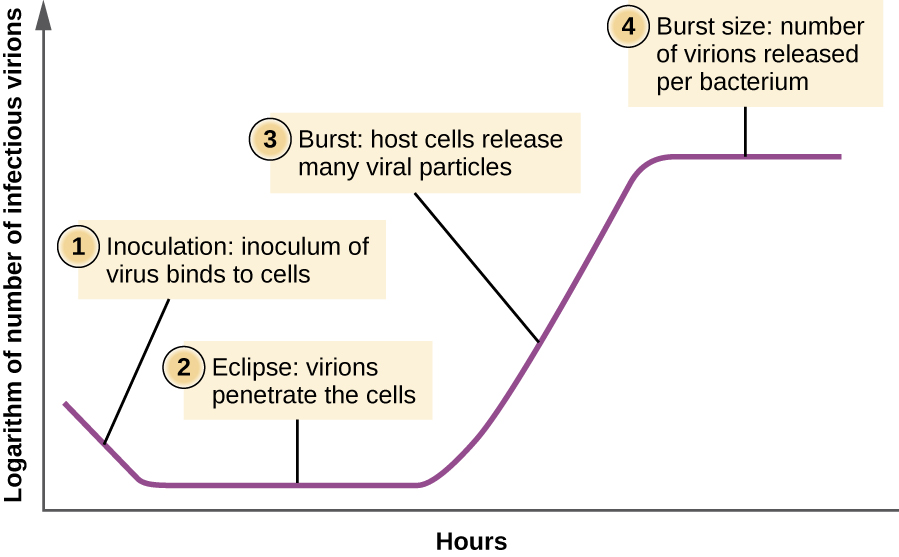
A diferencia de la curva de crecimiento para una población bacteriana, la curva de crecimiento para una población de virus a lo largo de su ciclo de vida no sigue una curva sigmoidea. Durante la etapa inicial, un inóculo de virus provoca infección. En la fase eclipse, los virus se unen y penetran en las células sin que se detecten viriones en el medio. La principal diferencia que aparece a continuación en la curva de crecimiento viral en comparación con una curva de crecimiento bacteriano ocurre cuando los viriones se liberan de la célula hospedadora lisada al mismo tiempo. Tal ocurrencia se denomina estallido, y el número de viriones por bacteria liberada se describe como el tamaño de la ráfaga. En una curva de multiplicación de un solo paso para bacteriófago, las células hospedadoras se lisan, liberando muchas partículas virales al medio, lo que conduce a un aumento muy pronunciado en el título viral (el número de viriones por unidad de volumen). Si no quedan células hospedadoras viables, las partículas virales comienzan a degradarse durante el declive del cultivo (ver Figura\(\PageIndex{8}\)).
Ejercicio\(\PageIndex{6}\)
¿Qué aspecto del ciclo de vida de un virus conduce al aumento repentino de la curva de crecimiento?
Tratamientos no registrados
El ébola es incurable y mortal. El brote en África Occidental en 2014 no tuvo precedentes, empequeñeciendo otras epidemias humanas de ébola en el nivel de mortalidad. De 24 mil 666 casos sospechosos o confirmados reportados, fallecieron 10 mil 179 personas. 1
No hay tratamientos ni vacunas aprobados para el Ébola disponibles. Si bien algunos medicamentos han mostrado potencial en estudios de laboratorio y modelos animales, no se han probado en humanos para su seguridad y efectividad. No sólo estos medicamentos no se prueban o no están registrados sino que también escasean.
Ante el gran sufrimiento y las altas tasas de mortalidad, es justo preguntarse si los medicamentos no registrados y no probados son mejores que ninguno en absoluto. ¿Deberían dispensarse esos medicamentos y, de ser así, quién debería recibirlos, a la luz de sus suministros sumamente limitados? ¿Es ético tratar medicamentos no probados en pacientes con Ébola? Por otro lado, ¿es ético retener medicamentos potencialmente salvavidas a pacientes moribundos? ¿O quizás deberían reservarse los medicamentos para los proveedores de salud que trabajan para contener la enfermedad?
En agosto de 2014, dos trabajadores humanitarios estadounidenses infectados y un sacerdote español fueron tratados con ZMAPp, un medicamento no registrado que había sido probado en monos pero no en humanos. Los dos trabajadores humanitarios estadounidenses se recuperaron, pero el sacerdote murió. Posteriormente ese mes, la OMS dio a conocer un informe sobre la ética de tratar a los pacientes con el medicamento. Dado que el ébola suele ser fatal, el panel razonó que es ético dar los medicamentos no registrados y poco ético retenerlos por motivos de seguridad. Esta situación es un ejemplo de “uso compasivo” fuera del sistema bien establecido de regulación y gobernanza de las terapias.
Ébola en EU
El 24 de septiembre de 2014, Thomas Eric Duncan llegó al Texas Health Presbyterian Hospital en Dallas quejándose de fiebre, dolor de cabeza, vómitos y diarrea, síntomas comúnmente observados en pacientes con resfriado o gripe. Después del examen, un médico del departamento de urgencias le diagnosticó sinusitis, le recetó algunos antibióticos y lo envió a su casa. Dos días después, Duncan regresó al hospital en ambulancia. Su condición se había deteriorado y análisis de sangre adicionales confirmaron que ha sido infectado con el virus del Ébola.
Investigaciones posteriores revelaron que Duncan acababa de regresar de Liberia, uno de los países en medio de una severa epidemia de ébola. El 15 de septiembre, nueve días antes de presentarse en el hospital de Dallas, Duncan había ayudado a transportar a un vecino afectado por el ébola a un hospital en Liberia. El hospital continuó atendiendo a Duncan, pero falleció varios días después de ser ingresado.
El cronograma del caso Duncan es indicativo del ciclo de vida del virus del Ébola. El tiempo de incubación para el ébola oscila entre 2 días y 21 días. Pasaron nueve días entre la exposición de Duncan a la infección por el virus y la aparición de sus síntomas. Esto corresponde, en parte, al periodo de eclipse en el crecimiento de la población de virus. Durante la fase de eclipse, Duncan no habría podido transmitir la enfermedad a otros. Sin embargo, una vez que un individuo infectado comienza a presentar síntomas, la enfermedad se vuelve muy contagiosa. El virus del Ébola se transmite a través del contacto directo con gotitas de fluidos corporales como saliva, sangre y vómito. Duncan podría posiblemente haber transmitido la enfermedad a otros en cualquier momento después de que comenzara a tener síntomas, presumiblemente algún tiempo antes de su llegada al hospital de Dallas. Una vez que un hospital se da cuenta de que un paciente como Duncan está infectado con el virus del Ébola, el paciente es inmediatamente puesto en cuarentena, y los funcionarios de salud pública inician un rastro de espalda para identificar a todas las personas con las que un paciente como Duncan pudo haber interactuado durante el periodo en el que estaba mostrando síntomas.
Los funcionarios de salud pública pudieron rastrear a 10 individuos de alto riesgo (familiares de Duncan) y 50 individuos de bajo riesgo para monitorearlos en busca de signos de infección. Ninguno contrajo la enfermedad. No obstante, una de las enfermeras encargadas de la atención de Duncan sí se contagió. Esto, junto con el diagnóstico erróneo inicial de Duncan, dejó en claro que los hospitales estadounidenses necesitaban brindar capacitación adicional al personal médico para prevenir un posible brote de ébola en Estados Unidos.
Ejercicio\(\PageIndex{7}\)
- ¿Qué tipos de capacitación pueden preparar a los profesionales de la salud para contener epidemias emergentes como el brote de ébola de 2014?
- ¿Cuál es la diferencia entre un patógeno contagioso y un patógeno infeccioso?

Para obtener información adicional sobre el ébola, visite el sitio web de los CDC.
Resumen
- Muchos virus se dirigen a hospedadores o tejidos específicos. Algunos pueden tener más de un anfitrión.
- Muchos virus siguen varias etapas para infectar las células hospedadoras. Estas etapas incluyen unión, penetración, desrecubrimiento, biosíntesis, maduración y liberación.
- Los bacteriófagos tienen un ciclo lítico o lisogénico. El ciclo lítico conduce a la muerte del huésped, mientras que el ciclo lisogénico conduce a la integración del fago en el genoma del huésped.
- Los bacteriófagos inyectan ADN en la célula hospedadora, mientras que los virus animales ingresan por endocitosis o fusión de membrana.
- Los virus animales pueden sufrir latencia, similar a la lisogenia de un bacteriófago.
- La mayoría de los virus vegetales son ARNmc de cadena positiva y pueden sufrir latencia, infección crónica o lítica, como se observa para los virus animales.
- La curva de crecimiento de las poblaciones de bacteriófagos es una curva de multiplicación de un solo paso y no una curva sigmoidea, en comparación con la curva de crecimiento bacteriano.
- Los bacteriófagos transfieren información genética entre hospedadores mediante transducción generalizada o especializada.
Notas al pie
- 1 Organización Mundial de la Salud. “Datos y estadísticas sobre el ébola de la OMS”. 18 de marzo de 2005. http://apps.who.int/gho/data/view.eb...150318? lang=es


