6.3: Aislamiento, Cultivo e Identificación de Virus
- Page ID
- 54460
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Discutir por qué los virus se describieron originalmente como agentes filtrables
- Describir el cultivo de virus y la recolección y manejo de especímenes
- Comparar técnicas in vivo e in vitro utilizadas para cultivar virus
Al inicio de este capítulo, describimos cómo se utilizaron filtros Chamberland de porcelana con poros lo suficientemente pequeños como para permitir el paso de los virus para descubrir el TMV. Hoy en día, los filtros de porcelana han sido reemplazados por filtros de membrana y otros dispositivos utilizados para aislar e identificar virus.
Aislamiento de Virus
A diferencia de las bacterias, muchas de las cuales pueden cultivarse en un medio nutritivo artificial, los virus requieren una célula hospedadora viva para su replicación. Las células hospedadoras infectadas (eucariotas o procariotas) pueden cultivarse y cultivarse, y luego el medio de crecimiento se puede cosechar como fuente de virus. Los viriones en el medio líquido pueden separarse de las células hospedadoras por centrifugación o filtración. Los filtros pueden eliminar físicamente cualquier cosa presente en la solución que sea más grande que los viriones; los virus pueden luego ser recolectados en el filtrado (Figura\(\PageIndex{1}\)).
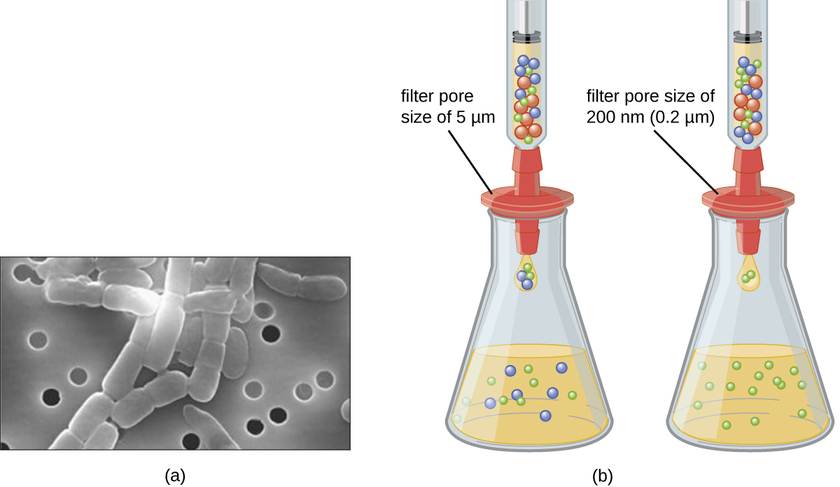
Ejercicio\(\PageIndex{1}\)
¿Qué tamaño de poro de filtro se necesita para recolectar un virus?
Cultivo de Virus
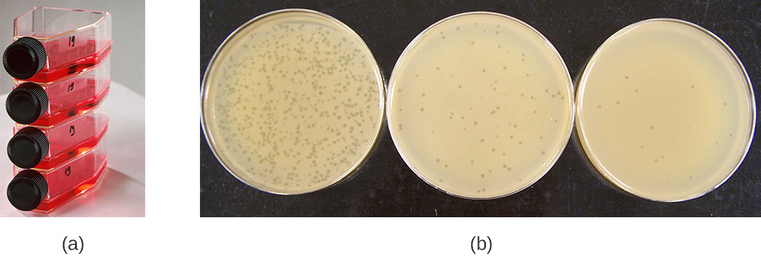
Los virus pueden cultivarse in vivo (dentro de un organismo vivo completo, planta o animal) o in vitro (fuera de un organismo vivo en células en un ambiente artificial, como un tubo de ensayo, matraz de cultivo celular o placa de agar). Los bacteriófagos se pueden cultivar en presencia de una capa densa de bacterias (también llamada césped bacteriano) cultivada en un agar blando de 0.7% en una placa Petri o matraz plano (horizontal) (Figura\(\PageIndex{2a}\)). La concentración de agar disminuye desde el 1.5% que se usa habitualmente en el cultivo de bacterias. El agar blando 0.7% permite que los bacteriófagos se difundan fácilmente a través del medio. Para los bacteriófagos líticos, la lisis de los huéspedes bacterianos se puede observar fácilmente cuando se detecta una zona clara llamada placa (Figura\(\PageIndex{1b}\)). A medida que el fago mata a la bacteria, se observan muchas placas entre el césped bacteriano turbio.
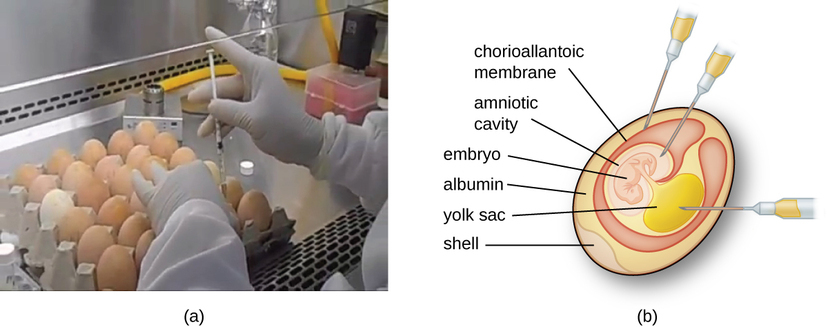
Los virus animales requieren células dentro de un animal huésped o células de cultivo tisular derivadas de un animal. El cultivo de virus animales es importante para 1) identificación y diagnóstico de virus patógenos en especímenes clínicos, 2) producción de vacunas y 3) estudios de investigación básica. Las fuentes huésped in vivo pueden ser un embrión en desarrollo en un huevo de ave embrionado (por ejemplo, pollo, pavo) o un animal entero. Por ejemplo, la mayor parte de la vacuna antigripal fabricada para los programas anuales de vacunación contra la influenza se cultiva en huevos de gallina.
El embrión o animal hospedador sirve como incubadora para la replicación viral (Figura\(\PageIndex{3}\)). La ubicación dentro del embrión o animal huésped es importante. Muchos virus tienen un tropismo tisular y, por lo tanto, deben introducirse en un sitio específico para su crecimiento. Dentro de un embrión, los sitios diana incluyen la cavidad amniótica, la membrana corioalantoidea o el saco vitelino. La infección viral puede dañar las membranas de los tejidos, produciendo lesiones llamadas viruela; perturbar el desarrollo embrionario; o causar la muerte del embrión.
Para estudios in vitro, se pueden utilizar diversos tipos de células para apoyar el crecimiento de virus. Un cultivo celular primario se prepara recientemente a partir de órganos o tejidos animales. Las células se extraen de los tejidos mediante raspado mecánico o picado para liberar células o mediante un método enzimático usando tripsina o colagenasa para romper el tejido y liberar células individuales en suspensión. Debido a los requisitos de dependencia del anclaje, los cultivos celulares primarios requieren un medio de cultivo líquido en una placa de Petri o matraz de cultivo tisular, por lo que las células tienen una superficie sólida como vidrio o plástico para su unión y crecimiento. Las culturas primarias suelen tener una vida útil limitada. Cuando las células en un cultivo primario sufren mitosis y se produce una densidad suficiente de células, las células entran en contacto con otras células. Cuando se produce este contacto célula a célula, la mitosis se activa para que se detenga. Esto se llama inhibición de contacto y evita que la densidad de las células llegue a ser demasiado alta. Para evitar la inhibición por contacto, las células del cultivo celular primario deben transferirse a otro recipiente con medio de crecimiento fresco. Esto se denomina cultivo celular secundario. Periódicamente, la densidad celular debe reducirse vertiendo algunas células y agregando medio fresco para proporcionar espacio y nutrientes para mantener el crecimiento celular. A diferencia de los cultivos celulares primarios, las líneas celulares continuas, generalmente derivadas de células transformadas o tumores, a menudo son capaces de subcultivarse muchas veces o incluso crecer indefinidamente (en cuyo caso se les llama inmortales). Las líneas celulares continuas pueden no exhibir dependencia de anclaje (crecerán en suspensión) y pueden haber perdido su inhibición de contacto. Como resultado, las líneas celulares continuas pueden crecer en pilas o grumos que se asemejan a pequeños crecimientos tumorales (Figura\(\PageIndex{4}\)).
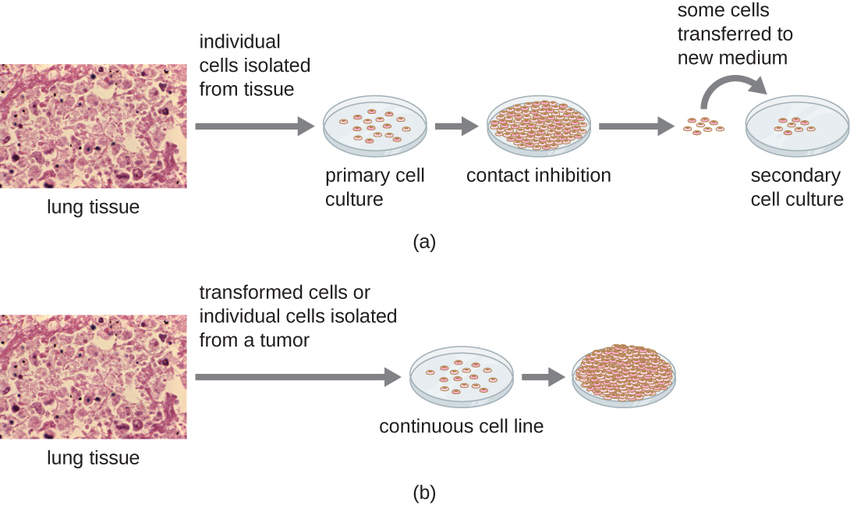
Un ejemplo de una línea celular inmortal es la línea celular HeLa, que originalmente se cultivó a partir de células tumorales obtenidas de Henrietta Lacks, paciente que murió de cáncer de cuello uterino en 1951. Las células HeLa fueron la primera línea celular de cultivo continuo de tejidos y se utilizaron para establecer el cultivo de tejidos como una tecnología importante para la investigación en biología celular, virología y medicina. Antes del descubrimiento de las células HeLa, los científicos no pudieron establecer cultivos de tejidos con ninguna confiabilidad o estabilidad. Más de seis décadas después, esta línea celular sigue viva y siendo utilizada para la investigación médica. Ver La línea celular inmortal de Henrietta carece de leer más sobre esta importante línea celular y los polémicos medios por los que se obtuvo.
Ejercicio\(\PageIndex{2}\)
¿Qué propiedad de las células hace necesarias diluciones periódicas de cultivos celulares primarios?
La línea celular inmortal de Henrietta carece
En enero de 1951, Henrietta Lacks, una mujer afroamericana de 30 años de Baltimore, fue diagnosticada con cáncer de cuello uterino en el Hospital John Hopkins. Ahora sabemos que su cáncer fue causado por el virus del papiloma humano (VPH). Los efectos citopáticos del virus alteraron las características de sus células en un proceso llamado transformación, que da a las células la capacidad de dividirse continuamente. Esta habilidad, por supuesto, resultó en un tumor canceroso que finalmente mató a la señora Lacks en octubre a los 31 años. Antes de su muerte, se tomaron muestras de sus células cancerosas sin su conocimiento o permiso. Las muestras finalmente terminaron en posesión del Dr. George Gey, investigador biomédico de la Universidad Johns Hopkins. Gey pudo cultivar algunas de las células de la muestra de Lacks, creando lo que hoy se conoce como la línea celular inmortal HeLa. Estas células tienen la capacidad de vivir y crecer indefinidamente y, aún hoy en día, siguen siendo ampliamente utilizadas en muchas áreas de investigación.
Según el esposo de Lacks, ni Henrietta ni la familia dieron permiso al hospital para recoger su espécimen de tejido. En efecto, la familia no tuvo conocimiento hasta 20 años después de la muerte de Lacks de que sus células seguían vivas y se usaban activamente con fines comerciales y de investigación. Sin embargo, las células HeLa han sido fundamentales en numerosos descubrimientos de investigación relacionados con la polio, el cáncer y el SIDA, entre otras enfermedades. Las células también han sido comercializadas, aunque nunca han sido patentadas ellas mismas. A pesar de ello, el patrimonio de Henrietta Lacks nunca se ha beneficiado con el uso de las células, aunque, en 2013, la familia Lacks recibió el control sobre la publicación de la secuencia genética de sus células.
Este caso plantea varias cuestiones bioéticas en torno al consentimiento informado de los pacientes y el derecho a saber. En el momento en que se tomaron los tejidos de Lacks, no había leyes ni lineamientos sobre el consentimiento informado. ¿Significa eso que fue tratada de manera justa en ese momento? Ciertamente para los estándares actuales, la respuesta sería no. La extracción de tejido u órganos de un paciente moribundo sin consentimiento no solo se considera poco ético sino ilegal, independientemente de que tal acto pueda salvar la vida de otros pacientes. ¿Es ético, entonces, que los científicos sigan utilizando los tejidos de Lacks para la investigación, a pesar de que fueron obtenidos ilegalmente según los estándares actuales?
Éticas o no, las células de Lacks son ampliamente utilizadas hoy en día para tantas aplicaciones que es imposible enumerarlas todas. ¿Es este un caso en el que los fines justifican los medios? ¿Le agradaría a Lacks conocer su contribución a la ciencia y los millones de personas que se han beneficiado? ¿Querría que su familia fuera compensada por los productos comerciales que se han desarrollado usando sus células? ¿O se sentiría violada y explotada por los investigadores que tomaron parte de su cuerpo sin su consentimiento? Porque nunca le preguntaron, nunca lo sabremos.
Detección de un Virus
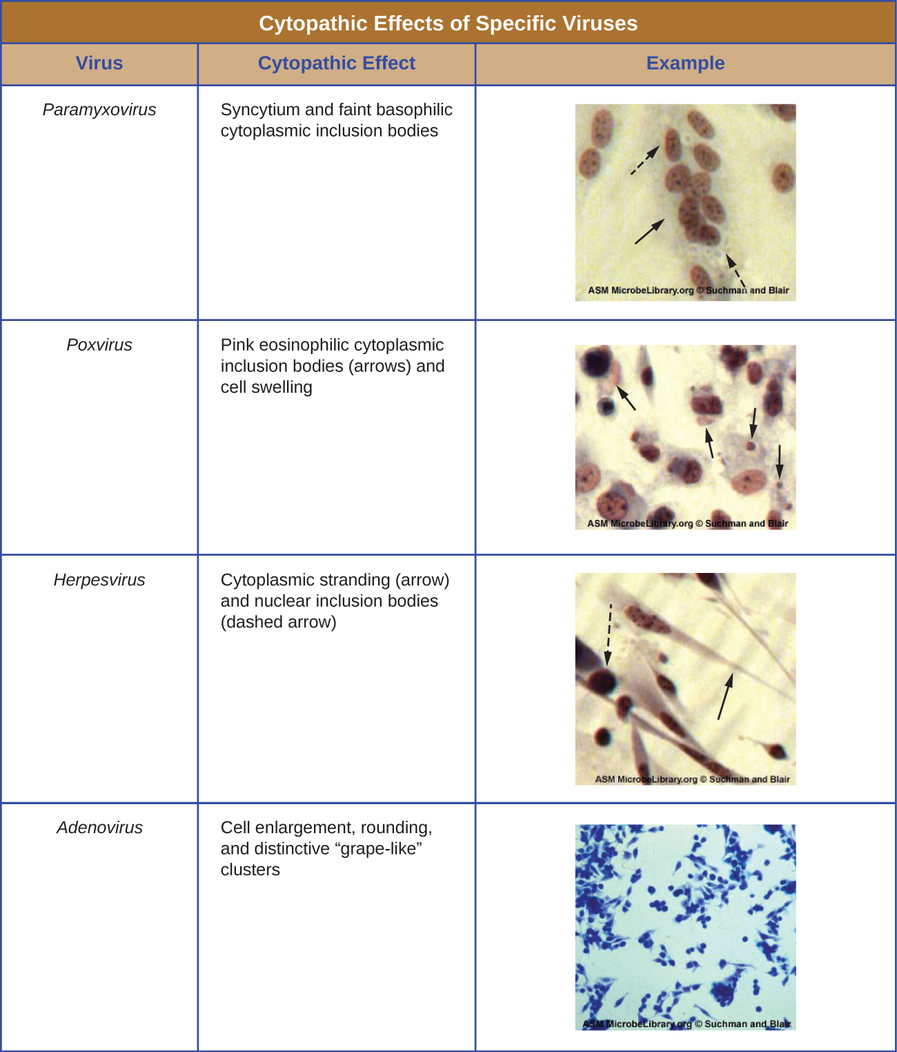
Independientemente del método de cultivo, una vez que un virus se ha introducido en un organismo huésped completo, embrión o célula de cultivo tisular, se puede preparar una muestra a partir del huésped infectado, embrión o línea celular para su posterior análisis bajo un microscopio de campo claro, electrónico o fluorescente. Los efectos citopáticos (CPEs) son distintas anomalías celulares observables debido a la infección viral. Los CPEs pueden incluir pérdida de adherencia a la superficie del recipiente, cambios en la forma celular de plano a redondo, contracción del núcleo, vacuolas en el citoplasma, fusión de membranas citoplásmicas y formación de sincitios multinucleados, cuerpos de inclusión en el núcleo o citoplasma, y lisis celular completa ( ver Figura\(\PageIndex{6}\)).
Otros cambios patológicos incluyen la alteración viral del genoma del huésped y la alteración de las células normales en células transformadas, que son los tipos de células asociadas con carcinomas y sarcomas. El tipo o gravedad del CPE depende del tipo de virus involucrado. La figura\(\PageIndex{6}\) enumera los CPE para virus específicos.
Mira este video para conocer los efectos de los virus en las células.
Ensayo de hemaglutinación
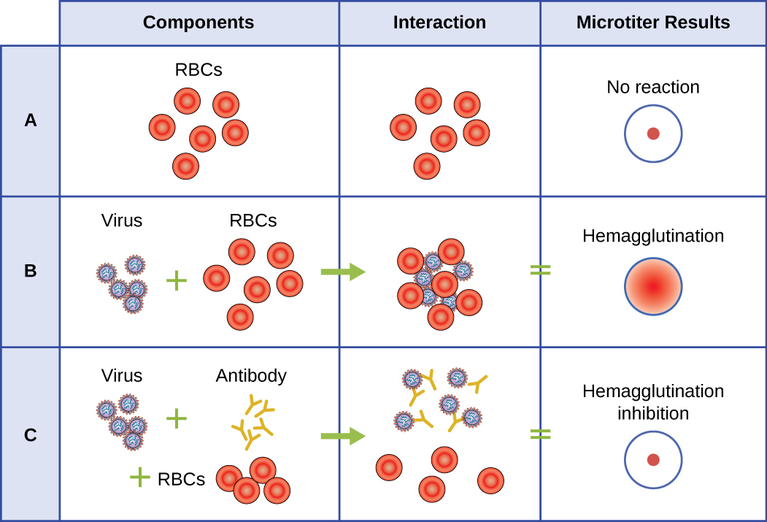
Se utiliza un ensayo serológico para detectar la presencia de ciertos tipos de virus en el suero del paciente. El suero es la fracción líquida de color pajizo del plasma sanguíneo de la que se han eliminado los factores de coagulación. El suero se puede utilizar en un ensayo directo llamado ensayo de hemaglutinación para detectar tipos específicos de virus en la muestra del paciente. La hemaglutinación es la aglutinación (aglutinación) de los eritrocitos (glóbulos rojos). Muchos virus producen proteínas superficiales o espigas llamadas hemaglutininas que pueden unirse a receptores en las membranas de los eritrocitos y hacer que las células se aglutinen. La hemaglutinación es observable sin usar el microscopio, pero este método no siempre diferencia entre partículas virales infecciosas y no infecciosas, ya que ambas pueden aglutinar eritrocitos.
Para identificar un virus patógeno específico mediante hemaglutinación, debemos usar un enfoque indirecto. Las proteínas llamadas anticuerpos, generadas por el sistema inmune del paciente para combatir un virus específico, pueden usarse para unirse a componentes como las hemaglutininas que están asociadas de manera única con tipos específicos de virus. La unión de los anticuerpos con las hemaglutininas encontradas en el virus posteriormente impide que los eritrocitos interactúen directamente con el virus. Entonces, cuando se agregan eritrocitos a los virus recubiertos de anticuerpos, no hay aparición de aglutinación; se ha inhibido la aglutinación. Llamamos a este tipo de ensayos indirectos para anticuerpos específicos de virus ensayos de inhibición de la hemaglutinación (HAI). La HAI se puede utilizar para detectar la presencia de anticuerpos específicos de muchos tipos de virus que pueden estar causando o haber causado una infección en un paciente incluso meses o años después de la infección (ver Figura\(\PageIndex{7}\)). Este ensayo se describe con mayor detalle en Ensayos de aglutinación.
Ejercicio\(\PageIndex{3}\)
¿Cuál es el resultado de una prueba de EIA positiva?
Prueba de amplificación de ácido nucleico
Las pruebas de amplificación de ácidos nucleicos (NAAT) se utilizan en biología molecular para detectar secuencias únicas de ácidos nucleicos de virus en muestras de pacientes. La reacción en cadena de la polimerasa (PCR) es un NAAT utilizado para detectar la presencia de ADN viral en una muestra de tejido o líquido corporal de un paciente. La PCR es una técnica que amplifica (es decir, sintetiza muchas copias) de un segmento de ADN viral de interés. Mediante PCR, las secuencias cortas de nucleótidos llamadas cebadores se unen a secuencias específicas de ADN viral, permitiendo la identificación del virus.
La transcriptasa inversa PCR (RT-PCR) es un NAAT utilizado para detectar la presencia de virus de ARN. La RT-PCR difiere de la PCR en que la enzima transcriptasa inversa (RT) se usa para elaborar un ADNc a partir de la pequeña cantidad de ARN viral en el espécimen. El ADNc puede amplificarse entonces por PCR. Tanto la PCR como la RT-PCR se utilizan para detectar y confirmar la presencia del ácido nucleico viral en especímenes de pacientes.
Susto de VPH
Michelle, una estudiante de enfermería de 21 años, llegó a la clínica universitaria preocupada de que pudiera haber estado expuesta a una enfermedad de transmisión sexual (ETS). Su pareja sexual había desarrollado recientemente varios bultos en la base de su pene. Había pospuesto ir al médico, pero Michelle sospecha que son verrugas genitales causadas por el VPH. Está especialmente preocupada porque sabe que el VPH no solo causa verrugas sino que es una causa prominente de cáncer de cuello uterino. Ella y su pareja siempre usan condones como anticoncepción, pero no confía en que esta precaución la proteja del VPH.
El médico de Michelle no encuentra signos físicos de verrugas genitales ni ninguna otra ETS, pero recomienda que Michelle se haga una prueba de Papanicolaou junto con una prueba de VPH. La prueba de Papanicolaou buscará células cervicales anormales y los CPEs asociados con el VPH; la prueba de VPH analizará la presencia del virus. Si ambas pruebas son negativas, Michelle puede estar más segura de que lo más probable es que no se haya infectado con el VPH. Sin embargo, su médico sugiere que podría ser prudente que Michelle se vacune contra el VPH para protegerse de una posible exposición futura.
Ejercicio\(\PageIndex{4}\)
¿Por qué el médico de Michelle ordena dos pruebas diferentes en lugar de depender de una u otra?
Inmunoensayo enzimático
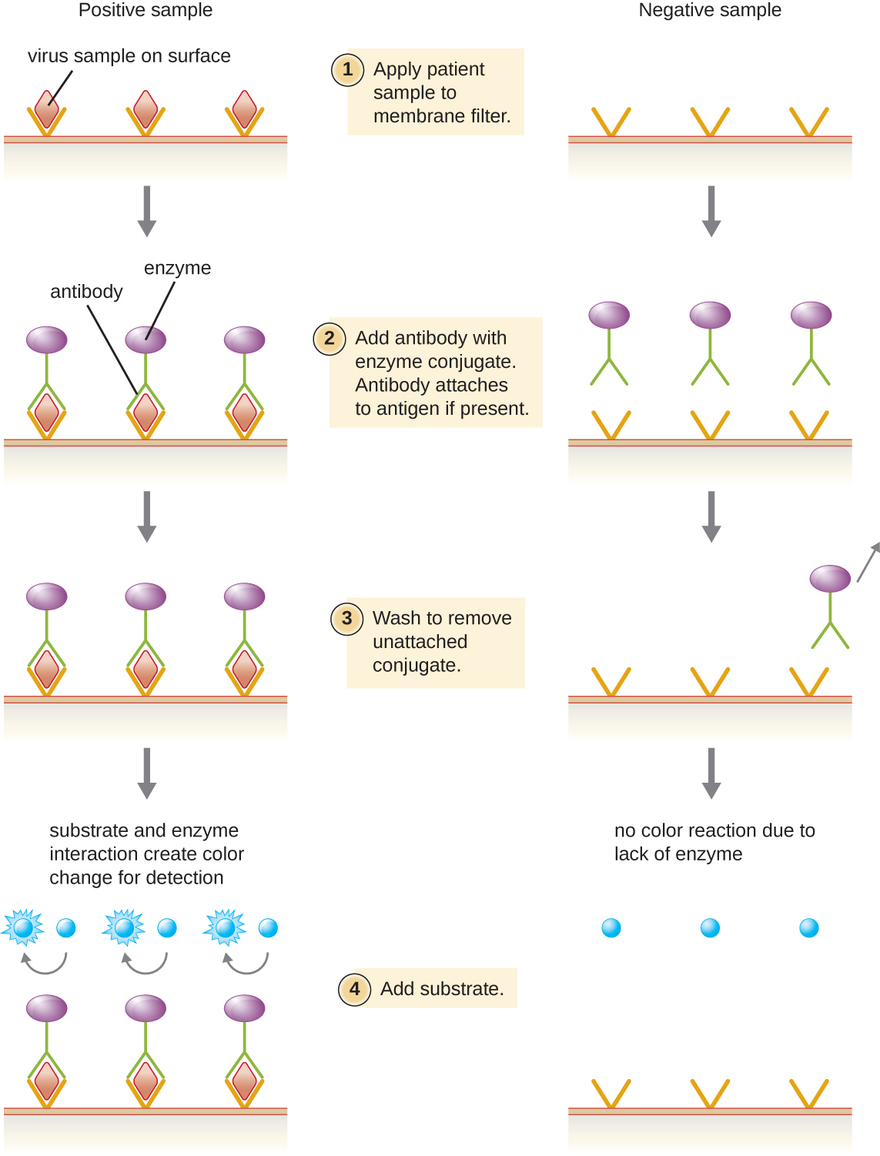
Los inmunoensayos enzimáticos (EIA) se basan en la capacidad de los anticuerpos para detectar y unirse a biomoléculas específicas llamadas antígenos. El anticuerpo de detección se une al antígeno diana con un alto grado de especificidad en lo que podría ser una mezcla compleja de biomoléculas. También se incluye en este tipo de ensayo una enzima incolora unida al anticuerpo de detección. La enzima actúa como una etiqueta en el anticuerpo de detección y puede interactuar con un sustrato incoloro, lo que lleva a la producción de un producto final coloreado. Los EIA a menudo se basan en capas de anticuerpos para capturar y reaccionar con antígenos, todos los cuales están unidos a un filtro de membrana (ver Figura\(\PageIndex{8}\)). Los EIA para antígenos virales se utilizan a menudo como pruebas preliminares de detección. Si los resultados son positivos, una confirmación adicional requerirá pruebas con una sensibilidad aún mayor, como una transferencia Western o una NAAT. Los EIA se discuten con más detalle en EIA y ELISA.
Ejercicio\(\PageIndex{5}\)
¿Qué suele indicar una prueba de EIA positiva?
Enfoque Clínico: Parte 3
Junto con el análisis RT/PCR, también se colectó saliva de David para cultivo viral. En general, ninguna prueba diagnóstica única es suficiente para el diagnóstico antemortem, ya que los resultados dependerán de la sensibilidad del ensayo, la cantidad de viriones presentes al momento de la prueba, y el momento del ensayo, ya que la liberación de viriones en la saliva puede variar. Resulta que el resultado fue negativo para el cultivo viral a partir de la saliva. Esto no es sorprendente para el médico de David, porque un resultado negativo no es un indicio absoluto de la ausencia de infección. Puede ser que el número de viriones en la saliva sea bajo al momento del muestreo. No es inusual repetir la prueba a intervalos para mejorar la posibilidad de detectar mayores cargas de virus.
Ejercicio\(\PageIndex{6}\)
¿Debe el médico de David modificar su curso de tratamiento con base en los resultados de estas pruebas?
Resumen
- El cultivo viral requiere la presencia de alguna forma de célula hospedadora (organismo completo, embrión o cultivo celular).
- Los virus pueden aislarse de las muestras por filtración.
- El filtrado viral es una rica fuente de viriones liberados.
- Los bacteriófagos se detectan por la presencia de placas claras en el césped bacteriano.
- Los virus animales y vegetales se detectan mediante efectos citopáticos, técnicas moleculares (PCR, RT-PCR), inmunoensayos enzimáticos y ensayos serológicos (ensayo de hemaglutinación, ensayo de inhibición de hemaglutinación).


