6.4: Viroides, Virusoides y Priones
- Page ID
- 54444
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Describir los viroides y sus características únicas
- Describir los virusoides y sus características únicas
- Describir los priones y sus características únicas
Los intentos de investigación para descubrir los agentes causantes de enfermedades no investigadas previamente han llevado al descubrimiento de agentes de enfermedades no vivientes bastante diferentes de los virus. Estas incluyen partículas que consisten solo en ARN o solo en proteínas que, sin embargo, son capaces de autopropagarse a expensas de un hospedador, una similitud clave con los virus que les permite causar afecciones de enfermedad. Hasta la fecha, estos descubrimientos incluyen viroides, virusoides y priones proteínicos.
Viroides
En 1971, Theodor Diener, patólogo que trabajaba en el Servicio de Investigación Agrícola, descubrió una partícula acelular a la que llamó viroide, que significa “similar a un virus”. Los viroides consisten únicamente en una cadena corta de ARN circular capaz de autorreplicación. Se encontró que el primer viroide descubierto causa enfermedad del huso del tubérculo de papa, lo que provoca un brote más lento y diversas deformidades en las plantas de papa (ver Figura\(\PageIndex{1}\)). Al igual que los virus, los viroides del tubérculo del huso de la papa (PSTV) toman el control de la maquinaria del huésped para replicar su genoma de ARN. A diferencia de los virus, los viroides no tienen una cubierta proteica para proteger su información genética.

Los viroides pueden resultar en pérdidas devastadoras de cultivos alimentarios agrícolas de importancia comercial cultivados en campos y huertos. Desde el descubrimiento del PSTV, se han descubierto otros viroides que causan enfermedades en las plantas. Tomate planta macho viroide (TPMvd) infecta plantas de tomate, lo que provoca pérdida de clorofila, hojas desfiguradas y quebradizas, y tomates muy pequeños, resultando en pérdida de productividad en este cultivo de campo. El viroide con manchas solares de aguacate (ASBVD) da como resultado menores rendimientos y frutos de mala calidad. El ASBvd es el viroide más pequeño descubierto hasta ahora que infecta a las plantas. El viroide de mosaico latente de durazno (PLMVD) puede causar necrosis de capullos y ramas florales, y herir el fruto maduro, lo que conduce al crecimiento de hongos y bacterias en el fruto. El PLMVD también puede causar cambios patológicos similares en ciruelas, nectarinas, albaricoques y cerezas, lo que resulta en una disminución de la productividad en estos huertos, también. Los viroides, en general, se pueden dispersar mecánicamente durante el mantenimiento o cosecha del cultivo, la reproducción vegetativa y posiblemente a través de semillas e insectos, resultando en una severa caída en la disponibilidad de alimentos y devastadoras consecuencias económicas.
Ejercicio\(\PageIndex{1}\)
¿De qué está hecho el genoma de un viroide?
Virusoides
Un segundo tipo de ARN patógeno que puede infectar cultivos agrícolas de importancia comercial son los virusoides, que son partículas subvirales mejor descritas como ARNss no autorreplicantes. La replicación del ARN de los virusoides es similar a la de los viroides pero, a diferencia de los viroides, los virusoides requieren que la célula también esté infectada con un virus “auxiliar” específico. Actualmente solo hay cinco tipos descritos de virusoides y sus virus auxiliares asociados. Los virus auxiliares son todos de la familia de los Sobemovirus. Un ejemplo de un virus auxiliar es el virus moteado del trébol subterráneo, que tiene un virusoide asociado empaquetado dentro de la cápside viral. Una vez que el virus auxiliar ingresa a la célula hospedadora, los virusoides se liberan y pueden encontrarse libres en el citoplasma de células vegetales, donde poseen actividad ribozima. El virus auxiliar experimenta una replicación viral típica independiente de la actividad del virusoide. Los genomas virusoides son pequeños, de solo 220 a 388 nucleótidos de longitud. Un genoma virusoide no codifica ninguna proteína, sino que solo sirve para replicar ARN virusoide.
Los virusoides pertenecen a un grupo mayor de agentes infecciosos llamados ARN satélite, que son ARN patógenos similares que se encuentran en animales. A diferencia de los virusoides vegetales, los ARN satélite pueden codificar proteínas; sin embargo, al igual que los virusoides vegetales, los ARN satélite deben coinfectar con un virus auxiliar para replicarse. Un ARN satélite que infecta a los humanos y que ha sido descrito por algunos científicos como virusoide es el virus de la hepatitis delta (HDV), que, según algunos informes, también se llama virusoide de hepatitis delta. Mucho más grande que un virusoide vegetal, el HDV tiene un genoma circular de ARNmc de 1,700 nucleótidos y puede dirigir la biosíntesis de proteínas asociadas a HDV. El virus auxiliar HDV es el virus de la hepatitis B (VHB). La coinfección con VHB y HDV resulta en cambios patológicos más severos en el hígado durante la infección, que es como se descubrió por primera vez el HDV.
Ejercicio\(\PageIndex{2}\)
¿Cuál es la principal diferencia entre un viroide y un virusoide?
Priones
En un momento, los científicos creyeron que cualquier partícula infecciosa debe contener ADN o ARN. Entonces, en 1982, Stanley Prusiner, médico que estudia la tembladera (una enfermedad fatal y degenerativa en ovejas) descubrió que la enfermedad era causada por partículas infecciosas proteínicas, o priones. Debido a que las proteínas son acelulares y no contienen ADN ni ARN, los hallazgos de Prusiner se encontraron originalmente con resistencia y escepticismo; sin embargo, su investigación finalmente fue validada, y recibió el Premio Nobel de Fisiología o Medicina en 1997.
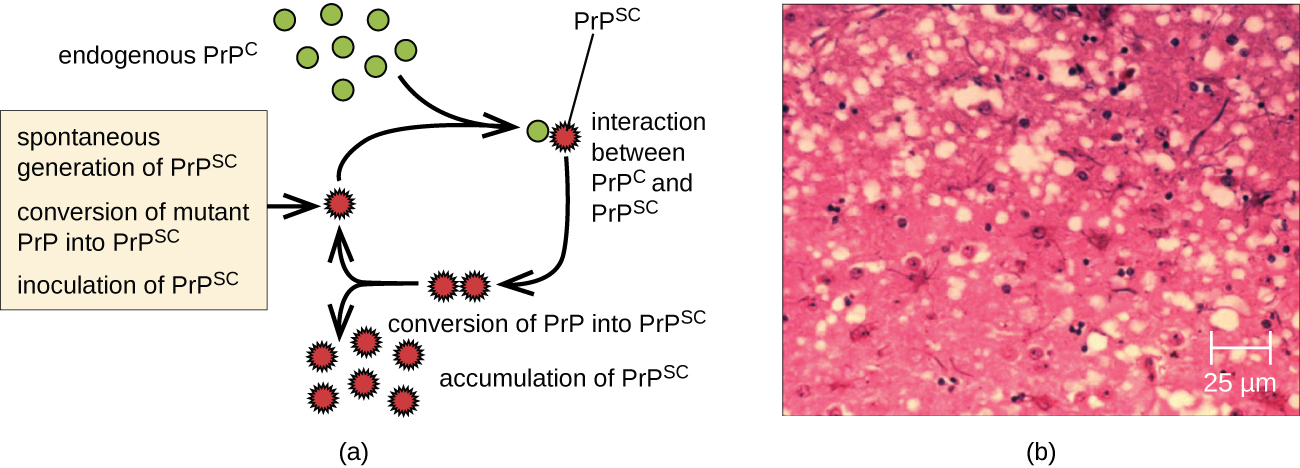
Un prión es una forma pícara mal plegada de una proteína normal (PrPC) que se encuentra en la célula. Esta proteína priónica pícara (PrPSc), que puede ser causada por una mutación genética o presentarse espontáneamente, puede ser infecciosa, estimulando que otras proteínas endógenas normales se vuelvan mal plegadas, formando placas (ver Figura\(\PageIndex{2}\)). Hoy en día, se sabe que los priones causan diversas formas de encefalopatía espongiforme transmisible (EET) en humanos y animales. La EET es un trastorno degenerativo poco frecuente que afecta el cerebro y el sistema nervioso. La acumulación de proteínas deshonestas hace que el tejido cerebral se vuelva similar a una esponja, matando las células cerebrales y formando agujeros en el tejido, lo que lleva a daño cerebral, pérdida de coordinación motora y demencia (ver Figura\(\PageIndex{3}\)). Los individuos infectados tienen discapacidad mental y se vuelven incapaces de moverse o hablar. No hay cura, y la enfermedad progresa rápidamente, conduciendo finalmente a la muerte en unos pocos meses o años.
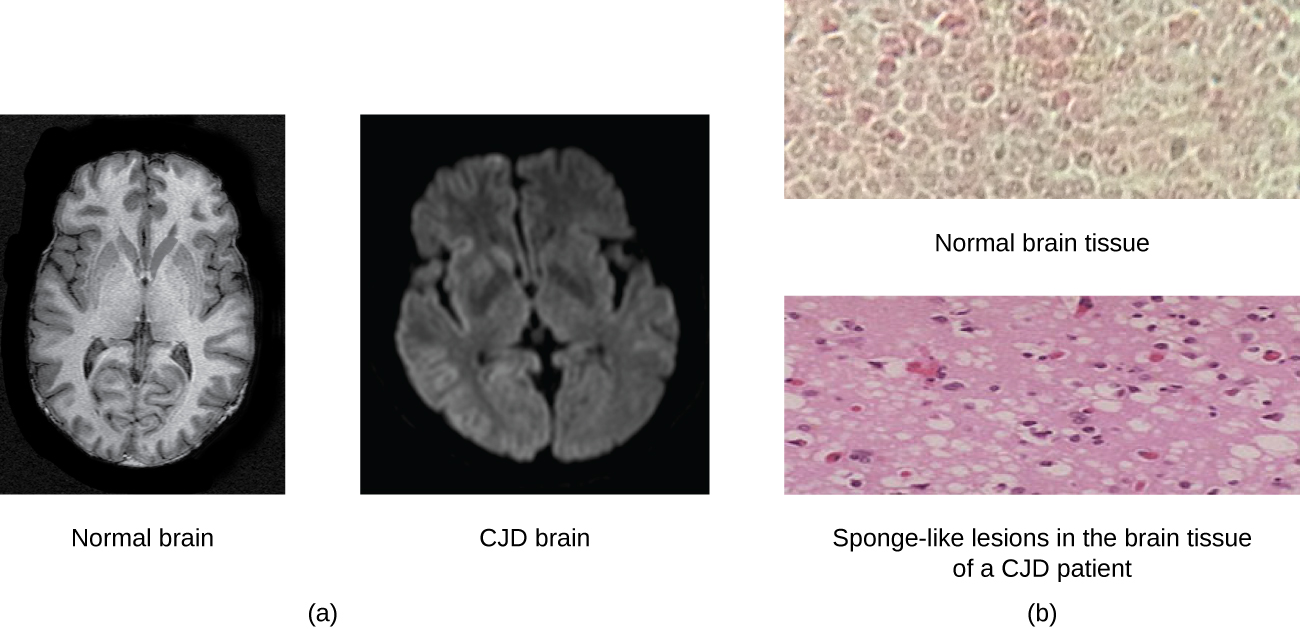
Las EET en humanos incluyen kuru, insomnio familiar fatal, enfermedad de Gerstmann-Straussler-Scheinker y enfermedad de Creutzfeldt-Jakob (ver Figura\(\PageIndex{3}\)). Las EET en animales incluyen la enfermedad de las vacas locas, la tembladera (en ovejas y cabras) y la enfermedad crónica de emaciación (en alces y venados). Las EET pueden transmitirse entre animales y de animales a humanos al comer carne contaminada o pienso para animales. La transmisión entre humanos puede ocurrir a través de la herencia (como suele ser el caso de GSS y ECJ) o por contacto con tejido contaminado, como podría ocurrir durante una transfusión de sangre o trasplante de órganos. No hay evidencia de transmisión vía contacto casual con una persona infectada. En la\(\PageIndex{1}\) tabla se enumeran las EET que afectan a los humanos y sus modos de transmisión.
| Enfermedad | Mecanismo (es) de Transmisión 1 |
|---|---|
| CJD esporádico (SCJD) | Desconocido; posiblemente por alteración de la proteína anterior normal (PrP) a forma pícara debido a mutación somática |
| Variante CJD (vCJD) | Comer productos bovinos contaminados y por transmisión secundaria de transmisión sanguínea |
| CJD Familiar (FCJD) | Mutación en el gen PrP de línea germinal |
| CJD iatrogénico (iCJD) | Instrumentos neuroquirúrgicos contaminados, injerto corneal, hormona gonadotrófica y, secundariamente, por transfusión de sangre |
| Kuru | Comer carne infectada a través del canibalismo ritual |
| Enfermedad de Gerstmann-Straussler-Scheinker (GSS) | Mutación en el gen PrP de línea germinal |
| Insomnio familiar fatal (FFI) | Mutación en el gen PrP de línea germinal |
Los priones son extremadamente difíciles de destruir porque son resistentes al calor, a los productos químicos y a la radiación. Incluso los procedimientos estándar de esterilización no aseguran la destrucción de estas partículas. Actualmente, no existe tratamiento o cura para la enfermedad de EET, y las carnes contaminadas o los animales infectados deben manejarse de acuerdo con las pautas federales para prevenir la transmisión.
Ejercicio\(\PageIndex{3}\)
¿Un prión tiene genoma?
Foco Clínico: Resolución
Unos días después, el médico de David recibe los resultados de la prueba de inmunofluorescencia en su muestra de piel. La prueba es negativa para el antígeno de la rabia. Una segunda prueba de antígeno viral en su muestra de saliva también le da negativo. A pesar de estos resultados, el médico decide continuar el curso actual de tratamiento de David. Ante la prueba de RT-PCR positiva, lo mejor es no descartar una posible infección por rabia.
Cerca del sitio de la picadura, David recibe una inyección de inmunoglobulina antirrábica, que se adhiere e inactiva cualquier virus de la rabia que pueda estar presente en sus tejidos. A lo largo de los siguientes 14 días, recibe una serie de cuatro vacunas específicas para la rabia en el brazo. Estas vacunas activan la respuesta inmune de David y ayudan a su cuerpo a reconocer y combatir el virus. Agradecidamente, con el tratamiento, los síntomas de David mejoran y se recupera por completo.
No todos los casos de rabia tienen un resultado tan afortunado. De hecho, la rabia suele ser mortal una vez que el paciente comienza a presentar síntomas, y los tratamientos postmordidos son principalmente paliativos (es decir, sedación y manejo del dolor).
Resumen
- Otros agentes acelulares como viroides, virusoides y priones también causan enfermedades. Los viroides consisten en ARNmc pequeños y desnudos que causan enfermedades en las plantas. Los virusoides son ARNmc que requieren otros virus auxiliares para establecer una infección. Los priones son partículas infecciosas proteínicas que causan encefalopatías espongiformes transmisibles.
- Los priones son extremadamente resistentes a los productos químicos, al calor y a la radiación.
- No hay tratamientos para la infección por priones.
Notas al pie
- 1 Instituto Nacional de Trastornos Neurológicos y Accidente Cerebrovascular. “Hoja informativa sobre la enfermedad de Creutzfeldt-Jakob”. http://www.ninds.nih.gov/disorders/cjd/detail_cjd.htm (consultado el 31 de diciembre de 2015).


