9.1: Cómo crecen los microbios
- Page ID
- 54922
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Definir el tiempo de generación para el crecimiento basado en la fisión binaria
- Identificar y describir las actividades de microorganismos sometidos a fases típicas de fisión binaria (división celular simple) en una curva de crecimiento
- Explicar varios métodos de laboratorio utilizados para determinar los recuentos celulares viables y totales en poblaciones en crecimiento exponencial
- Describir ejemplos de división celular que no implica fisión binaria, como gemación o fragmentación
- Describir la formación y características de las biopelículas
- Identificar los riesgos para la salud asociados con las biopelículas y cómo se abordan
- Describir la detección de quórum y su papel en la comunicación célula a célula y coordinación de actividades celulares
Jeni, una mujer embarazada de 24 años en su segundo trimestre, visita una clínica con quejas de fiebre alta, 38.9 °C (102 °F), fatiga y dolores musculares, signos y síntomas típicos similares a la gripe. Jeni hace ejercicio regularmente y sigue una dieta nutritiva con énfasis en los alimentos orgánicos, incluida la leche cruda que compra en un mercado local de agricultores. Todas sus vacunas están actualizadas. No obstante, el proveedor de salud que ve a Jeni está preocupado y ordena que el laboratorio de microbiología envíe una muestra de sangre para ser examinada.
Ejercicio\(\PageIndex{1}\)
¿Por qué el proveedor de salud está preocupado por los signos y síntomas de Jeni?
El ciclo celular bacteriano implica la formación de nuevas células a través de la replicación del ADN y la partición de los componentes celulares en dos células hijas. En los procariotas, la reproducción es siempre asexual, aunque se lleva a cabo una extensa recombinación genética en forma de transferencia genética horizontal, como se explorará en un capítulo diferente. La mayoría de las bacterias tienen un solo cromosoma circular; sin embargo, existen algunas excepciones. Por ejemplo, Borrelia burgdorferi, el agente causante de la enfermedad de Lyme, tiene un cromosoma lineal.
Fsión binaria
El mecanismo más común de replicación celular en bacterias es un proceso llamado fisión binaria, que se representa en la Figura\(\PageIndex{1}\):. Antes de dividirse, la célula crece y aumenta su número de componentes celulares. A continuación, la replicación del ADN comienza en una ubicación en el cromosoma circular llamada origen de replicación, donde el cromosoma se une a la membrana celular interna. La replicación continúa en direcciones opuestas a lo largo del cromosoma hasta que se alcanza el término.
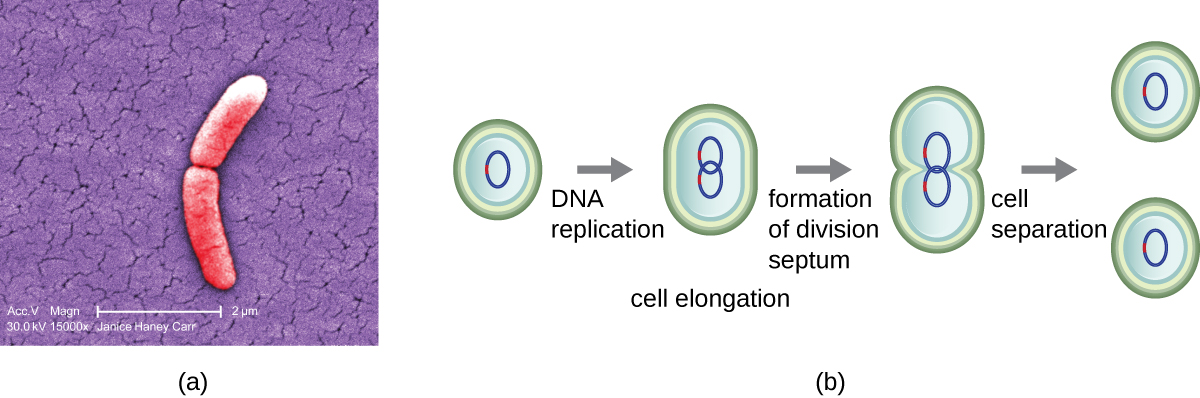
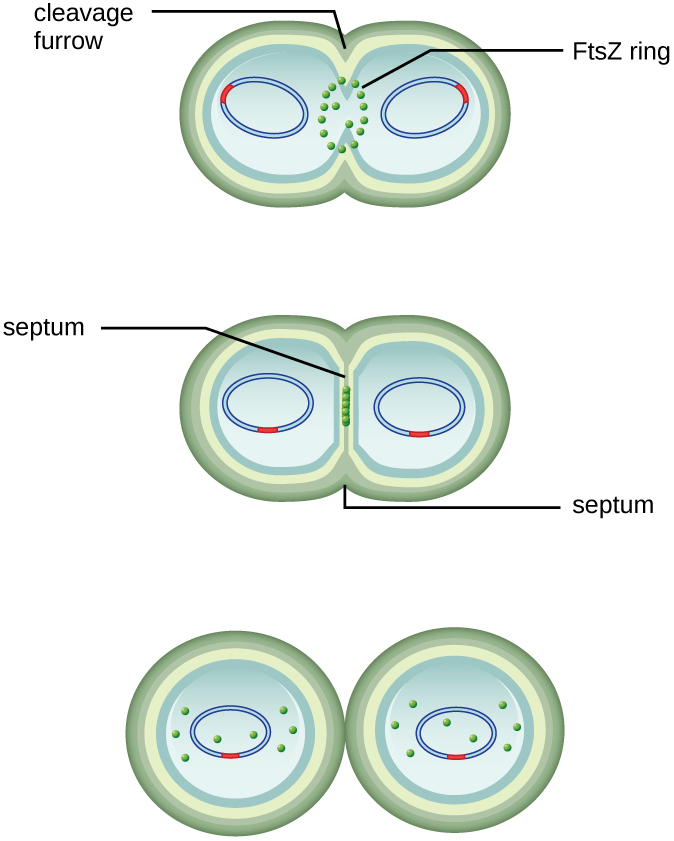
El centro de la célula agrandada se contrae hasta que se forman dos células hijas, recibiendo cada descendencia una copia completa del genoma parental y una división del citoplasma (citocinesis). Este proceso de citocinesis y división celular está dirigido por una proteína llamada FtsZ. FtsZ se ensambla en un anillo Z en la membrana citoplasmática (Figura\(\PageIndex{2}\)). El anillo Z está anclado por proteínas de unión a FTSZ y define el plano de división entre las dos células hijas. Las proteínas adicionales necesarias para la división celular se agregan al anillo Z para formar una estructura llamada divisoma. El divisoma se activa para producir una pared celular de peptidoglicano y construir un tabique que divide las dos células hijas. Las células hijas están separadas por el tabique de división, donde todas las capas externas de las células (la pared celular y las membranas externas, si están presentes) deben ser remodeladas para completar la división. Por ejemplo, sabemos que enzimas específicas rompen los enlaces entre los monómeros en peptidoglicanos y permiten la adición de nuevas subunidades a lo largo del tabique de división.
Ejercicio\(\PageIndex{2}\)
¿Cuál es el nombre de la proteína que se ensambla en un anillo Z para iniciar la citocinesis y la división celular?
Tiempo de Generación
En organismos eucariotas, el tiempo de generación es el tiempo entre los mismos puntos del ciclo de vida en dos generaciones sucesivas. Por ejemplo, el tiempo de generación típico para la población humana es de 25 años. Esta definición no es práctica para las bacterias, que pueden reproducirse rápidamente o permanecer latentes durante miles de años. En los procariotas (Bacterias y Archaea), el tiempo de generación también se llama tiempo de duplicación y se define como el tiempo que tarda la población en duplicarse a través de una ronda de fisión binaria. Los tiempos de duplicación bacteriana varían enormemente. Mientras que Escherichia coli puede duplicarse en tan solo 20 minutos bajo condiciones de crecimiento óptimas en el laboratorio, las bacterias de la misma especie pueden necesitar varios días para duplicarse en ambientes especialmente hostiles. La mayoría de los patógenos crecen rápidamente, como E. coli, pero hay excepciones. Por ejemplo, Mycobacterium tuberculosis, el agente causante de la tuberculosis, tiene un tiempo de generación de entre 15 y 20 horas. Por otro lado, M. leprae, que causa la enfermedad de Hansen (lepra), crece mucho más lentamente, con un tiempo de duplicación de 14 días.
Cálculo del número de celdas
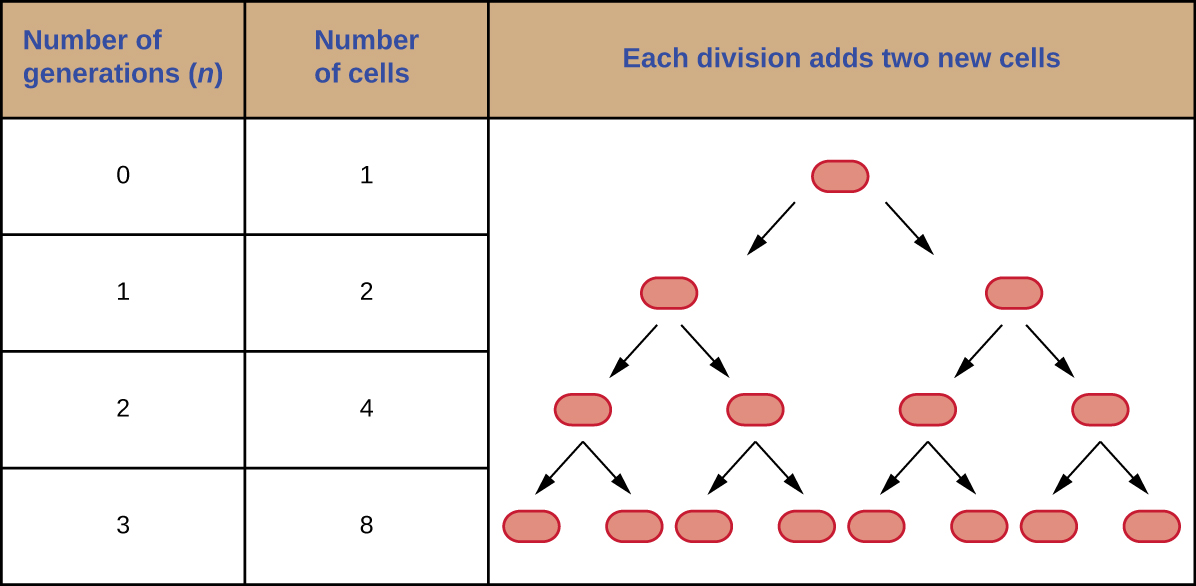
Es posible predecir el número de células en una población cuando se dividen por fisión binaria a un ritmo constante. Como ejemplo, considere lo que sucede si una sola celda se divide cada 30 minutos durante 24 horas. El diagrama de la Figura\(\PageIndex{3}\) muestra el incremento en el número de células para las tres primeras generaciones.
El número de células aumenta exponencialmente y se puede expresar como 2 n, donde n es el número de generaciones. Si las células se dividen cada 30 minutos, después de 24 horas, habrían tenido lugar 48 divisiones. Si aplicamos la fórmula 2 n, donde n es igual a 48, la célula única daría lugar a 2 48 o 281,474,976,710,656 células a 48 generaciones (24 horas). Cuando se trata de números tan enormes, es más práctico utilizar la notación científica. Por lo tanto, expresamos el número de celdas como 2.8 × 10 14 celdas.
En nuestro ejemplo, usamos una celda como número inicial de celdas. Para cualquier número de celdas de partida, la fórmula se adapta de la siguiente manera:
\[N_n = N_02^n\]
N n es el número de celdas en cualquier generación n, N 0 es el número inicial de celdas y n es el número de generaciones.
Ejercicio\(\PageIndex{3}\)
Con un tiempo de duplicación de 30 minutos y un tamaño de población inicial de 1 × 10 5 células, ¿cuántas células estarán presentes después de 2 horas, suponiendo que no haya muerte celular?
La curva de crecimiento
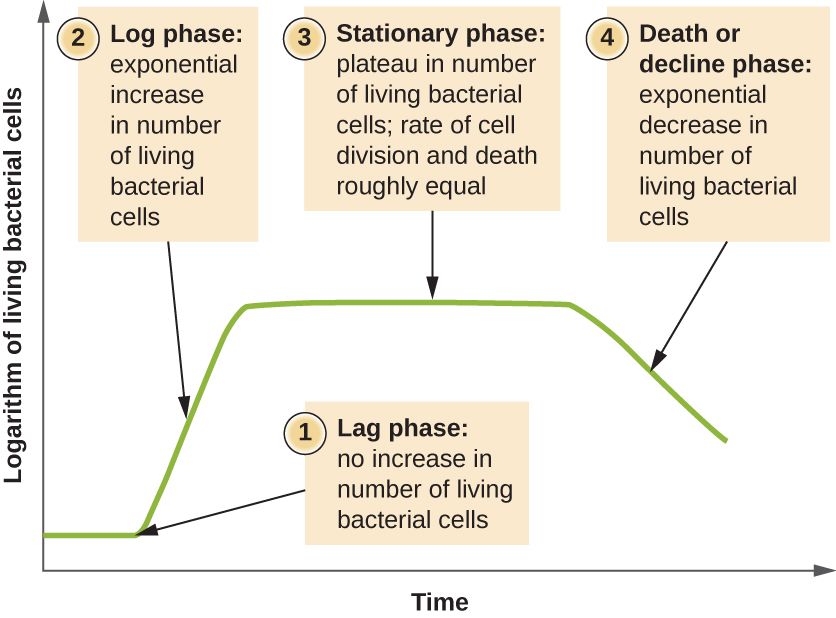
Los microorganismos cultivados en cultivo cerrado (también conocido como cultivo discontinuo), en los que no se agregan nutrientes y la mayoría de los desechos no se eliminan, siguen un patrón de crecimiento reproducible denominado curva de crecimiento. Un ejemplo de un cultivo discontinuo en la naturaleza es un estanque en el que un pequeño número de células crecen en un ambiente cerrado. La densidad de cultivo se define como el número de células por unidad de volumen. En un ambiente cerrado, la densidad de cultivo es también una medida del número de células en la población. Las infecciones del cuerpo no siempre siguen la curva de crecimiento, pero pueden existir correlaciones dependiendo del sitio y tipo de infección. Cuando se representa el número de células vivas frente al tiempo, se pueden observar distintas fases en la curva (Figura\(\PageIndex{4}\)).
La Fase de Retraso
El inicio de la curva de crecimiento representa un pequeño número de células, denominadas inóculo, que se agregan a un medio de cultivo fresco, un caldo nutricional que apoya el crecimiento. La fase inicial de la curva de crecimiento se denomina fase de retraso, durante la cual las células se están preparando para la siguiente fase de crecimiento. El número de células no cambia durante la fase de retraso; sin embargo, las células crecen y son metabólicamente activas, sintetizando proteínas necesarias para crecer dentro del medio. Si alguna célula fue dañada o impactada durante la transferencia al nuevo medio, la reparación se lleva a cabo durante la fase de retraso. La duración de la fase de retraso está determinada por muchos factores, incluyendo la especie y composición genética de las células, la composición del medio y el tamaño del inóculo original.
La Fase Log
En la fase de crecimiento logarítmico (logarítmico), a veces llamada fase de crecimiento exponencial, las células se dividen activamente por fisión binaria y su número aumenta exponencialmente. Para cualquier especie bacteriana dada, el tiempo de generación bajo condiciones de crecimiento específicas (nutrientes, temperatura, pH, etc.) se determina genéticamente, y este tiempo de generación se denomina tasa de crecimiento intrínseco. Durante la fase logarítmica, la relación entre el tiempo y el número de celdas no es lineal sino exponencial; sin embargo, la curva de crecimiento a menudo se grafica en una gráfica semilogarítmica, como se muestra en la Figura\(\PageIndex{5}\), lo que da la apariencia de una relación lineal.
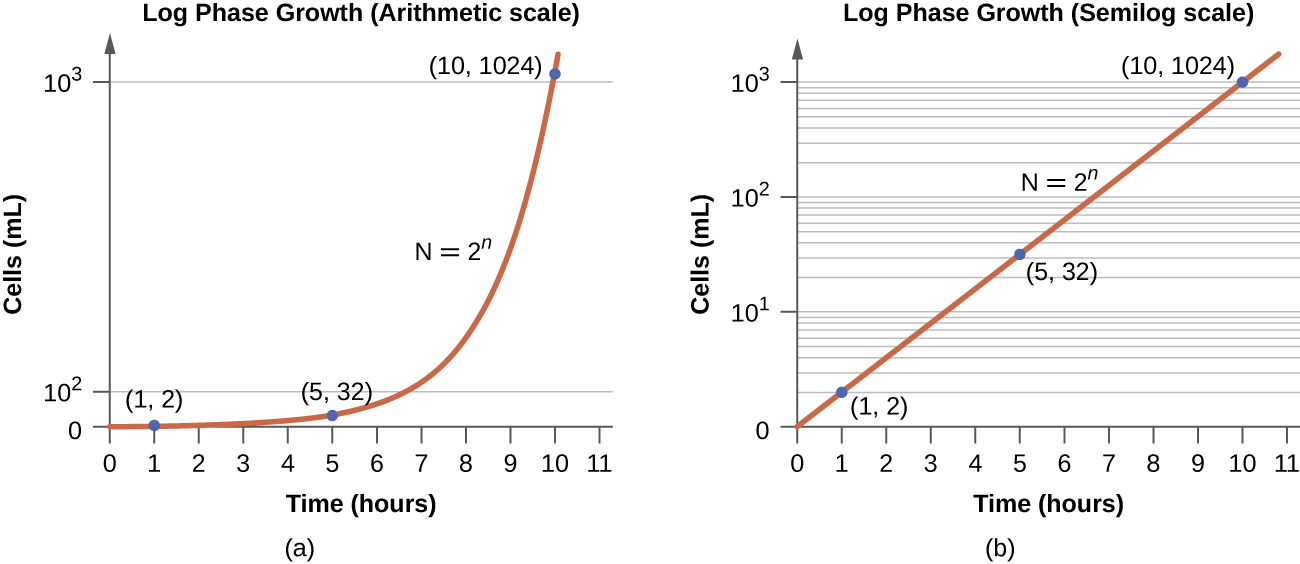
Las células en fase logarítmica muestran tasa de crecimiento constante y actividad metabólica uniforme. Por esta razón, las células en fase logarítmica se utilizan preferentemente para aplicaciones industriales y trabajos de investigación. La fase logarítmica es también la etapa donde las bacterias son las más susceptibles a la acción de desinfectantes y antibióticos comunes que afectan la síntesis de proteínas, ADN y pared celular.
Fase Estacionaria
A medida que el número de células aumenta a través de la fase logarítmica, varios factores contribuyen a una desaceleración de la tasa de crecimiento. Los productos de desecho se acumulan y los nutrientes se agotan gradualmente. Además, el agotamiento gradual del oxígeno comienza a limitar el crecimiento celular aeróbico. Esta combinación de condiciones desfavorables frena y finalmente frena el crecimiento poblacional. El número total de células vivas alcanza una meseta denominada fase estacionaria (Figura\(\PageIndex{4}\)). En esta fase, el número de nuevas células creadas por la división celular es ahora equivalente al número de células que mueren; así, la población total de células vivas está relativamente estancada. La densidad de cultivo en un cultivo estacionario es constante. La capacidad de carga del cultivo, o densidad máxima de cultivo, depende de los tipos de microorganismos en el cultivo y de las condiciones específicas del cultivo; sin embargo, la capacidad de carga es constante para un organismo determinado cultivado en las mismas condiciones.
Durante la fase estacionaria, las células cambian a un modo de supervivencia del metabolismo. A medida que el crecimiento se ralentiza, también lo hace la síntesis de peptidoglicanos, proteínas y ácidos nucleicos; así, los cultivos estacionarios son menos susceptibles a los antibióticos que interrumpen estos procesos. En bacterias capaces de producir endosporas, muchas células se someten a esporulación durante la fase estacionaria. Los metabolitos secundarios, incluidos los antibióticos, se sintetizan en la fase estacionaria. En ciertas bacterias patógenas, la fase estacionaria también se asocia con la expresión de factores de virulencia, productos que contribuyen a la capacidad de un microbio para sobrevivir, reproducirse y causar enfermedades en un organismo huésped. Por ejemplo, la detección de quórum en Staphylococcus aureus inicia la producción de enzimas que pueden descomponer el tejido humano y los desechos celulares, despejando el camino para que las bacterias se propaguen a nuevos tejidos donde los nutrientes son más abundantes.
La fase de la muerte
A medida que un medio de cultivo acumula desechos tóxicos y se agotan los nutrientes, las células mueren en mayor y mayor número. Pronto, el número de células moribundas supera el número de células en división, lo que lleva a una disminución exponencial en el número de células (Figura\(\PageIndex{4}\)). Esta es la fase de muerte acertadamente llamada, a veces llamada fase de declive. Muchas células lisan y liberan nutrientes en el medio, permitiendo que las células supervivientes mantengan la viabilidad y formen endosporas. Algunas células, las llamadas persistentes, se caracterizan por una tasa metabólica lenta. Las células persistentes son médicamente importantes porque están asociadas con ciertas infecciones crónicas, como la tuberculosis, que no responden al tratamiento antibiótico.
Sosteniendo el crecimiento microbiano
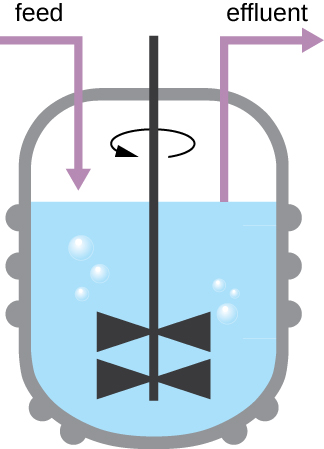
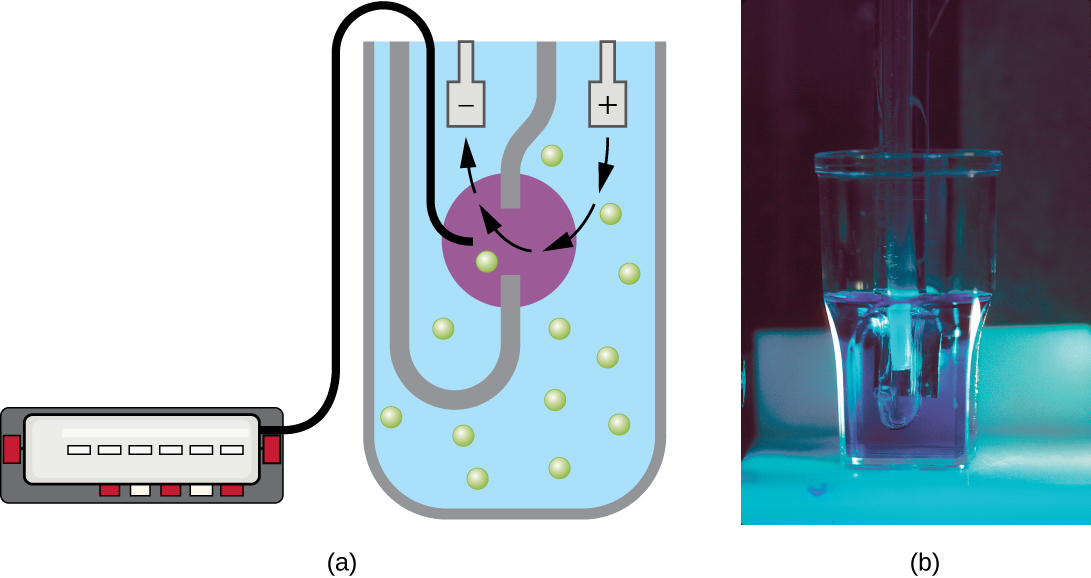
El patrón de crecimiento mostrado en la Figura\(\PageIndex{4}\) tiene lugar en un ambiente cerrado; no se agregan nutrientes y no se eliminan los desechos y las células muertas. En muchos casos, sin embargo, es ventajoso mantener las células en la fase logarítmica de crecimiento. Un ejemplo es en industrias que cosechan productos microbianos. Se utiliza un quimiostato (Figura\(\PageIndex{6}\)) para mantener un cultivo continuo en el que los nutrientes se suministran a una tasa constante. Se mezcla una cantidad controlada de aire para procesos aeróbicos. La suspensión bacteriana se elimina a la misma velocidad que los nutrientes fluyen para mantener un ambiente de crecimiento óptimo.
Ejercicio\(\PageIndex{4}\)
- ¿Durante qué fase se produce el crecimiento al ritmo más rápido?
- Nombrar dos factores que limiten el crecimiento microbiano.
Medición del crecimiento bacteriano
Estimar el número de células bacterianas en una muestra, conocido como recuento bacteriano, es una tarea común que realizan los microbiólogos. El número de bacterias en una muestra clínica sirve como indicación de la extensión de una infección. El control de calidad del agua potable, los alimentos, los medicamentos e incluso los cosméticos se basa en estimaciones de recuentos bacterianos para detectar contaminación y prevenir la propagación de enfermedades. Se utilizan dos enfoques principales para medir el número de celdas. Los métodos directos implican contar células, mientras que los métodos indirectos dependen de la medición de la presencia o actividad celular sin contar realmente células individuales. Tanto los métodos directos como los indirectos tienen ventajas y desventajas para aplicaciones específicas.
Recuento directo de células
El recuento directo de células se refiere al recuento de las células en un cultivo líquido o colonias en una placa. Es una forma directa de estimar cuántos organismos están presentes en una muestra. Veamos primero un método simple y rápido que requiere solo un portaobjetos especializado y un microscopio compuesto.
La forma más sencilla de contar bacterias se llama recuento celular microscópico directo, que implica transferir un volumen conocido de un cultivo a un portaobjetos calibrado y contar las células bajo un microscopio óptico. El portaobjetos calibrado se denomina cámara Petroff-Hausser (Figura\(\PageIndex{7}\)) y es similar a un hemocitómetro utilizado para contar glóbulos rojos. El área central de la cámara de conteo está grabada en cuadrados de varios tamaños. Se agrega una muestra de la suspensión de cultivo a la cámara bajo un cubreobjetos que se coloca a una altura específica de la superficie de la rejilla. Es posible estimar la concentración de células en la muestra original contando células individuales en varios cuadrados y determinando el volumen de la muestra observada. El área de los cuadrados y la altura a la que se coloca el cubreobjetos se especifican para la cámara. La concentración debe corregirse para la dilución si la muestra se diluyó antes de la enumeración.
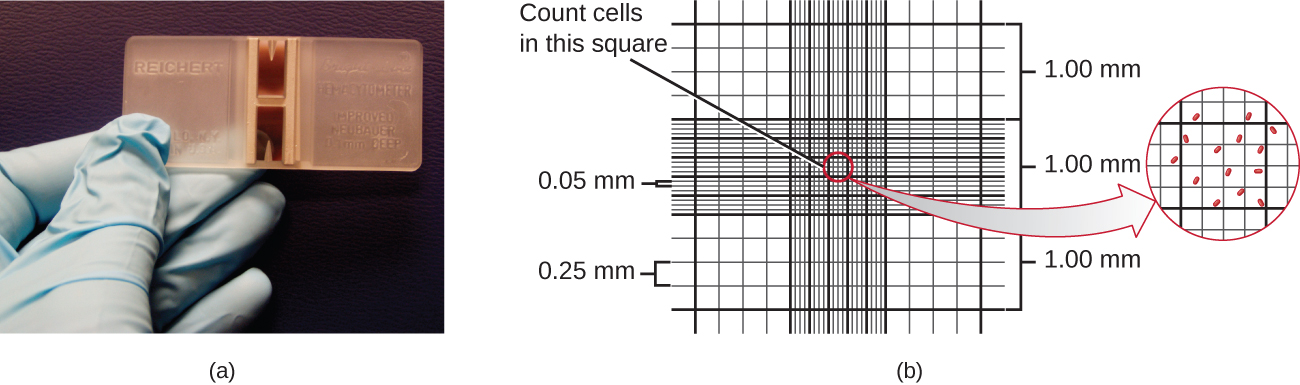
Las células en varios cuadrados pequeños deben ser contadas y tomar el promedio para obtener una medición confiable. Las ventajas de la cámara son que el método es fácil de usar, relativamente rápido y económico. A la baja, la cámara de conteo no funciona bien con cultivos diluidos porque puede que no haya suficientes células para contar.
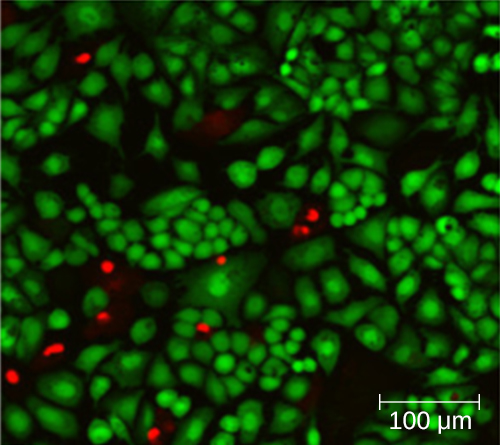
El uso de una cámara de conteo no necesariamente produce un recuento preciso del número de células vivas porque no siempre es posible distinguir entre células vivas, células muertas y desechos del mismo tamaño bajo el microscopio. Sin embargo, las técnicas de tinción de fluorescencia recientemente desarrolladas permiten distinguir bacterias viables y muertas. Estas manchas de viabilidad (o tinciones vivas) se unen a ácidos nucleicos, pero las tinciones primarias y secundarias difieren en su capacidad para cruzar la membrana citoplásmica. La tinción primaria, que fluoresce verde, puede penetrar membranas citoplásmicas intactas, tiñendo tanto células vivas como muertas. La tinción secundaria, que fluoresce en rojo, puede teñir una célula solo si la membrana citoplásmica está considerablemente dañada. Así, las células vivas fluorescen en verde porque solo absorben la mancha verde, mientras que las células muertas aparecen rojas porque la mancha roja desplaza la mancha verde sobre sus ácidos nucleicos (Figura\(\PageIndex{8}\)).
Otra técnica utiliza un dispositivo electrónico de conteo celular (contador Coulter) para detectar y contar los cambios en la resistencia eléctrica en una solución salina. Un tubo de vidrio con una pequeña abertura se sumerge en una solución electrolítica. Un primer electrodo se suspende en el tubo de vidrio. Un segundo electrodo se encuentra fuera del tubo. A medida que las células son aspiradas a través de la pequeña abertura en el tubo de vidrio, cambian brevemente la resistencia medida entre los dos electrodos y el cambio es registrado por un sensor electrónico (Figura\(\PageIndex{9}\)); cada cambio de resistencia representa una celda. El método es rápido y preciso dentro de un rango de concentraciones; sin embargo, si el cultivo está demasiado concentrado, más de una célula puede pasar por la abertura en un momento dado y sesgar los resultados. Este método tampoco diferencia entre células vivas y muertas.
Los recuentos directos proporcionan una estimación del número total de células en una muestra. No obstante, en muchas situaciones, es importante conocer el número de células vivas o viables. Los recuentos de células vivas son necesarios para evaluar la extensión de una infección, la efectividad de los compuestos antimicrobianos y medicamentos, o la contaminación de alimentos y agua.
Ejercicio\(\PageIndex{5}\)
- ¿Por qué contaría el número de celdas en más de un cuadrado en la cámara Petroff-Hausser para estimar los números de celdas?
- En el método de tinción de viabilidad, ¿por qué las células muertas aparecen rojas?
Recuento de Placas
El recuento de placas viables, o simplemente el recuento de placas, es un recuento de células viables o vivas. Se basa en el principio de que las células viables se replican y dan lugar a colonias visibles cuando se incuban en condiciones adecuadas para el espécimen. Los resultados generalmente se expresan como unidades formadoras de colonias por mililitro (UFC/ml) en lugar de células por mililitro porque más de una célula puede haber aterrizado en el mismo lugar para dar lugar a una sola colonia. Además, las muestras de bacterias que crecen en racimos o cadenas son difíciles de dispersar y una sola colonia puede representar varias células. Algunas células se describen como viables pero no cultivables y no formarán colonias en medios sólidos. Por todas estas razones, el recuento de placas viables se considera una estimación baja del número real de células vivas. Estas limitaciones no restan valor a la utilidad del método, que proporciona estimaciones del número de bacterias vivas.
Los microbiólogos suelen contar placas con 30-300 colonias. Las muestras con muy pocas colonias (300 <30) do not give statistically reliable numbers, and overcrowded plates (> colonias) dificultan el recuento preciso de colonias individuales. Además, los recuentos en este rango minimizan la aparición de más de una célula bacteriana formando una sola colonia. Así, la UFC calculada está más cerca del número real de bacterias vivas en la población.
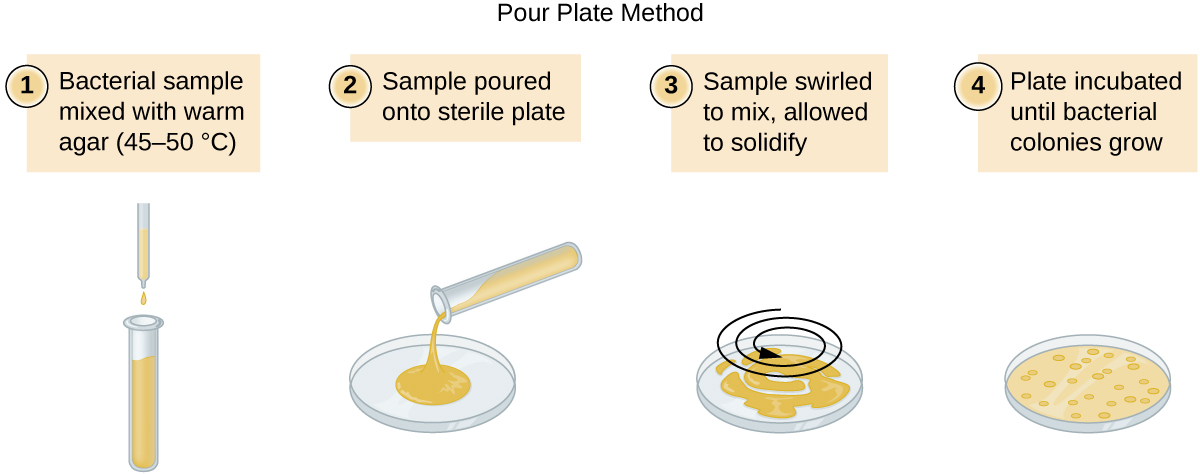
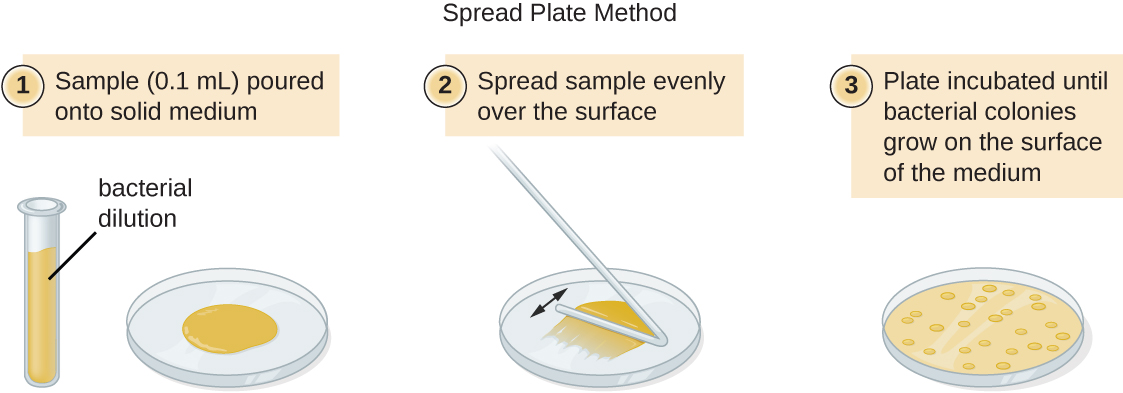
Existen dos enfoques comunes para inocular placas para recuentos viables: la placa de vertido y la placa de extensión. Aunque el procedimiento de inoculación final difiere entre estos dos métodos, ambos comienzan con una dilución en serie del cultivo.
Dilución en serie
La dilución en serie de un cultivo es un primer paso importante antes de proceder al método de la placa de vertido o de la placa de extensión. El objetivo del proceso de dilución en serie es obtener placas con CFU en el rango de 30—300, y el proceso generalmente implica varias diluciones en múltiplos de 10 para simplificar el cálculo. El número de diluciones seriadas se elige de acuerdo con una estimación preliminar de la densidad de cultivo. La figura\(\PageIndex{10}\) ilustra el método de dilución en serie.
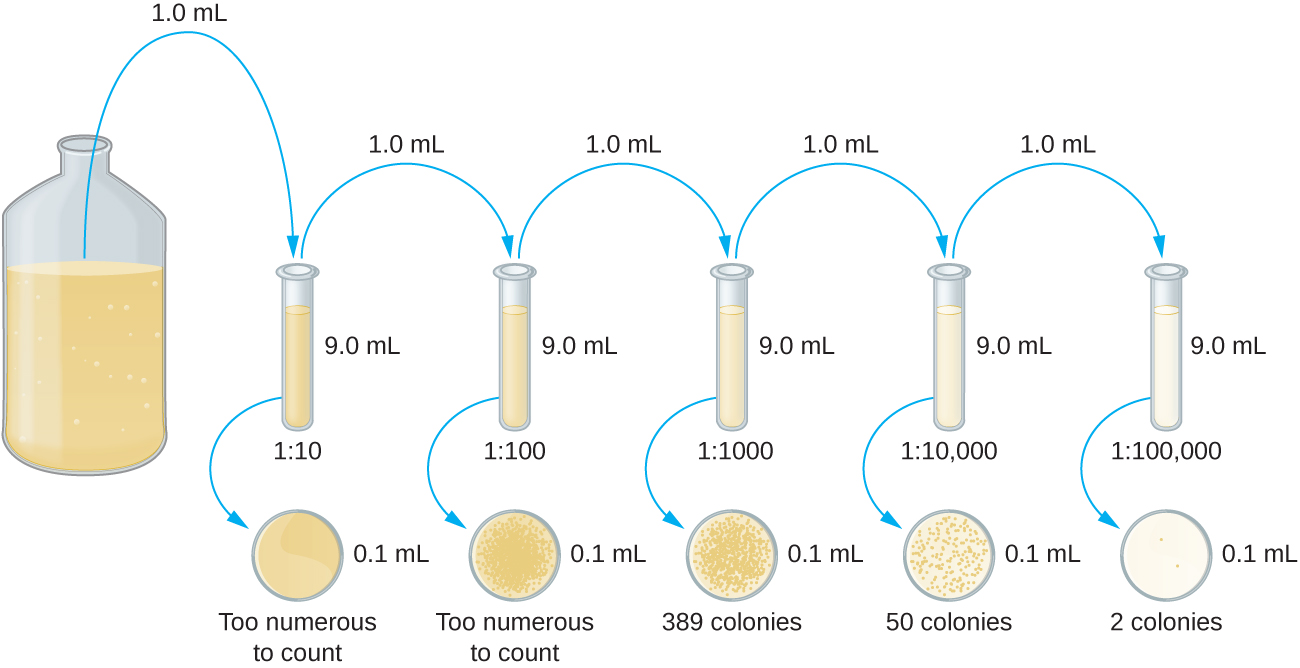
Se agrega un volumen fijo del cultivo original, 1.0 mL, y se mezcla a fondo con la primera solución de tubo de dilución, que contiene 9.0 mL de caldo estéril. Este paso representa un factor de dilución de 10, o 1:10, en comparación con el cultivo original. De esta primera dilución, se retira el mismo volumen, 1.0 mL, y se mezcla con un tubo fresco de 9.0 mL de solución de dilución. El factor de dilución es ahora de 1:100 en comparación con el cultivo original. Este proceso continúa hasta que se produce una serie de diluciones que abarcarán la concentración celular deseada para un conteo preciso. De cada tubo, se siembra una muestra sobre medio sólido utilizando el método de la placa de vertido (Figura\(\PageIndex{11}\)) o el método de la placa de extensión (Figura\(\PageIndex{12}\)). Las placas se incuban hasta que aparecen las colonias. Generalmente se preparan de dos a tres placas a partir de cada dilución y se promedian los números de colonias contadas en cada placa. En todos los casos, la mezcla minuciosa de las muestras con el medio de dilución (para asegurar que la distribución celular en el tubo sea aleatoria) es primordial para obtener resultados confiables.
El factor de dilución se utiliza para calcular el número de células en el cultivo celular original. En nuestro ejemplo, se contó un promedio de 50 colonias en las placas obtenidas de la dilución 1:10 ,000. Debido a que solo se pipeteó 0.1 mL de suspensión en la placa, el multiplicador requerido para reconstituir la concentración original es de 10 × 10,000. El número de UFC por mL es igual a 50 × 100 × 10,000 = 5,000,000. El número de bacterias en el cultivo se estima en 5 millones de células/ml. El recuento de colonias obtenido de la dilución 1:1000 fue de 389, muy por debajo de los 500 esperados para una diferencia de 10 veces en las diluciones. Esto resalta el tema de la inexactitud cuando los recuentos de colonias son mayores a 300 y más de una célula bacteriana crece en una sola colonia.
Una muestra muy diluida —agua potable, por ejemplo— puede no contener suficientes organismos para utilizar ninguno de los métodos de conteo en placa descritos. En tales casos, la muestra original debe concentrarse en lugar de diluirse antes de sembrar. Esto se puede lograr usando una modificación de la técnica de conteo de placas llamada técnica de filtración por membrana. Los volúmenes conocidos se filtran asépticamente al vacío a través de una membrana con un tamaño de poro lo suficientemente pequeño como para atrapar microorganismos. La membrana se transfiere a una placa Petri que contiene un medio de crecimiento apropiado. Las colonias se cuentan después de la incubación. El cálculo de la densidad celular se realiza dividiendo el recuento celular por el volumen de líquido filtrado.
Vea este video para ver demostraciones de diluciones en serie y técnicas de placas extendidas.
El número más probable
El número de microorganismos en muestras diluidas suele ser demasiado bajo para ser detectado por los métodos de recuento en placa descritos hasta ahora. Para estos especímenes, los microbiólogos utilizan rutinariamente el método del número más probable (MPN), un procedimiento estadístico para estimar el número de microorganismos viables en una muestra. A menudo utilizado para muestras de agua y alimentos, el método MPN evalúa el crecimiento detectable al observar cambios en la turbidez o color debido a la actividad metabólica.
Una aplicación típica del método MPN es la estimación del número de coliformes en una muestra de agua de estanque. Los coliformes son bacterias gramnegativas de varilla que fermentan la lactosa. La presencia de coliformes en el agua se considera un signo de contaminación por materia fecal. Para el método ilustrado en la Figura\(\PageIndex{13}\), se prueba una serie de tres diluciones de la muestra de agua inoculando cinco tubos de caldo de lactosa con 10 mL de muestra, cinco tubos de caldo de lactosa con 1 mL de muestra y cinco tubos de caldo de lactosa con 0.1 mL de muestra. Los tubos de caldo de lactosa contienen un indicador de pH que cambia de color de rojo a amarillo cuando se fermenta la lactosa. Después de la inoculación e incubación, los tubos se examinan para detectar una indicación de crecimiento coliforme por un cambio de color en el medio de rojo a amarillo. El primer conjunto de tubos (muestra de 10 mL) mostró crecimiento en todos los tubos; el segundo conjunto de tubos (1 mL) mostró crecimiento en dos tubos de cinco; en el tercer conjunto de tubos, no se observa crecimiento en ninguno de los tubos (dilución de 0.1-mL). Los números 5, 2 y 0 se comparan con la Figura B1 del Apéndice B, que se ha construido utilizando un modelo de probabilidad del procedimiento de muestreo. De nuestra lectura de la tabla, concluimos que 49 es el número más probable de bacterias por cada 100 mL de agua de estanque.
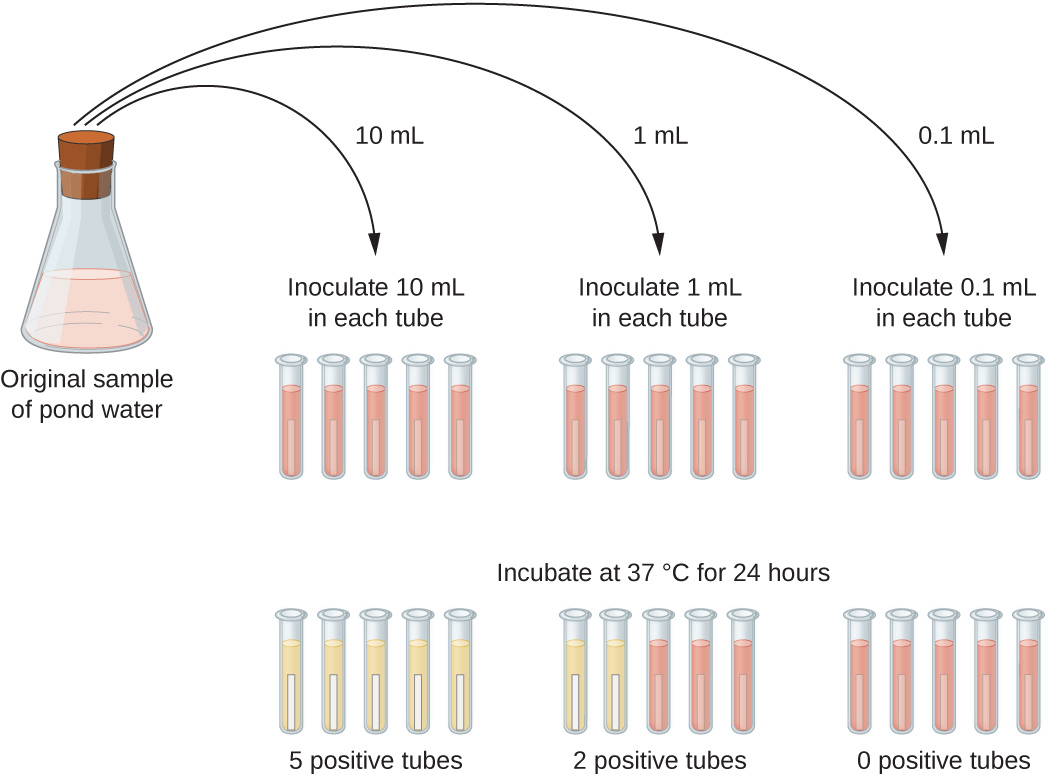
Ejercicio\(\PageIndex{6}\)
- ¿Qué es una unidad formadora de colonias?
- ¿Qué dos métodos se utilizan con frecuencia para estimar el número de bacterias en muestras de agua?
Recuentos indirectos de celdas
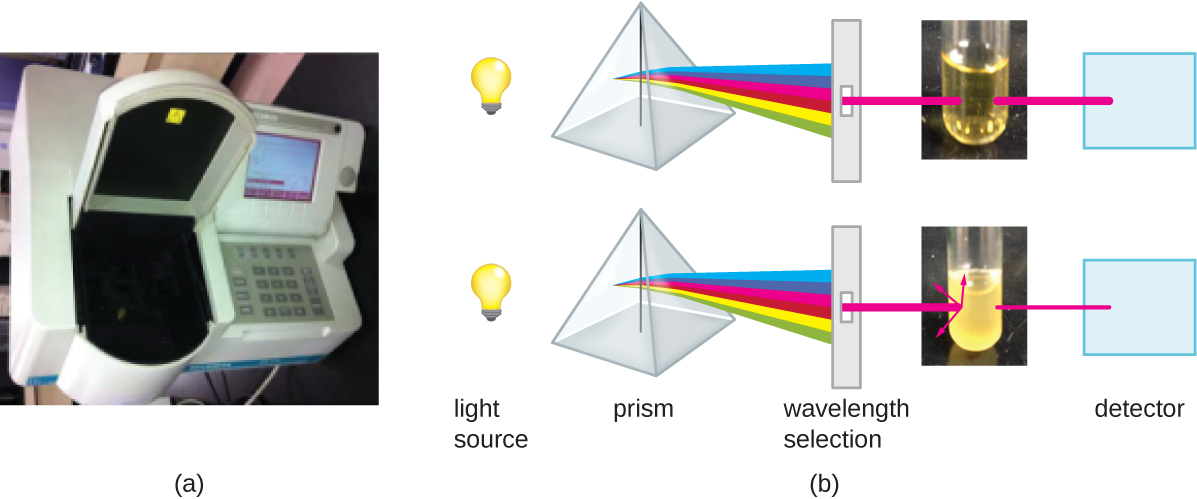
Además de los métodos directos de conteo de células, otros métodos, basados en una detección indirecta de la densidad celular, se utilizan comúnmente para estimar y comparar densidades celulares en un cultivo. El enfoque más importante es medir la turbidez (turbidez) de una muestra de bacterias en una suspensión líquida. El instrumento de laboratorio utilizado para medir la turbidez se denomina espectrofotómetro (Figura\(\PageIndex{14}\)). En un espectrofotómetro, un haz de luz se transmite a través de una suspensión bacteriana, la luz que pasa a través de la suspensión es medida por un detector, y la cantidad de luz que pasa a través de la muestra y llega al detector se convierte en porcentaje de transmisión o un valor logarítmico llamado absorbancia (densidad óptica). A medida que aumenta el número de bacterias en una suspensión, la turbidez también aumenta y hace que menos luz llegue al detector. La disminución de la luz que pasa a través de la muestra y llega al detector se asocia con una disminución en el porcentaje de transmisión y aumento en la absorbancia medida por el espectrofotómetro.
La medición de la turbidez es un método rápido para estimar la densidad celular siempre que haya suficientes células en una muestra para producir turbidez. Es posible correlacionar las lecturas de turbidez con el número real de células realizando un recuento en placa viable de muestras tomadas de cultivos que tienen un rango de valores de absorbancia. Usando estos valores, se genera una curva de calibración trazando la turbidez en función de la densidad celular. Una vez producida la curva de calibración, se puede utilizar para estimar los recuentos celulares de todas las muestras obtenidas o cultivadas en condiciones similares y con densidades dentro del rango de valores utilizados para construir la curva.
La medición del peso seco de una muestra de cultivo es otro método indirecto para evaluar la densidad de cultivo sin medir directamente los recuentos celulares. La suspensión celular utilizada para el pesaje debe concentrarse por filtración o centrifugación, lavarse y luego secarse antes de tomar las medidas. El grado de secado debe ser estandarizado para tener en cuenta el contenido de agua residual. Este método es especialmente útil para microorganismos filamentosos, que son difíciles de enumerar por recuento directo o viable en placas.
Como hemos visto, los métodos para estimar el número de células viables pueden ser intensivos en mano de obra y llevar tiempo porque las células deben cultivarse. Recientemente, se han desarrollado formas indirectas de medir células vivas que son rápidas y fáciles de implementar. Estos métodos miden la actividad celular siguiendo la producción de productos metabólicos o la desaparición de los reactivos. La formación de trifosfato de adenosina (ATP), la biosíntesis de proteínas y ácidos nucleicos y el consumo de oxígeno se pueden monitorear para estimar el número de células.
Ejercicio\(\PageIndex{7}\)
- ¿Cuál es el propósito de una curva de calibración al estimar el recuento de células a partir de mediciones de turbidez?
- ¿Cuáles son los métodos indirectos más nuevos para contar células vivas?
Patrones alternativos de división celular
La fisión binaria es el patrón más común de división celular en procariotas, pero no es el único. Otros mecanismos suelen implicar división asimétrica (como en gemación) o producción de esporas en filamentos aéreos.
En algunas cianobacterias, muchos nucleoides pueden acumularse en una célula redonda agrandada o a lo largo de un filamento, lo que lleva a la generación de muchas células nuevas a la vez. Las nuevas celdas a menudo se separan del filamento padre y flotan en un proceso llamado fragmentación (Figura\(\PageIndex{15}\)). La fragmentación se observa comúnmente en los Actinomicetos, un grupo de bacterias grampositivas, anaerobias que se encuentran comúnmente en el suelo. Otro curioso ejemplo de división celular en procariotas, que recuerda al nacimiento vivo en animales, es exhibido por la bacteria gigante Epulopiscium. Varias células hijas crecen completamente en la célula parental, que eventualmente se desintegra, liberando las nuevas células al ambiente. Otras especies pueden formar una extensión larga y estrecha en un polo en un proceso llamado gemación. La punta de la extensión se hincha y forma una célula más pequeña, la yema que finalmente se desprende de la célula madre. La brotación es más común en levaduras (Figura\(\PageIndex{15}\)), pero también se observa en bacterias prostecadas y algunas cianobacterias.

Las bacterias del suelo Actinomyces crecen en filamentos largos divididos por septos, similares a los micelios observados en los hongos, dando como resultado células largas con múltiples nucleoides. Las señales ambientales, probablemente relacionadas con la baja disponibilidad de nutrientes, conducen a la formación de filamentos aéreos. Dentro de estos filamentos aéreos, las células alargadas se dividen simultáneamente. Las nuevas células, que contienen un solo nucleoide, se desarrollan en esporas que dan lugar a nuevas colonias.
Ejercicio\(\PageIndex{8}\)
Identificar al menos una diferencia entre fragmentación y gemación.
Biofilms
En la naturaleza, los microorganismos crecen principalmente en biopelículas, ecosistemas complejos y dinámicos que se forman en una variedad de superficies ambientales, desde conductos industriales y tuberías de tratamiento de agua hasta rocas en lechos de ríos. Sin embargo, las biopelículas no están restringidas a sustratos superficiales sólidos. Casi cualquier superficie en un ambiente líquido que contenga algunos nutrientes mínimos eventualmente desarrollará una biopelícula. Las colchonetas microbianas que flotan en el agua, por ejemplo, son biopelículas que contienen grandes poblaciones de microorganismos fotosintéticos. Las biopelículas que se encuentran en la boca humana pueden contener cientos de especies bacterianas. Independientemente del ambiente donde ocurran, las biopelículas no son colecciones aleatorias de microorganismos; más bien, son comunidades altamente estructuradas que proporcionan una ventaja selectiva a sus microorganismos constituyentes.
Estructura de Biofilm
Las observaciones mediante microscopía confocal han demostrado que las condiciones ambientales influyen en la estructura general de las biopelículas. Las biopelículas filamentosas llamadas serpentinas se forman en agua que fluye rápidamente, como arroyos de agua dulce, remolinos y celdas de flujo de laboratorio especialmente diseñadas que replican las condiciones de crecimiento en fluidos de rápido movimiento. Las serpentinas están ancladas al sustrato por una “cabeza” y la “cola” flota aguas abajo en la corriente. En aguas fijas o de movimiento lento, las biopelículas principalmente asumen una forma de hongo. La estructura de las biopelículas también puede cambiar con otras condiciones ambientales como la disponibilidad de nutrientes.
Las observaciones detalladas de biopelículas bajo láser confocal y microscopios electrónicos de barrido revelan conglomerados de microorganismos incrustados en una matriz intercalada con canales de aguas abiertas. La matriz extracelular consiste en sustancias poliméricas extracelulares (EPS) secretadas por los organismos en la biopelícula. La matriz extracelular representa una gran fracción de la biopelícula, representando 50% — 90% de la masa seca total. Las propiedades del EPS varían según los organismos residentes y las condiciones ambientales.
EPS es un gel hidratado compuesto principalmente por polisacáridos y que contiene otras macromoléculas como proteínas, ácidos nucleicos y lípidos. Desempeña un papel clave en el mantenimiento de la integridad y función de la biopelícula. Los canales en el EPS permiten el movimiento de nutrientes, desechos y gases a lo largo de la biopelícula. Esto mantiene las células hidratadas, evitando la desecación. El EPS también protege a los organismos en la biopelícula de la depredación por otros microbios o células (por ejemplo, protozoos, glóbulos blancos en el cuerpo humano).
Formación de biopelículas
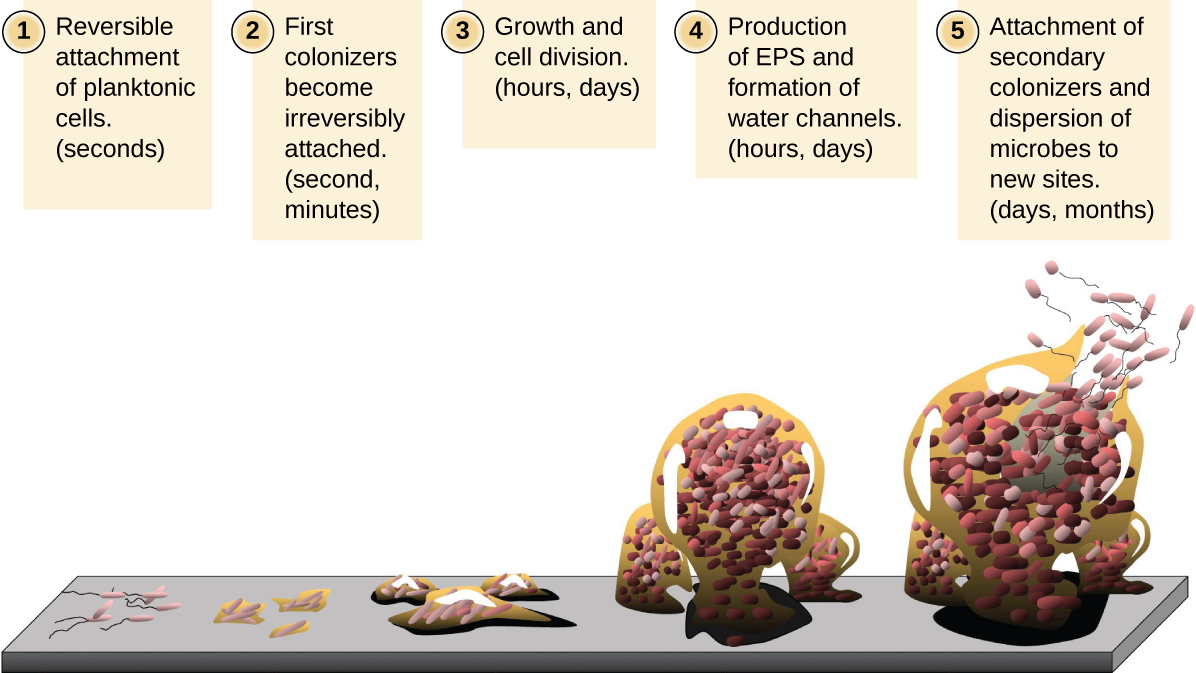
Las células microbianas de flotación libre que viven en un ambiente acuático se denominan células planctónicas. La formación de una biopelícula implica esencialmente la unión de células planctónicas a un sustrato, donde se vuelven sésiles (unidas a una superficie). Esto ocurre en etapas, como se representa en la Figura\(\PageIndex{16}\). La primera etapa implica la unión de células planctónicas a una superficie recubierta con una película acondicionadora de material orgánico. En este punto, la unión al sustrato es reversible, pero a medida que las células expresan nuevos fenotipos que facilitan la formación de EPS, pasan de un estilo de vida planctónico a un estilo de vida sésil. La biopelícula desarrolla estructuras características, incluyendo una extensa matriz y canales de agua. Apéndices como fimbrias, pilos y flagelos interactúan con el EPS, y la microscopía y el análisis genético sugieren que tales estructuras son necesarias para el establecimiento de una biopelícula madura. En la última etapa del ciclo de vida de la biopelícula, las células en la periferia de la biopelícula revierten a un estilo de vida planctónico, desprendiendo la biopelícula madura para colonizar nuevos sitios. Esta etapa se conoce como dispersión.
Dentro de una biopelícula, diferentes especies de microorganismos establecen colaboraciones metabólicas en las que el producto de desecho de un organismo se convierte en el nutriente para otro. Por ejemplo, los microorganismos aeróbicos consumen oxígeno, creando regiones anaeróbicas que promueven el crecimiento de anaerobios. Esto ocurre en muchas infecciones polimicrobianas que involucran patógenos tanto aeróbicos como anaerobios.
El mecanismo por el cual las células en una biopelícula coordinan sus actividades en respuesta a estímulos ambientales se denomina detección de quórum. La detección de quórum, que puede ocurrir entre células de diferentes especies dentro de una biopelícula, permite a los microorganismos detectar su densidad celular a través de la liberación y unión de pequeñas moléculas difusibles llamadas autoinductores. Cuando la población celular alcanza un umbral crítico (quórum), estos autoinductores inician una cascada de reacciones que activan genes asociados a funciones celulares que solo son beneficiosas cuando la población alcanza una densidad crítica. Por ejemplo, en algunos patógenos, la síntesis de factores de virulencia solo comienza cuando hay suficientes células presentes para abrumar las defensas inmunitarias del huésped. Aunque se estudia principalmente en poblaciones bacterianas, la detección de quórum se realiza entre bacterias y eucariotas y entre células eucariotas como el hongo Candida albicans, un miembro común de la microbiota humana que puede causar infecciones en individuos inmunodeprimidos.
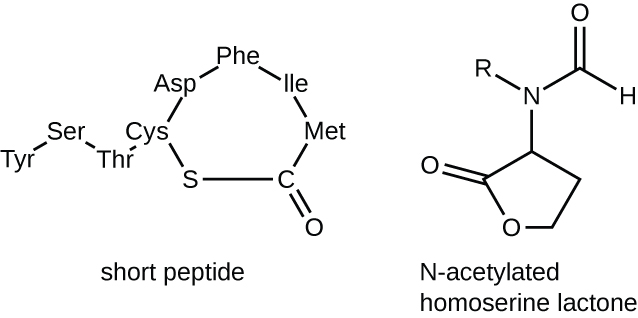
Las moléculas de señalización en la detección de quórum pertenecen a dos clases principales. Las bacterias gramnegativas se comunican principalmente usando homoserina lactonas N-aciladas, mientras que las bacterias grampositivas utilizan principalmente péptidos pequeños (Figura\(\PageIndex{17}\)). En todos los casos, el primer paso en la detección de quórum consiste en la unión del autoinductor a su receptor específico solo cuando se alcanza una concentración umbral de moléculas de señalización. Una vez que tiene lugar la unión al receptor, una cascada de eventos de señalización conduce a cambios en la expresión génica. El resultado es la activación de respuestas biológicas ligadas a la detección de quórum, notablemente un incremento en la producción de las propias moléculas de señalización, de ahí el término autoinductor.
Biofilms y Salud Humana
El cuerpo humano alberga muchos tipos de biopelículas, algunas beneficiosas y otras dañinas. Por ejemplo, las capas de microbiota normal que recubren la mucosa intestinal y respiratoria juegan un papel en la prevención de infecciones por patógenos. Sin embargo, otras biopelículas en el cuerpo pueden tener un efecto perjudicial en la salud. Por ejemplo, la placa que se forma en los dientes es una biopelícula que puede contribuir a la enfermedad dental y periodontal. También se pueden formar biopelículas en las heridas, ocasionando en ocasiones infecciones graves que pueden propagarse. La bacteria Pseudomonas aeruginosa a menudo coloniza biopelículas en las vías respiratorias de pacientes con fibrosis quística, causando infecciones crónicas y a veces fatales de los pulmones. También se pueden formar biopelículas en dispositivos médicos utilizados en o en el cuerpo, causando infecciones en pacientes con catéteres internos, articulaciones artificiales o lentes de contacto.
Los patógenos incrustados dentro de las biopelículas presentan una mayor resistencia a los antibióticos que sus homólogos de flotación libre. Se han propuesto varias hipótesis para explicar por qué. Las células en las capas profundas de una biopelícula son metabólicamente inactivas y pueden ser menos susceptibles a la acción de los antibióticos que interrumpen las actividades metabólicas. El EPS también puede ralentizar la difusión de antibióticos y antisépticos, evitando que lleguen a las células en las capas más profundas de la biopelícula. Los cambios fenotípicos también pueden contribuir al aumento de la resistencia exhibida por las células bacterianas en biopelículas. Por ejemplo, el aumento de la producción de bombas de eflujo, proteínas incrustadas en la membrana que extruyen activamente antibióticos de las células bacterianas, han demostrado ser un mecanismo importante de resistencia a los antibióticos entre las bacterias asociadas a biopelículas. Finalmente, las biopelículas proporcionan un ambiente ideal para el intercambio de ADN extracromosómico, que a menudo incluye genes que confieren resistencia a antibióticos.
Ejercicio\(\PageIndex{9}\)
- ¿En qué consiste la matriz de una biopelícula?
- ¿Cuál es el papel de la detección de quórum en una biopelícula?
Conceptos clave y resumen
- La mayoría de las células bacterianas se dividen por fisión binaria. El tiempo de generación en el crecimiento bacteriano se define como el tiempo de duplicación de la población.
- Las células en un sistema cerrado siguen un patrón de crecimiento con cuatro fases: lag, logarítmica (exponencial), estacionaria y muerte.
- Las células pueden ser contadas por recuento directo de células viables. Los métodos de la placa de vertido y la placa de extensión se utilizan para sembrar diluciones seriadas en o sobre, respectivamente, agar para permitir el recuento de células viables que dan lugar a unidades formadoras de colonias. La filtración por membrana se utiliza para contar células vivas en soluciones diluidas. El método del número celular más probable (MPN) permite estimar el número de células en cultivos sin usar medios sólidos.
- Se pueden usar métodos indirectos para estimar la densidad de cultivo midiendo la turbidez de un cultivo o la densidad de células vivas midiendo la actividad metabólica.
- Otros patrones de división celular incluyen la formación de múltiples nucleoides en las células; la división asimétrica, como en la brotación; y la formación de hifas y esporas terminales.
- Las biopelículas son comunidades de microorganismos enmallados en una matriz de sustancia polimérica extracelular. La formación de una biopelícula ocurre cuando las células planctónicas se unen a un sustrato y se vuelven sésiles. Las células en biopelículas coordinan su actividad comunicándose a través de la detección de quórum.
- Las biopelículas se encuentran comúnmente en superficies en la naturaleza y en el cuerpo humano, donde pueden ser beneficiosas o causar infecciones graves. Los patógenos asociados con biopelículas suelen ser más resistentes a antibióticos y desinfectantes.


