13.1: Controlar el crecimiento microbiano
- Page ID
- 54350
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Compara desinfectantes, antisépticos y esterilizantes
- Describir los principios para controlar la presencia de microorganismos a través de la esterilización y desinfección
- Diferenciar entre microorganismos de diversos niveles de seguridad biológica y explicar los métodos utilizados para el manejo de microbios en cada nivel
Enfoque Clínico: Parte 1
Roberta es una agente inmobiliaria de 46 años que recientemente se sometió a una colecistectomía (cirugía para extirpar cálculos biliares dolorosos). La cirugía se realizó laparoscópicamente con la ayuda de un duodenoscopio, un endoscopio especializado que permite a los cirujanos ver el interior del cuerpo con la ayuda de una pequeña cámara. Al regresar a casa del hospital, Roberta desarrolló dolor abdominal y fiebre alta. También experimentó una sensación de ardor al orinar y notó sangre en su orina. Ella notificó a su cirujano de estos síntomas, según sus instrucciones postoperatorias.
Ejercicio\(\PageIndex{1}\)
¿Cuáles son algunas posibles causas de los síntomas de Roberta?
Para prevenir la propagación de enfermedades humanas, es necesario controlar el crecimiento y la abundancia de microbios en o sobre diversos elementos frecuentemente utilizados por los humanos. Los artículos inanimados, como pomos de puerta, juguetes o toallas, que pueden albergar microbios y ayudar en la transmisión de enfermedades, se llaman fomites. Dos factores influyen fuertemente en el nivel de limpieza requerido para un determinado fomite y, de ahí, el protocolo elegido para lograr este nivel. El primer factor es la aplicación para la que se utilizará el artículo. Por ejemplo, las aplicaciones invasivas que requieren inserción en el cuerpo humano requieren un nivel de limpieza mucho mayor que las aplicaciones que no lo hacen. El segundo factor es el nivel de resistencia al tratamiento antimicrobiano por patógenos potenciales. Por ejemplo, los alimentos conservados por enlatado a menudo se contaminan con la bacteria Clostridium botulinum, que produce la neurotoxina que causa el botulismo. Debido a que C. botulinum puede producir endosporas que pueden sobrevivir a condiciones duras, se deben usar temperaturas y presiones extremas para eliminar las endosporas. Otros organismos pueden no requerir medidas tan extremas y pueden ser controlados por un procedimiento como lavar la ropa en una lavadora.
Niveles de Seguridad Biológica de Laboratorio
Para investigadores o personal de laboratorio que trabaja con patógenos, los riesgos asociados a patógenos específicos determinan los niveles de limpieza y control requeridos. Los Centros para el Control y la Prevención de Enfermedades (CDC) y los Institutos Nacionales de Salud (NIH) han establecido cuatro niveles de clasificación, denominados “niveles de seguridad biológica” (BSL). Diversas organizaciones alrededor del mundo, entre ellas la Organización Mundial de la Salud (OMS) y la Unión Europea (UE), utilizan un esquema de clasificación similar. Según los CDC, el BSL está determinado por la infectividad del agente, la facilidad de transmisión y la gravedad potencial de la enfermedad, así como el tipo de trabajo que se realiza con el agente. 1
Cada BSL requiere de un nivel diferente de biocontención para evitar la contaminación y propagación de agentes infecciosos al personal de laboratorio y, en última instancia, a la comunidad. Por ejemplo, el BSL más bajo, BSL-1, requiere la menor cantidad de precauciones porque se aplica a situaciones con el menor riesgo de infección microbiana.
Los agentes BSL-1 son aquellos que generalmente no causan infección en humanos adultos sanos. Estas incluyen bacterias no infecciosas, como cepas no patógenas de Escherichia coli y Bacillus subtilis, y virus que se sabe que infectan a animales distintos a los humanos, como los baculovirus (virus de insectos). Debido a que trabajar con agentes BSL-1 plantea muy poco riesgo, son necesarias pocas precauciones. Los trabajadores de laboratorio utilizan una técnica aséptica estándar y pueden trabajar con estos agentes en un banco o mesa abierta de laboratorio, usando equipo de protección personal (EPP) como una bata de laboratorio, gafas y guantes, según sea necesario. Aparte de un fregadero para lavado de manos y puertas para separar el laboratorio del resto del edificio, no se necesitan modificaciones adicionales.
Los agentes clasificados como BSL-2 incluyen aquellos que presentan un riesgo moderado para los trabajadores de laboratorio y la comunidad, y son típicamente “indígenas”, lo que significa que comúnmente se encuentran en esa área geográfica. Estos incluyen bacterias como Staphylococcus aureus y Salmonella spp., y virus como hepatitis, paperas y virus del sarampión. Los laboratorios BSL-2 requieren precauciones adicionales más allá de las de BSL-1, incluyendo acceso restringido; EPP requerido, incluyendo un protector facial en algunas circunstancias; y el uso de gabinetes de seguridad biológica para procedimientos que puedan dispersar agentes por el aire (llamado “aerosolización”). Los laboratorios BSL-2 están equipados con puertas de cierre automático, una estación lavaojos y un autoclave, que es un dispositivo especializado para esterilizar materiales con vapor presurizado antes de su uso o eliminación. Los laboratorios BSL-1 también pueden tener un autoclave.
Los agentes BSL-3 tienen el potencial de causar infecciones letales por inhalación. Estos pueden ser indígenas o “exóticos”, lo que significa que se derivan de una ubicación extraña, e incluyen patógenos como Mycobacterium tuberculosis, Bacillus anthracis, virus del Nilo Occidental y virus de inmunodeficiencia humana (VIH). Debido a la gravedad de las infecciones causadas por los agentes BSL-3, los laboratorios que trabajan con ellos requieren acceso restringido. Los trabajadores de laboratorio están bajo vigilancia médica, posiblemente recibiendo vacunas para los microbios con los que trabajan. Además del PPE estándar ya mencionado, el personal de laboratorio en los laboratorios BSL-3 también debe usar un respirador y trabajar con microbios y agentes infecciosos en un gabinete de seguridad biológica en todo momento. Los laboratorios BSL-3 requieren un fregadero manos libres, una estación lavaojos cerca de la salida y dos juegos de puertas de cierre automático y bloqueo en la entrada. Estos laboratorios están equipados con flujo de aire direccional, lo que significa que el aire limpio es aspirado a través del laboratorio desde áreas limpias hasta áreas potencialmente contaminadas. Este aire no puede ser recirculado, por lo que se requiere un suministro constante de aire limpio.
Los agentes BSL-4 son los más peligrosos y a menudo fatales. Estos microbios son típicamente exóticos, se transmiten fácilmente por inhalación, y causan infecciones para las que no hay tratamientos ni vacunas. Los ejemplos incluyen el virus del Ébola y el virus de Marburgo, los cuales causan fiebres hemorrágicas, y el virus de la viruela. Solo hay un pequeño número de laboratorios en Estados Unidos y en todo el mundo debidamente equipados para trabajar con estos agentes. Además de las precauciones BSL-3, los trabajadores de laboratorio en las instalaciones de BSL-4 también deben cambiarse de ropa al ingresar al laboratorio, ducharse al salir y descontaminar todo el material al salir. Mientras trabajan en el laboratorio, deben usar un traje protector de cuerpo completo con un suministro de aire designado o realizar todo el trabajo dentro de un gabinete de seguridad biológica con un suministro de aire filtrado de partículas de alta eficiencia (HEPA) y un escape doblemente filtrado por HEPA. Si usa un traje, la presión del aire dentro del traje debe ser mayor que la del exterior del traje, de modo que si se produce una fuga en el traje, el aire de laboratorio que pueda estar contaminado no se puede introducir en el traje (Figura\(\PageIndex{1}\)). El propio laboratorio debe estar ubicado ya sea en un edificio separado o en una porción aislada de un edificio y tener su propio sistema de suministro de aire y escape, así como su propio sistema de descontaminación. Los BSL se resumen en la Figura\(\PageIndex{2}\).

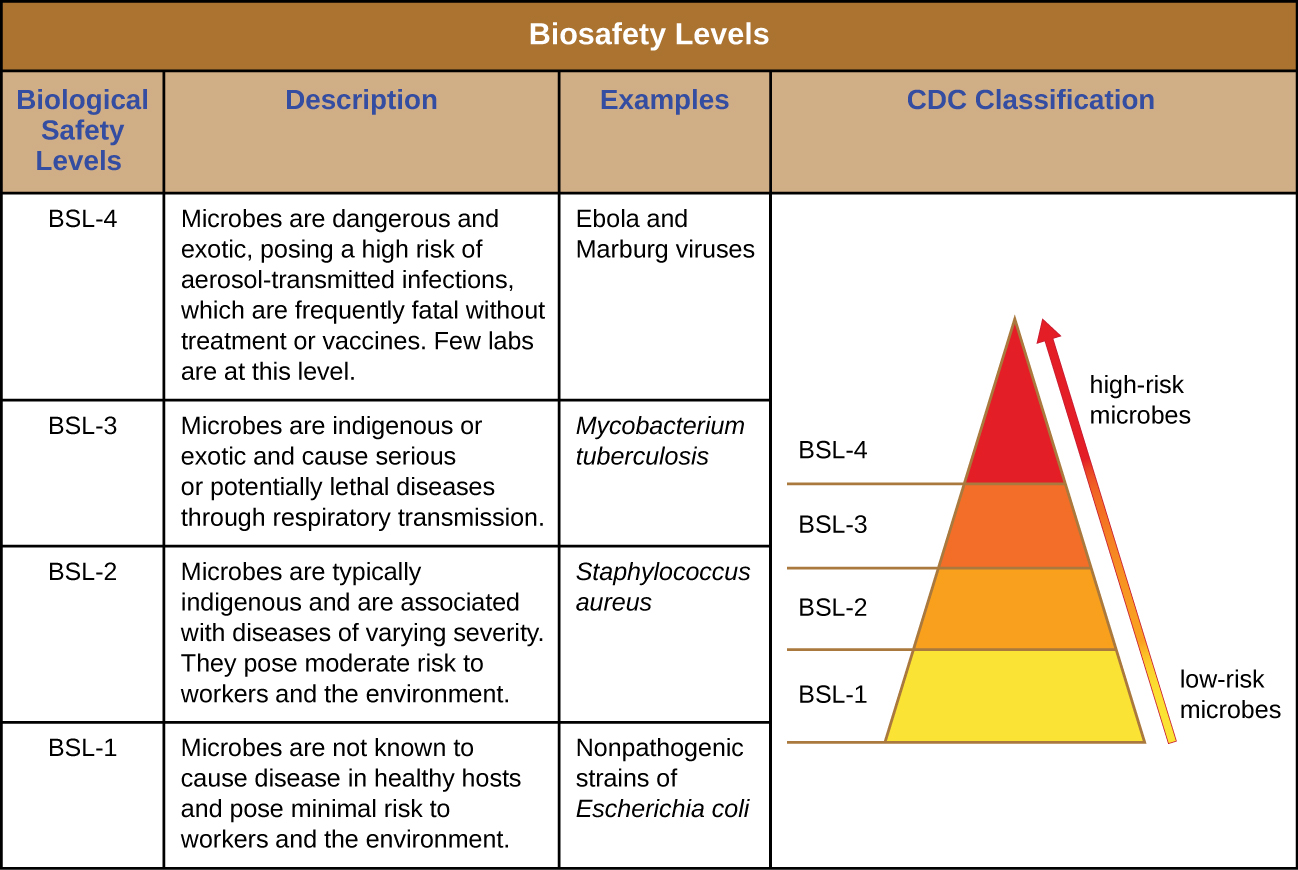
Para obtener más información sobre las cuatro BSL, visite el sitio web de los CDC.
Ejercicio\(\PageIndex{2}\)
¿Cuáles son algunos factores utilizados para determinar el BSL necesario para trabajar con un patógeno específico?
Esterilización
Los protocolos más extremos para el control microbiano tienen como objetivo lograr la esterilización: la eliminación completa o destrucción de todas las células vegetativas, endosporas y virus del elemento o ambiente objetivo. Los protocolos de esterilización generalmente están reservados para entornos de laboratorio, médicos, manufactureros y de la industria alimentaria, donde puede ser imperativo que ciertos artículos estén completamente libres de agentes potencialmente infecciosos. La esterilización se puede lograr a través de medios físicos, como la exposición a alto calor, presión o filtración a través de un filtro apropiado, o por medios químicos. Los químicos que se pueden utilizar para lograr la esterilización se denominan esterilizantes s. Los esterilizantes matan eficazmente todos los microbios y virus y, con el tiempo de exposición adecuado, también pueden matar las endosporas.
Para muchos propósitos clínicos, la técnica aséptica es necesaria para evitar la contaminación de superficies estériles. La técnica aséptica implica una combinación de protocolos que mantienen colectivamente la esterilidad, o asepsia, evitando así la contaminación del paciente con microbios y agentes infecciosos. No practicar la técnica aséptica durante muchos tipos de procedimientos clínicos puede introducir microbios en el cuerpo del paciente y poner al paciente en riesgo de sepsis, una respuesta inflamatoria sistémica a una infección que da como resultado fiebre alta, aumento de las frecuencias cardíacas y respiratorias, shock y, posiblemente, muerte. Los procedimientos médicos que conlleven riesgo de contaminación deben realizarse en un campo estéril, un área designada que se mantenga libre de todos los microbios vegetativos, endosporas y virus. Los campos estériles se crean de acuerdo con protocolos que requieren el uso de materiales esterilizados, como empaques y drapeado, y procedimientos estrictos para el lavado y aplicación de esterilizantes. Se siguen otros protocolos para mantener el campo estéril mientras se realiza el procedimiento médico.
Un protocolo de esterilización de alimentos, la esterilización comercial, utiliza calor a una temperatura lo suficientemente baja como para preservar la calidad de los alimentos pero lo suficientemente alta como para destruir patógenos comunes responsables de la intoxicación alimentaria, como C. botulinum. Debido a que C. botulinum y sus endosporas se encuentran comúnmente en el suelo, pueden contaminar fácilmente los cultivos durante la cosecha, y estas endosporas pueden germinar posteriormente dentro del ambiente anaeróbico una vez que los alimentos son enlatados. Las latas metálicas de alimentos contaminados con C. botulinum se abombarán debido a la producción de gases del microbio; los frascos contaminados de alimentos generalmente se abultan en la tapa metálica. Para eliminar el riesgo de contaminación por C. botulinum, se diseñan protocolos comerciales de conservas de alimentos con un amplio margen de error. Asumen una población imposiblemente grande de endosporas (10 12 por lata) y tienen como objetivo reducir esta población a 1 endospora por lata para garantizar la inocuidad de los alimentos enlatados. Por ejemplo, los alimentos ácidos bajos y medios se calientan a 121 °C por un mínimo de 2.52 minutos, que es el tiempo que tardaría en reducir una población de 10 12 endoesporas por lata hasta 1 endospora a esta temperatura. Aun así, la esterilización comercial no elimina la presencia de todos los microbios; más bien, se dirige a aquellos patógenos que causan deterioro y enfermedades transmitidas por los alimentos, al tiempo que permite que muchos organismos no patógenos sobrevivan. Por lo tanto, la “esterilización” es algo así como un nombre inapropiado en este contexto, y la esterilización comercial puede describirse con mayor precisión como “cuasi-esterilización”.
Ejercicio\(\PageIndex{3}\)
¿Cuál es la diferencia entre la esterilización y la técnica aséptica?
La Asociación de Tecnólogos Quirúrgicos publica estándares para la técnica aséptica, incluyendo la creación y mantenimiento de un campo estéril.
Otros métodos de control
Los protocolos de esterilización requieren procedimientos que no son prácticos, o necesarios, en muchos entornos. Varios otros métodos se utilizan en entornos clínicos y no clínicos para reducir la carga microbiana en los ítems. Aunque los términos para estos métodos se suelen utilizar indistintamente, existen distinciones importantes (Figura\(\PageIndex{3}\)).
El proceso de desinfección inactiva la mayoría de los microbios en la superficie de un fomite mediante el uso de productos químicos antimicrobianos o calor. Debido a que algunos microbios permanecen, el artículo desinfectado no se considera estéril. Idealmente, los desinfectantes deben ser de acción rápida, estables, fáciles de preparar, económicos y fáciles de usar. Un ejemplo de desinfectante natural es el vinagre; su acidez mata a la mayoría de los microbios. Los desinfectantes químicos, como la lejía con cloro o los productos que contienen cloro, se utilizan para limpiar superficies no vivas como bancos de laboratorio, superficies clínicas y lavabos de baño. La desinfección típica no conduce a la esterilización porque las endoesporas tienden a sobrevivir incluso cuando todas las células vegetativas han sido destruidas.
A diferencia de los desinfectantes, los antisépticos son productos químicos antimicrobianos seguros para su uso en piel o tejidos vivos. Ejemplos de antisépticos incluyen peróxido de hidrógeno y alcohol isopropílico. El proceso de aplicación de un antiséptico se llama antisepsia. Además de las características de un buen desinfectante, los antisépticos también deben ser selectivamente efectivos contra microorganismos y capaces de penetrar en el tejido profundamente sin causar daño tisular.
El tipo de protocolo requerido para lograr el nivel de limpieza deseado depende del artículo particular a limpiar. Por ejemplo, los utilizados clínicamente se clasifican como críticos, semicríticos y no críticos. Los artículos críticos deben ser estériles porque se utilizarán dentro del cuerpo, a menudo penetrando en tejidos estériles o en el torrente sanguíneo; ejemplos de artículos críticos incluyen instrumentos quirúrgicos, catéteres y fluidos intravenosos. Los endoscopios gastrointestinales y diversos tipos de equipos para terapias respiratorias son ejemplos de ítems semicríticos; pueden entrar en contacto con membranas mucosas o piel no intacta pero no penetran en los tejidos. Por lo general, los artículos semicríticos no necesitan esterilizarse, pero sí requieren un alto nivel de desinfección. Los artículos que pueden entrar en contacto pero no penetrar la piel intacta son artículos no críticos; ejemplos son ropa de cama, muebles, muletas, estetoscopios y puños para la presión arterial. Estos artículos necesitan estar limpios pero no altamente desinfectados.
El acto de lavarse las manos es un ejemplo de desgerminación, en el que los números microbianos se reducen significativamente al fregar suavemente el tejido vivo, más comúnmente la piel, con un químico suave (por ejemplo, jabón) para evitar la transmisión de microbios patógenos. Limpiar la piel con un hisopo con alcohol en el lugar de la inyección es otro ejemplo de desgerminación. Estos métodos de desgerminación eliminan la mayoría (pero no todos) microbios de la superficie de la piel.
El término sanitización se refiere a la limpieza de fomitos para eliminar suficientes microbios para lograr niveles considerados seguros para la salud pública. Por ejemplo, los lavavajillas comerciales utilizados en la industria de servicios de alimentos suelen utilizar agua y aire muy calientes para lavar y secar; las altas temperaturas matan a la mayoría de los microbios, desinfectando los platos. Las superficies en las habitaciones de los hospitales se desinfectan comúnmente con un desinfectante químico para prevenir la transmisión de enfermedades entre pacientes. La figura\(\PageIndex{3}\) resume protocolos comunes, definiciones, aplicaciones y agentes utilizados para controlar el crecimiento microbiano.

Ejercicio\(\PageIndex{4}\)
- ¿Cuál es la diferencia entre un desinfectante y un antiséptico?
- ¿Cuál es el más efectivo para eliminar microbios de un producto: desinfección, desgerminación o esterilización? Explicar.
Enfoque Clínico: Parte 2
El médico de Roberta sospechó que una infección bacteriana fue la responsable de su fiebre alta de inicio brusco, dolor abdominal y orina sanguinolenta. Con base en estos síntomas, el médico diagnosticó una infección del tracto urinario (ITU). Una amplia variedad de bacterias pueden causar infecciones urinarias, que generalmente ocurren cuando las bacterias del tracto gastrointestinal inferior se introducen en el tracto urinario. Sin embargo, la reciente cirugía de cálculos biliares de Roberta provocó que el médico sospechara que había contraído una infección nosocomial (adquirida en el hospital) durante su cirugía. El médico tomó una muestra de orina y ordenó un cultivo de orina para verificar la presencia de glóbulos blancos, glóbulos rojos y bacterias. Los resultados de esta prueba ayudarían a determinar la causa de la infección. El médico también le recetó un curso del antibiótico ciprofloxacino, confiando en que aclararía la infección de Roberta.
Ejercicio\(\PageIndex{5}\)
¿Cuáles son algunas formas posibles en que las bacterias podrían haberse introducido en las vías urinarias de Roberta durante su cirugía?
Medición del Control Microbiano
Los métodos físicos y químicos de control microbiano que matan al microorganismo objetivo son identificados por el sufijo -cide (o -cidal). El prefijo indica el tipo de microbio o agente infeccioso muerto por el método de tratamiento: bactericida s mata bacterias, viricida s mata o inactiva virus, y fungicida s mata hongos. Otros métodos no matan organismos sino que, en cambio, detienen su crecimiento, haciendo que su población sea estática; dichos métodos se identifican por el sufijo -stat (o -static). Por ejemplo, los tratamientos bacteriostáticos inhiben el crecimiento de bacterias, mientras que los tratamientos fungistáticos inhiben el crecimiento de hongos. Los factores que determinan si un tratamiento en particular es -cida o -estático incluyen los tipos de microorganismos objetivo, la concentración de la sustancia química utilizada y la naturaleza del tratamiento aplicado.
Aunque los tratamientos estáticos en realidad no matan a los agentes infecciosos, a menudo son menos tóxicos para los humanos y otros animales, y también pueden preservar mejor la integridad del artículo tratado. Tales tratamientos suelen ser suficientes para mantener bajo control la población microbiana de un artículo. La toxicidad reducida de algunos de estos productos químicos estáticos también les permite impregnarse de manera segura en plásticos para evitar el crecimiento de microbios en estas superficies. Dichos plásticos se utilizan en productos como juguetes para niños y tablas de cortar para la preparación de alimentos. Cuando se usan para tratar una infección, los tratamientos estáticos suelen ser suficientes en un individuo sano, evitando que el patógeno se multiplique, permitiendo así que el sistema inmunitario del individuo elimine la infección.
El grado de control microbiano se puede evaluar utilizando una curva de muerte microbiana para describir el progreso y la efectividad de un protocolo particular. Cuando se expone a un protocolo de control microbiano particular, morirá un porcentaje fijo de los microbios dentro de la población. Debido a que la tasa de matanzas se mantiene constante incluso cuando el tamaño de la población varía, el porcentaje de muertos es información más útil que el número absoluto de microbios muertos. Las curvas de muerte a menudo se representan como parcelas semilog al igual que las curvas de crecimiento microbiano porque la reducción en microorganismos es típicamente logarítmica (Figura\(\PageIndex{4}\)). La cantidad de tiempo que tarda un protocolo específico en producir una disminución de un orden de magnitud en el número de organismos, o la muerte del 90% de la población, se denomina tiempo de reducción decimal (DRT) o valor D.
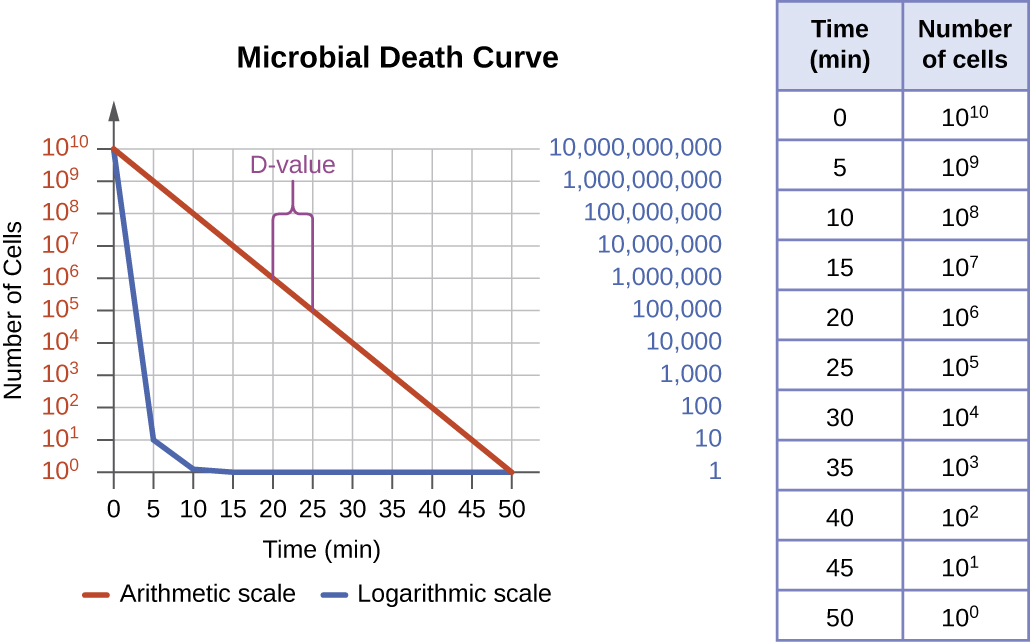
Varios factores contribuyen a la efectividad de un agente desinfectante o protocolo de control microbiano. Primero, como se demuestra en la Figura\(\PageIndex{4}\), el tiempo de exposición es importante. Los tiempos de exposición más largos matan más microbios. Debido a que la muerte microbiana de una población expuesta a un protocolo específico es logarítmica, lleva más tiempo matar una carga poblacional alta que una carga poblacional baja expuesta al mismo protocolo. Se necesita un tiempo de tratamiento más corto (medido en múltiplos del valor D) cuando se inicia con un número menor de organismos. La efectividad también depende de la susceptibilidad del agente a ese agente desinfectante o protocolo. También es importante la concentración de agente desinfectante o la intensidad de exposición. Por ejemplo, temperaturas más altas y concentraciones más altas de desinfectantes matan a los microbios de manera más rápida y efectiva. Las condiciones que limitan el contacto entre el agente y las células diana, por ejemplo, la presencia de fluidos corporales, tejidos, desechos orgánicos (por ejemplo, lodo o heces) o biopelículas en las superficies, aumentan el tiempo de limpieza o la intensidad del protocolo de control microbiano requerido para alcanzar el nivel deseado de limpieza . Todos estos factores deben ser considerados a la hora de elegir el protocolo apropiado para controlar el crecimiento microbiano en una situación dada.
Ejercicio\(\PageIndex{6}\)
- ¿Cuáles son dos posibles razones para elegir un tratamiento bacteriostático sobre uno bactericida?
- Nombrar al menos dos factores que puedan comprometer la efectividad de un agente desinfectante.
Conceptos clave y resumen
- Los artículos inanimados que pueden albergar microbios y ayudar en su transmisión se denominan fomites. El nivel de limpieza requerido para un fomite depende tanto del uso del artículo como del agente infeccioso con el que el artículo puede estar contaminado.
- Los CDC y los NIH han establecido cuatro niveles de seguridad biológica (BSL) para laboratorios que realizan investigaciones sobre agentes infecciosos. Cada nivel está diseñado para proteger al personal de laboratorio y a la comunidad. Estos BSL están determinados por la infectividad del agente, la facilidad de transmisión y la gravedad potencial de la enfermedad, así como el tipo de trabajo que se realiza con el agente.
- La desinfección elimina los patógenos potenciales de un fómito, mientras que la antisepsia utiliza químicos antimicrobianos lo suficientemente seguros para los tejidos; en ambos casos, la carga microbiana se reduce, pero los microbios pueden permanecer a menos que el químico utilizado sea lo suficientemente fuerte como para ser esterilizante.
- La cantidad de limpieza (esterilización versus desinfección de alto nivel versus limpieza general) requerida para los artículos utilizados clínicamente depende de si el artículo entrará en contacto con tejidos estériles (elemento crítico), membranas mucosas (elemento semicritico) o intacto piel (elemento no crítico).
- Los procedimientos médicos con riesgo de contaminación deben realizarse en un campo estéril mantenido por una técnica aséptica adecuada para prevenir la sepsis.
- La esterilización es necesaria para algunas aplicaciones médicas así como en la industria alimentaria, donde las endosporas de Clostridium botulinum se matan a través de protocolos comerciales de esterilización.
- Los métodos físicos o químicos para controlar el crecimiento microbiano que resultan en la muerte del microbio están indicados por los sufijos -cida o -cida (por ejemplo, como con bactericidas, viricidas y fungicidas), mientras que los que inhiben el crecimiento microbiano son indicado por los sufijos -stat o -static (e.g., bacteriostático, fungistático).
- Las curvas de muerte microbiana muestran la disminución logarítmica de microbios vivos expuestos a un método de control microbiano. El tiempo que tarda un protocolo en producir una reducción de 1 log (90%) en la población microbiana es el tiempo de reducción decimal, o valor D.
- Al elegir un protocolo de control microbiano, los factores a considerar incluyen la duración del tiempo de exposición, el tipo de microbio objetivo, su susceptibilidad al protocolo, la intensidad del tratamiento, la presencia de compuestos orgánicos que pueden interferir con el protocolo, y las condiciones ambientales que pueden alterar el efectividad del protocolo.
Notas al pie
- 1 Centros para el Control y la Prevención de Enfermedades de Estados Unidos. “Reconocer los Niveles de Bioseguridad”. http://www.cdc.gov/training/quicklearns/biosafety/. Consultado el 7 de junio de 2016.


