18.3: Linfocitos T
- Page ID
- 54643
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Describir el proceso de maduración de células T y selección tímica
- Explicar los eventos genéticos que conducen a la diversidad de receptores de células T
- Comparar y contrastar las diversas clases y subtipos de células T en términos de activación y función
- Explicar el mecanismo por el cual los superantígenos efectúan la activación no regulada de células T
Como se explica en Descripción general de la inmunidad adaptativa específica, los anticuerpos involucrados en la inmunidad humoral a menudo se unen a patógenos y toxinas antes de que puedan unirse e invadir las células hospedadoras. Así, la inmunidad humoral se ocupa principalmente de combatir patógenos en espacios extracelulares. Sin embargo, los patógenos que ya han ganado entrada a las células hospedadoras están ampliamente protegidos de las defensas mediadas por anticuerpos humorales. La inmunidad celular, por otro lado, se dirige y elimina los patógenos intracelulares a través de las acciones de los linfocitos T, o células T (Figura\(\PageIndex{1}\)). Las células T también juegan un papel más central en la orquestación de la respuesta inmune adaptativa general (tanto humoral como celular) junto con las defensas celulares de la inmunidad innata.

Producción y maduración de células T
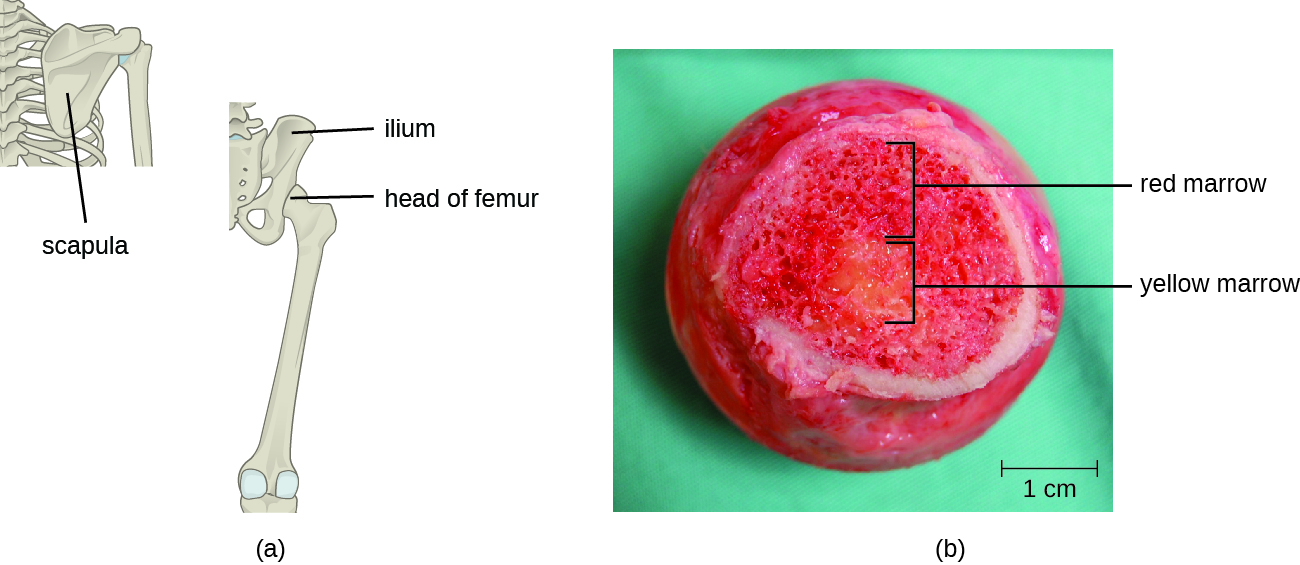
Las células T, como todos los demás glóbulos blancos implicados en la inmunidad innata y adaptativa, se forman a partir de células madre hematopoyéticas multipotentes (CMH) en la médula ósea (ver Figura 17.3.1). Sin embargo, a diferencia de los glóbulos blancos de la inmunidad innata, las células T eventuales se diferencian primero en células madre linfoides que luego se convierten en linfocitos pequeños e inmaduros, a veces llamados linfoblastos. Los primeros pasos de diferenciación ocurren en la médula roja de los huesos (Figura\(\PageIndex{2}\)), después de lo cual los linfocitos T inmaduros ingresan al torrente sanguíneo y viajan al timo para las etapas finales de maduración (Figura\(\PageIndex{3}\)). Una vez en el timo, los linfocitos T inmaduros se denominan timocitos.
La maduración de los timocitos dentro del timo se puede dividir en pasos críticos de árbol de selección positiva y negativa, denominados colectivamente selección tímica. El primer paso de la selección tímica ocurre en la corteza del timo e implica el desarrollo de un receptor funcional de células T (TCR) que se requiere para la activación por APC. Los timocitos con TCR defectuosos se eliminan mediante selección negativa a través de la inducción de apoptosis (muerte celular controlada programada). El segundo paso de la selección tímica también ocurre en la corteza e implica la selección positiva de timocitos que interaccionarán apropiadamente con las moléculas del MHC. Los timocitos que pueden interactuar apropiadamente con las moléculas del MHC reciben una estimulación positiva que los mueve más a través del proceso de maduración, mientras que los timocitos que no interactúan adecuadamente no son estimulados y son eliminados por la apoptosis. El tercer y último paso de la selección tímica ocurre tanto en la corteza como en la médula e implica la selección negativa para eliminar los timocitos autorreactivos, aquellos que reaccionan a los autoantígenos, por apoptosis. Este paso final a veces se conoce como tolerancia central porque evita que las células T autorreaccionantes lleguen al torrente sanguíneo y puedan causar enfermedades autoinmunes, lo que ocurre cuando el sistema inmunitario ataca a las células “auto” sanas.
A pesar de la tolerancia central, algunas células T autorreactivas generalmente escapan del timo y ingresan al torrente sanguíneo periférico. Por lo tanto, se necesita una segunda línea de defensa llamada tolerancia periférica para proteger contra la enfermedad autoinmune. La tolerancia periférica implica mecanismos de anergia e inhibición de células T autorreactivas por células T reguladoras. La anergia se refiere a un estado de falta de respuesta a la estimulación antigénica. En el caso de las células T autorreactivas que escapan del timo, la falta de una señal coestimuladora esencial requerida para la activación provoca anergia e impide la activación autoinmune. Las células T reguladoras participan en la tolerancia periférica inhibiendo la activación y función de las células T autorreactivas y secretando citocinas antiinflamatorias.
No se entiende completamente qué eventos dirigen específicamente la maduración de los timocitos en células T reguladoras. Las teorías actuales sugieren que los eventos críticos pueden ocurrir durante el tercer paso de la selección tímica, cuando se eliminan la mayoría de las células T autorreactivas. Las células T reguladoras pueden recibir una señal única que está por debajo del umbral requerido para dirigirse a ellas para selección negativa y apoptosis. En consecuencia, estas células continúan madurando y luego saliendo del timo, armadas para inhibir la activación de las células T autorreactivas.
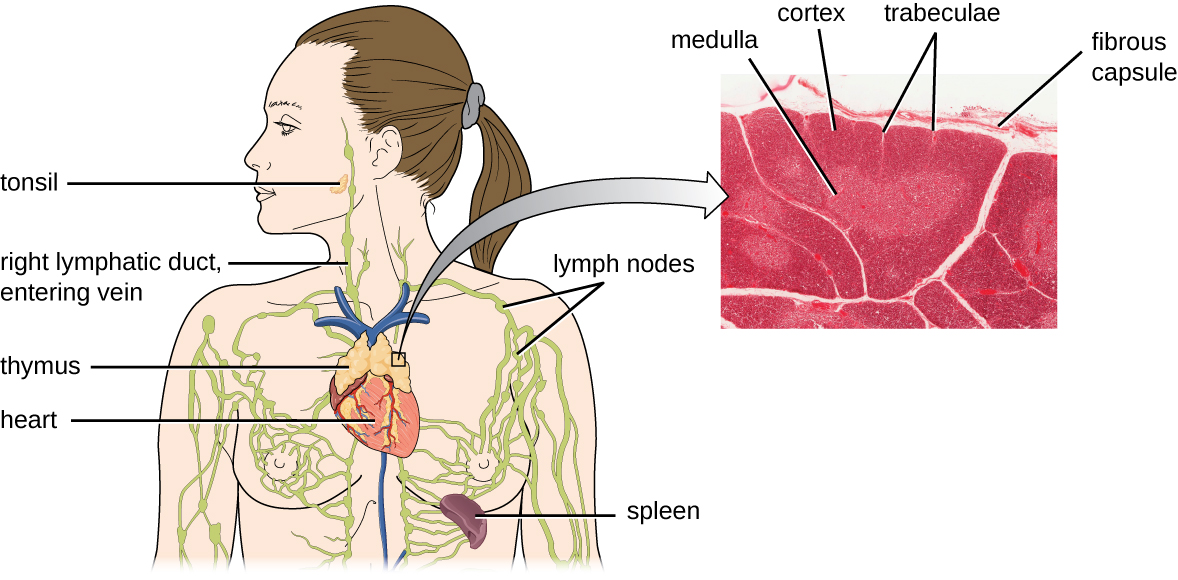
Se ha estimado que los tres pasos de selección tímica eliminan 98% de timocitos. El 2% restante que sale del timo migra a través del torrente sanguíneo y el sistema linfático a sitios de órganos/tejidos linfoides secundarios, como los ganglios linfáticos, el bazo y las amígdalas (Figura\(\PageIndex{3}\)), donde esperan la activación a través de la presentación de antígenos específicos por APC. Hasta que se activan, se les conoce como células T vívidas maduras.
Ejercicio\(\PageIndex{1}\)
- ¿Qué sitios anatómicos están involucrados en la producción y maduración de las células T?
- ¿Cuáles son los tres pasos involucrados en la selección tímica?
- ¿Por qué son importantes la tolerancia central y la tolerancia periférica? ¿Qué impiden?
Clases de células T
Las células T pueden clasificarse en tres clases distintas: células T auxiliares, células T reguladoras y células T citotóxicas. Estas clases se diferencian en función de su expresión de ciertas moléculas superficiales, su modo de activación y sus roles funcionales en la inmunidad adaptativa (Tabla\(\PageIndex{1}\)).
Todas las células T producen moléculas agrupadas de diferenciación (CD), glicoproteínas de la superficie celular que pueden ser utilizadas para identificar y distinguir entre los diversos tipos de glóbulos blancos. Aunque las células T pueden producir una variedad de moléculas de CD, CD4 y CD8 son las dos más importantes utilizadas para la diferenciación de las clases. Las células T colaboradoras y las células T reguladoras se caracterizan por la expresión de CD4 en su superficie, mientras que las células T citotóxicas se caracterizan por la expresión de CD8.
Las clases de células T también pueden distinguirse por las moléculas específicas del MHC y las APCs con las que interactúan para su activación. Las células T auxiliares y las células T reguladoras solo pueden ser activadas por las APCs que presentan antígenos asociados con el MHC II. En contraste, las células T citotóxicas reconocen antígenos presentados en asociación con MHC I, ya sea por APC o por células nucleadas infectadas con un patógeno intracelular.
Las diferentes clases de células T también juegan diferentes roles funcionales en el sistema inmune. Las células T auxiliares sirven como orquestadores centrales que ayudan a activar y dirigir las funciones de la inmunidad humoral y celular. Además, las células T auxiliares potencian las funciones matadoras de patógenos de los macrófagos y las células NK de inmunidad innata. Por el contrario, el papel principal de las células T reguladoras es prevenir respuestas inmunitarias indeseables y potencialmente dañinas. Su papel en la tolerancia periférica, por ejemplo, protege contra los trastornos autoinmunes, como se discutió anteriormente. Finalmente, las células T citotóxicas son las células efectoras primarias para la inmunidad celular. Reconocen y se dirigen a las células que han sido infectadas por patógenos intracelulares, destruyendo las células infectadas junto con los patógenos en su interior.
| Clase | Moléculas CD de superficie | Activación | Funciones |
|---|---|---|---|
| Células T auxiliares | CD4 | APCs que presentan antígenos asociados a MHC II | Orquestar la inmunidad humoral y celular |
| Involucrados en la activación de macrófagos y células NK | |||
| Células T reguladoras | CD4 | APCs que presentan antígenos asociados a MHC II | Involucrados en tolerancia periférica y prevención de respuestas autoinmunes |
| células T citotóxicas | CD8 | APC o células nucleadas infectadas que presentan antígenos asociados a MHC I | Destruir células infectadas con patógenos intracelulares |
Ejercicio\(\PageIndex{2}\)
- ¿Cuáles son las funciones únicas de las tres clases de células T?
- ¿Qué células T pueden ser activadas por antígenos presentados por células distintas de las APC?
Receptores de células T
Tanto para las células T colaboradoras como para las células T citotóxicas, la activación es un proceso complejo que requiere las interacciones de múltiples moléculas y la exposición a citocinas. El receptor de células T (TCR) participa en la primera etapa del reconocimiento de epítopos patógenos durante el proceso de activación.
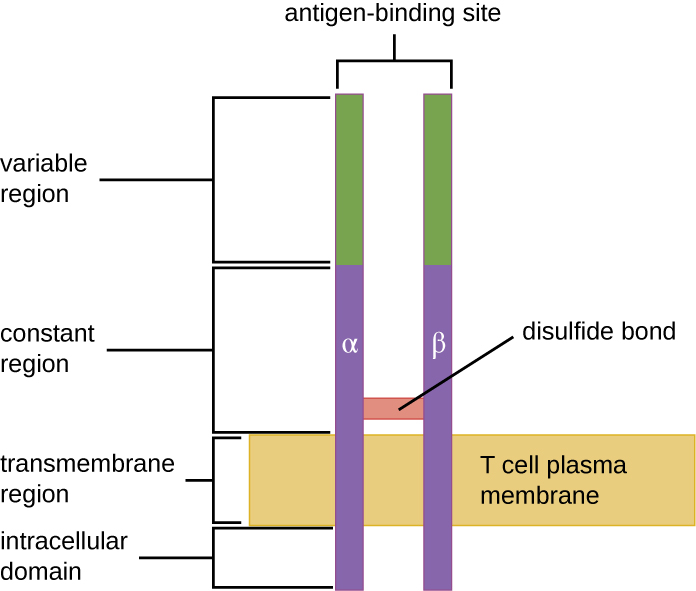
El TCR proviene de la misma familia de receptores que los anticuerpos IgD e IgM, los receptores de antígeno en la superficie de la membrana de las células B, y por lo tanto comparte elementos estructurales comunes. Similar a los anticuerpos, el TCR tiene una región variable y una región constante, y la región variable proporciona el sitio de unión al antígeno (Figura\(\PageIndex{4}\)). Sin embargo, la estructura del TCR es más pequeña y menos compleja que las moléculas de inmunoglobulina (Figura 18.1.4). Mientras que las inmunoglobulinas tienen cuatro cadenas peptídicas y estructuras en forma de Y, el TCR consiste en solo dos cadenas peptídicas (cadenas α y β), las cuales abarcan la membrana citoplasmática de la célula T.
Los TCR son específicos de epítopos, y se ha estimado que se requieren 25 millones de células T con TCR únicos de unión a epítopos para proteger a un individuo contra una amplia gama de patógenos microbianos. Debido a que el genoma humano sólo contiene alrededor de 25.000 genes, sabemos que cada TCR específico no puede ser codificado por su propio conjunto de genes. Esto plantea la cuestión de cómo se puede lograr una población tan vasta de células T con millones de TCR específicos. La respuesta es un proceso llamado reordenamiento genético, que ocurre en el timo durante el primer paso de la selección tímica.
Los genes que codifican para las regiones variables del TCR se dividen en distintos segmentos génicos llamados segmentos variables (V), diversidad (D) y unión (J). Los segmentos de genes asociados con la cadena α del TCR consisten en 70 o más segmentos V α diferentes y 61 segmentos J α diferentes. Los segmentos génicos asociados a la cadena β del TCR constan de 52 segmentos V β diferentes, dos segmentos D β diferentes y 13 segmentos J β diferentes. Durante el desarrollo del TCR funcional en el timo, el reordenamiento genético en una célula T reúne un segmento V α y un segmento J α para codificar la región variable de la cadena α. De manera similar, el reordenamiento genético reúne uno de los segmentos V β junto con uno de los segmentos D β y uno de los segmentos EtJ β para codificar la región variable de la cadena β. Todas las posibles combinaciones de reordenamientos entre diferentes segmentos de V, D y J proporcionan la diversidad genética requerida para producir millones de TCR con regiones variables específicas de epítopos únicos.
Ejercicio\(\PageIndex{3}\)
- ¿Cuáles son las similitudes y diferencias entre los TCR y las inmunoglobulinas?
- ¿Qué proceso se utiliza para proporcionar millones de sitios únicos de unión a TCR?
Activación y diferenciación de células T auxiliares
Las células T auxiliares solo pueden ser activadas por las APCs que presentan epítopos foráneos procesados en asociación con MHC II. El primer paso en el proceso de activación es el reconocimiento por TCR del epítopo foráneo específico presentado dentro de la hendidura de unión al antígeno MHC II. La segunda etapa implica la interacción de CD4 en la célula T auxiliar con una región de la molécula MHC II separada de la hendidura de unión al antígeno. Esta segunda interacción ancla el complejo MHC II-TCR y asegura que la célula T auxiliar esté reconociendo tanto el epítopo extraño (“no propio”) como el antígeno “propio” de la APC; ambos reconocimientos son necesarios para la activación de la célula. En la tercera etapa, la APC y la célula T secretan citocinas que activan la célula T colaboradora. La célula T auxiliar activada luego prolifera, dividiéndose por mitosis para producir linfocitos T cooperadores clonales que se diferencian en subtipos con diferentes funciones (Figura\(\PageIndex{5}\)).
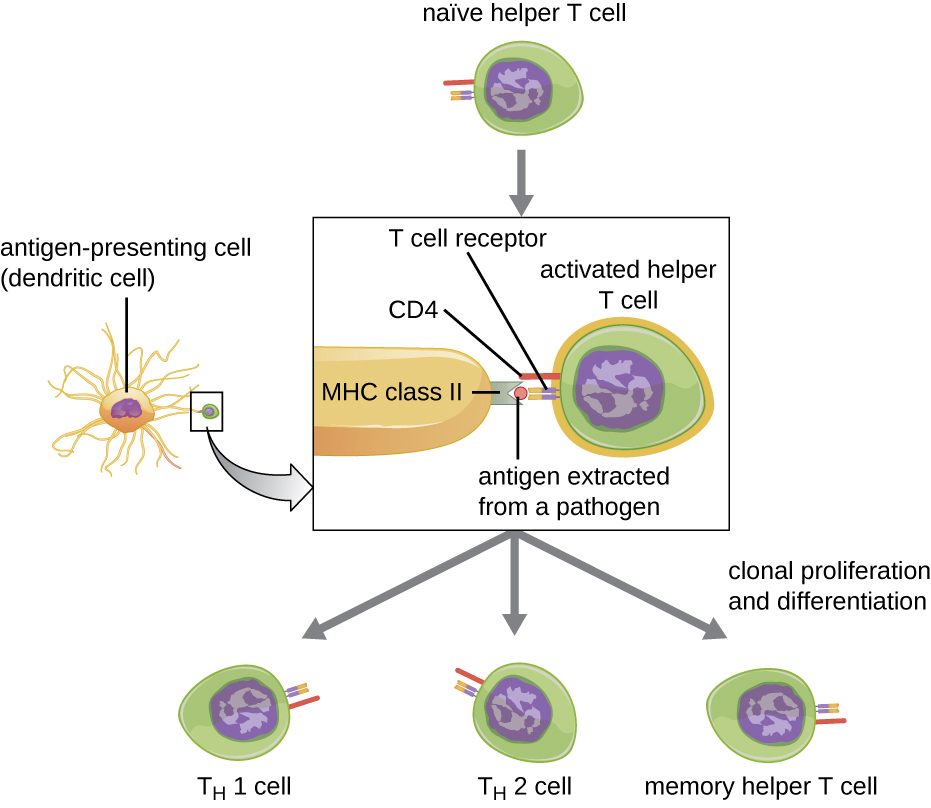
Las células T auxiliares activadas pueden diferenciarse en uno de cuatro subtipos distintos, resumidos en la Tabla\(\PageIndex{2}\). El proceso de diferenciación está dirigido por citocinas secretadas por APC. Dependiendo de qué citocinas secretadas por APC interaccionen con una célula T auxiliar activada, la célula puede diferenciarse en una célula T auxiliar 1 (TH 1), una célula T auxiliar 2 (T H 2) o una célula T auxiliar de memoria. Los dos tipos de células T colaboradoras son células efectoras de vida relativamente corta, lo que significa que realizan diversas funciones de la respuesta inmune inmediata. En contraste, las células T colaboradoras de memoria tienen una vida relativamente larga; están programadas para “recordar” un antígeno o epítopo específico con el fin de montar una respuesta rápida, fuerte y secundaria a exposiciones posteriores.
Las células T H 1 secretan sus propias citocinas que están involucradas en la estimulación y orquestación de otras células involucradas en la inmunidad adaptativa e innata. Por ejemplo, estimulan las células T citotóxicas, potenciando su destrucción de células infectadas y promoviendo la diferenciación en células T citotóxicas de memoria. Las células T H 1 también estimulan a los macrófagos y neutrófilos para que sean más efectivos en su destrucción de bacterias intracelulares. También pueden estimular a las células NK para que sean más efectivas en la destrucción de las células diana.
Las células T H 2 juegan un papel importante en la orquestación de la respuesta inmune humoral a través de su secreción de citocinas que activan las células B y dirigen la diferenciación de las células B y la producción de anticuerpos. Varias citocinas producidas por las células T H 2 orquestan el cambio de clase de anticuerpos, lo que permite que las células B cambien entre la producción de IgM, IgG, IgA e IgE según sea necesario para llevar a cabo funciones específicas de anticuerpos y proporcionar respuestas inmunitarias humorales específicas de patógenos.
Se descubrió un tercer subtipo de células T colaboradoras llamadas células T H 17 a través de observaciones de que la inmunidad a algunas infecciones no está asociada con células T H 1 o T H 2. Las células T H 17 y las citocinas que producen parecen ser específicamente responsables de la defensa del organismo contra las infecciones mucocutáneas crónicas. Los pacientes que carecen de suficientes células T H 17 en la mucosa (p. ej., pacientes con VIH) pueden ser más susceptibles a bacteriemia e infecciones gastrointestinales. 1
| Subtipo | Funciones |
|---|---|
| Celdas T H 1 | Estimular las células T citotóxicas y producir células T citot |
| Estimular los macrófagos y neutrófilos (PMN) para una destrucción intracelular más efectiva de patógenos | |
| Estimular a las células NK para que destruyan | |
| T H 2 celdas | Estimular la activación y diferenciación de células B en células plasmáticas y células B de memoria |
| Cambio directo de clase de anticuerpos en células B | |
| T H 17 celdas | Estimular la inmunidad a infecciones específicas como infecciones mucocutáneas crónicas |
| Células T auxiliares de memoria | “Recordar” un patógeno específico y montar una respuesta secundaria fuerte y rápida tras la reexposición |
Activación y diferenciación de células T citotóxicas
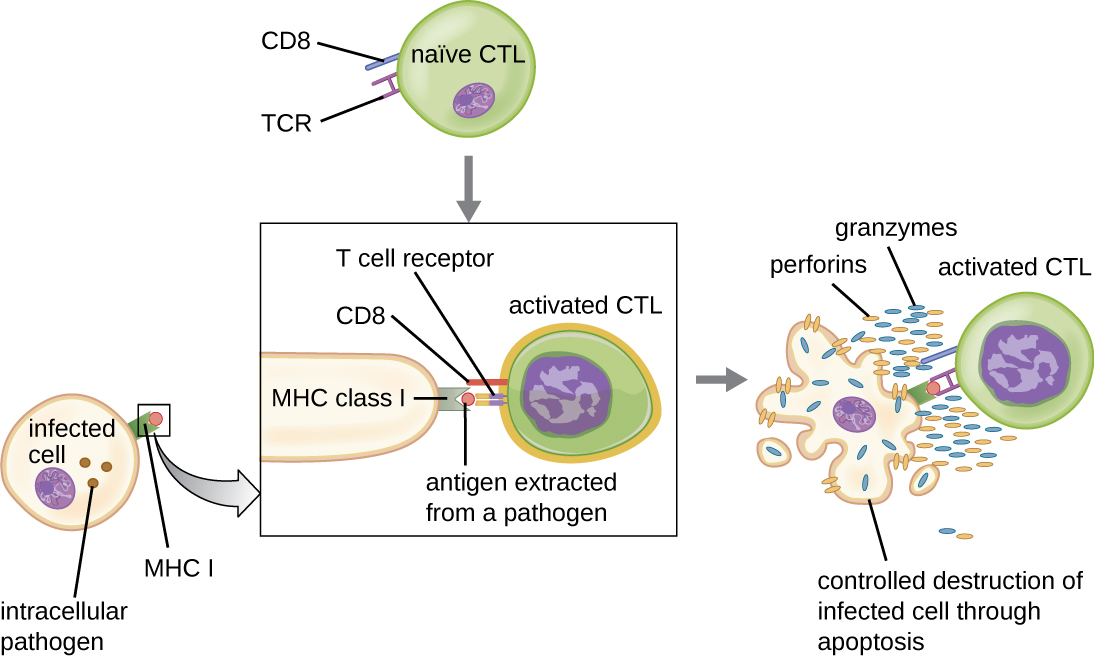
Las células T citotóxicas (también denominadas linfocitos T citotóxicos, o CTL) son activadas por APC en un proceso de tres etapas similar al de las células T colaboradoras. La diferencia clave es que la activación de células T citotóxicas implica el reconocimiento de un antígeno presentado con MHC I (a diferencia de MHC II) y la interacción de CD8 (a diferencia de CD4) con el complejo receptor. Después del co-reconocimiento exitoso de epítopo extraño y autoantígeno, la producción de citocinas por la APC y la célula T citotóxica activan la proliferación y diferenciación clonal. Las células T citotóxicas activadas pueden diferenciarse en células T citotóxicas efectoras que se dirigen a patógenos para destrucción o células de memoria que están listas para responder a exposiciones posteriores
Como se ha señalado, la proliferación y diferenciación de células T citotóxicas también es estimulada por citocinas secretadas por células T H1 activadas por el mismo epítopo extraño. La coestimulación que proviene de estas células T H 1 es proporcionada por citocinas secretadas. Aunque es posible que la activación de las células T citotóxicas se produzca sin estimulación de las células T H 1, la activación no es tan efectiva ni duradera.
Una vez activadas, las células T citotóxicas sirven como células efectoras de la inmunidad celular, reconociendo y destruyendo células infectadas con patógenos intracelulares a través de un mecanismo muy similar al de las células NK. Sin embargo, mientras que las células NK reconocen señales inespecíficas de estrés o anormalidad celular, las células T citotóxicas reconocen células infectadas a través de la presentación de antígenos de epítopos específicos de patógenos asociados con MHC I. Una vez que se reconoce una célula infectada, el TCR de la célula T citotóxica se une al epítopo y libera perforina y granzimas que destruyen la célula infectada (Figura\(\PageIndex{6}\)). La perforina es una proteína que crea poros en la célula diana, y las granzimas son proteasas que ingresan a los poros e inducen apoptosis. Este mecanismo de muerte celular programada es un medio controlado y eficiente de destruir y eliminar las células infectadas sin liberar los patógenos en su interior para infectar las células vecinas, como podría ocurrir si las células infectadas fueran simplemente lisadas.
En este video, se puede ver una célula T citotóxica que induce apoptosis en una célula diana.
Ejercicio\(\PageIndex{4}\)
- Comparar y contrastar la activación de células T auxiliares y células T citotóxicas.
- ¿Cuáles son las diferentes funciones de los subtipos de células T auxiliares?
- ¿Cuál es el mecanismo de destrucción mediada por CTL de células infectadas?
Superantígenos y activación no regulada de células T
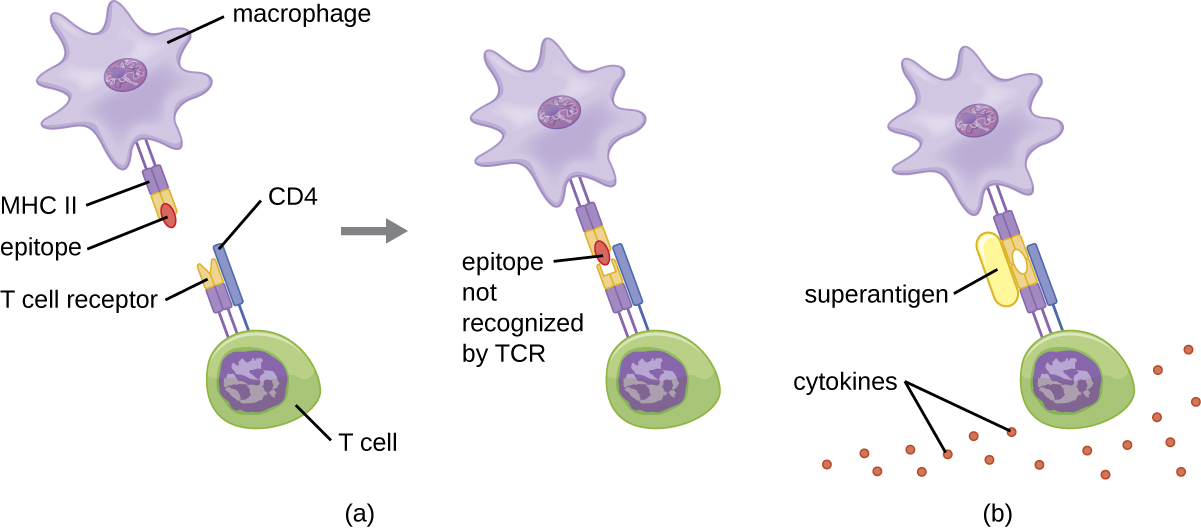
Cuando se controla y regula la activación de las células T, el resultado es una respuesta protectora que es efectiva para combatir infecciones. Sin embargo, si la activación de las células T no está regulada y es excesiva, el resultado puede poner en peligro la vida. Ciertos patógenos bacterianos y virales producen toxinas conocidas como superantígenos (ver Factores de Virulencia de Patógenos Bacterianos y Virales) que pueden desencadenar tal respuesta no regulada. Los superantígenos bacterianos conocidos incluyen la toxina del síndrome de choque tóxico (TSST), las enterotoxinas estafilocócicas, las toxinas pirogénicas estreptocócicas, el superantígeno estreptocócico y la exotoxina mitogénica estreptocócica. Los virus conocidos por producir superantígenos incluyen el virus de Epstein-Barr (herpesvirus humano 4), el citomegalovirus (herpesvirus humano 5) y otros.
El mecanismo de activación de células T por superantígenos implica su unión simultánea a moléculas MHC II de APC y la región variable de la cadena β del TCR. Esta unión ocurre fuera de la hendidura de unión a antígeno del MHC II, por lo que el superantígeno se unirá y activará MHC II y TCR sin reconocimiento específico de epítopos extraños (Figura\(\PageIndex{7}\)). El resultado es una liberación excesiva e incontrolada de citocinas, a menudo llamada tormenta de citocinas, que estimula una respuesta inflamatoria excesiva. Esto puede llevar a una peligrosa disminución de la presión arterial, shock, falla multiorgánica y potencialmente, la muerte.
Ejercicio\(\PageIndex{5}\)
- ¿Cuáles son los ejemplos de superantígenos?
- ¿Cómo activa un superantígeno una célula T auxiliar?
- ¿Qué efecto tiene un superantígeno en una célula T?
Caso en Punto: Superantígenos
Melissa, una mujer de 22 años por lo demás sana, es llevada a la sala de emergencias por su preocupado novio. Se queja de una aparición repentina de fiebre alta, vómitos, diarrea y dolores musculares. En su entrevista inicial, le dice al médico tratante que está tomando anticonceptivos hormonales y además está a dos días de la porción de menstruación de su ciclo. Ella no está tomando otros medicamentos y no está abusando de ninguna droga o alcohol. Ella no es fumadora. No es diabética y actualmente no tiene una infección de ningún tipo que sepa.
Mientras espera en la sala de emergencias, la presión arterial de Melissa comienza a bajar drásticamente y su estado mental se deteriora a confusión general. El médico cree que es probable que padezca síndrome de shock tóxico (TSS). El TSS es causado por la toxina TSST-1, un superantígeno asociado a Staphylococcus aureus, y el uso inadecuado de tampones es una causa común de infecciones que conducen a TSS. El superantígeno estimula de manera inapropiada la activación generalizada de las células T y la liberación excesiva de citocinas, dando como resultado una respuesta inflamatoria masiva y sistémica que puede ser fatal.
Se pueden tomar hisopos vaginales o cervicales para confirmar la presencia del microbio, pero estas pruebas no son críticas para realizar en función de los síntomas y el historial médico de Melissa. El médico prescribe rehidratación, terapia de apoyo y antibióticos para detener la infección bacteriana. También le receta medicamentos para aumentar la presión arterial de Melissa. Melissa pasa tres días en el hospital bajo tratamiento; además, su función renal es monitoreada por el alto riesgo de insuficiencia renal asociada al SST. Después de 72 horas, Melissa está lo suficientemente bien como para ser dada de alta para continuar su recuperación en su casa.
Ejercicio\(\PageIndex{6}\)
¿De qué manera la terapia antibiótica ayudaría a combatir un superantígeno?
Enfoque Clínico: Parte 2
Los ganglios linfáticos inflamados de Olivia, el abdomen y el bazo sugieren una fuerte respuesta inmune a una infección sistémica en progreso. Además, la pequeña Olivia se muestra reacia a girar la cabeza y parece estar experimentando un intenso dolor de cuello. El médico ordena un hemograma completo, hemocultivo y punción lumbar. El líquido cefalorraquídeo (LCR) obtenido aparece turbio y se evalúa posteriormente mediante la evaluación de la tinción Gram y el cultivo de posibles patógenos bacterianos. El hemograma completo indica números elevados de glóbulos blancos en el torrente sanguíneo de Olivia. Los aumentos de glóbulos blancos se registran a 28.5 K/µL (rango normal: 6.0—17.5 K/µL). El porcentaje de neutrófilos se registró como 60% (rango normal: 23— 45%). Los niveles de glucosa en el LCR se registraron en 30 mg/100 mL (rango normal: 50—80 mg/100 mL). El recuento de glóbulos blancos en el LCR fue de 1,163/mm3 (rango normal: 5—20/mm 3).
Ejercicio\(\PageIndex{7}\)
- Con base en estos resultados, ¿tiene un diagnóstico preliminar?
- ¿Cuál es un tratamiento recomendado basado en este diagnóstico preliminar?
Conceptos clave y resumen
- Los linfocitos T inmaduros se producen en la médula ósea roja y viajan al timo para su maduración.
- La selección tímica es un proceso de tres pasos de selección negativa y positiva que determina qué células T madurarán y saldrán del timo hacia el torrente sanguíneo periférico.
- La tolerancia central implica la selección negativa de las células T autorreactivas en el timo, y la tolerancia periférica implica la anergia y las células T reguladoras que previenen las respuestas inmunitarias autorreactivas y la autoinmunidad.
- El TCR es similar en estructura a las inmunoglobulinas, pero menos complejo. Millones de TCR únicos de unión a epítopos se codifican a través de un proceso de reordenamiento genético de los segmentos génicos V, D y J.
- Las células T se pueden dividir en tres clases —células T colaboradoras, células T citotóxicas y células T reguladoras— en función de su expresión de CD4 o CD8, las moléculas del MHC con las que interactúan para la activación y sus respectivas funciones.
- Las células T colaboradoras activadas se diferencian en subtipos de células T H 1, T H 2, T H 17 o células T de memoria. La diferenciación está dirigida por las citocinas específicas a las que están expuestas. T H 1, T H 2 y T H 17 realizan diferentes funciones relacionadas con la estimulación de defensas inmunes adaptativas e innatas. Las células T de memoria son células de larga vida que pueden responder rápidamente a exposiciones secundarias.
- Una vez activadas, las células T citotóxicas se dirigen y matan a las células infectadas con La matanza requiere el reconocimiento de epítopos patógenos específicos presentados en la superficie celular usando moléculas MHC I. La matanza está mediada por perforina y granzimas que inducen apoptosis.
- Los superantígenos son proteínas bacterianas o virales que provocan una activación inespecífica de las células T colaboradoras, lo que lleva a una liberación excesiva de citocinas (tormenta de citocinas) y una respuesta inflamatoria sistémica, potencialmente mortal.
Notas al pie
- 1 Blaschitz C., Raffatellu M. “Las citocinas Th17 y la barrera mucosa intestinal”. J Clin Immunol. 2010 mar; 30 (2) :196-203. doi: 10.1007/s10875-010-9368-7.


