18.5: Vacunas
- Page ID
- 54672
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Compara los distintos tipos de inmunidad artificial
- Diferenciar entre variolación y vacunación
- Describir diferentes tipos de vacunas y explicar sus respectivas ventajas y desventajas
Para muchas enfermedades, la prevención es la mejor forma de tratamiento, y pocas estrategias para la prevención de enfermedades son tan efectivas como la vacunación. La vacunación es una forma de inmunidad artificial. Al estimular artificialmente las defensas inmunitarias adaptativas, una vacuna desencadena una producción de células de memoria similar a la que ocurriría durante una respuesta primaria. Al hacerlo, el paciente es capaz de montar una respuesta secundaria fuerte tras la exposición al patógeno, pero sin tener que sufrir primero una infección inicial. En esta sección, exploraremos varios tipos diferentes de inmunidad artificial junto con diversos tipos de vacunas y los mecanismos por los cuales inducen la inmunidad artificial.
Clasificaciones de la inmunidad adaptativa
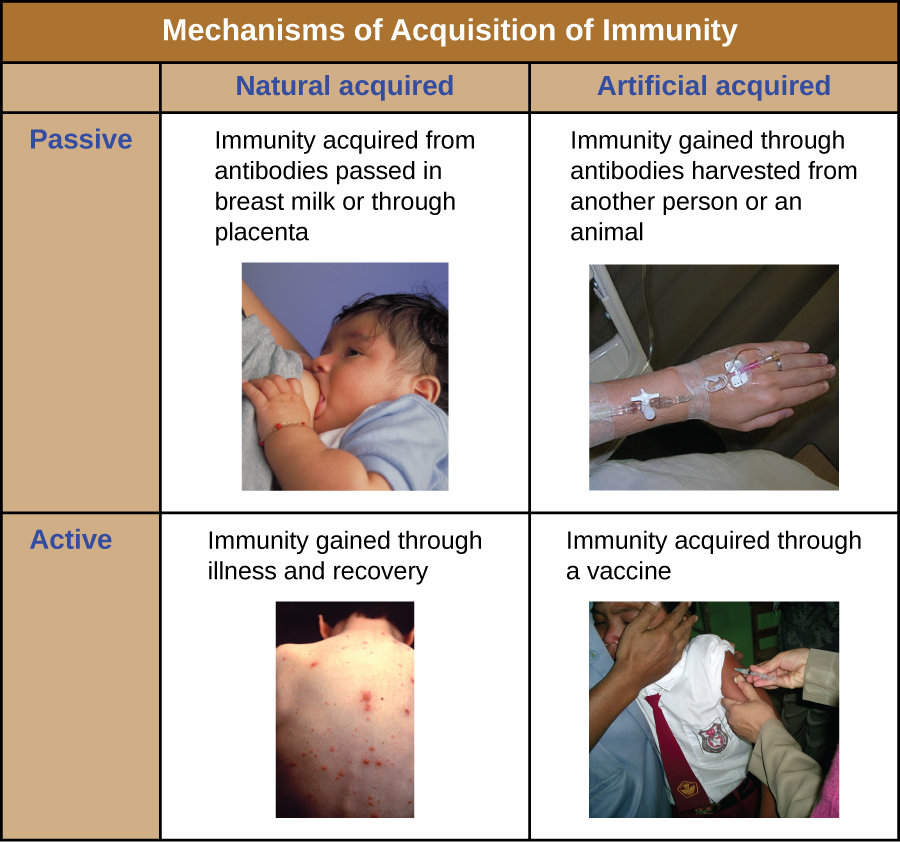
Todas las formas de inmunidad adaptativa pueden describirse como activas o pasivas. La inmunidad activa se refiere a la activación de las propias defensas inmunitarias adaptativas de un individuo, mientras que la inmunidad pasiva se refiere a la transferencia de defensas inmunitarias adaptativas de otro individuo o animal. La inmunidad activa y pasiva puede subdividirse aún más en función de si la protección se adquiere natural o artificialmente.
La inmunidad activa natural es la inmunidad adaptativa que se desarrolla después de la exposición natural a un patógeno (Figura\(\PageIndex{1}\)). Los ejemplos incluirían la inmunidad de por vida que se desarrolla después de la recuperación de una infección por varicela o sarampión (aunque no siempre es necesaria una infección aguda para activar la inmunidad adaptativa). El período de tiempo que un individuo está protegido puede variar sustancialmente dependiendo del patógeno y antígenos involucrados. Por ejemplo, la activación de la inmunidad adaptativa por estructuras de picos proteicos durante una infección viral intracelular puede activar la inmunidad de por vida, mientras que la activación por antígenos de cápsulas de carbohidratos durante una infección bacteriana extracelular puede activar la inmunidad a corto plazo.
La inmunidad pasiva natural implica el paso natural de anticuerpos de una madre a su hijo antes y después del nacimiento. La IgG es la única clase de anticuerpos que puede atravesar la placenta desde la sangre de la madre hasta el suministro de sangre fetal. La transferencia placentaria de IgG es una importante defensa inmune pasiva para el lactante, que dura hasta seis meses después del nacimiento. La IgA secretora también se puede transferir de la madre al lactante a través de la leche materna.
La inmunidad pasiva artificial se refiere a la transferencia de anticuerpos producidos por un donante (humano o animal) a otro individuo. Esta transferencia de anticuerpos puede realizarse como medida profiláctica (es decir, para prevenir enfermedades después de la exposición a un patógeno) o como estrategia para tratar una infección activa. Por ejemplo, la inmunidad pasiva artificial se usa comúnmente para la profilaxis posterior a la exposición contra la rabia, la hepatitis A, la hepatitis B y la varicela (en individuos de alto riesgo). Las infecciones activas tratadas por inmunidad pasiva artificial incluyen infecciones por citomegalovirus en pacientes inmunocomprometidos e infecciones por el virus del Ébola. En 1995, ocho pacientes en la República Democrática del Congo con infecciones activas por ébola fueron tratados con transfusiones de sangre de pacientes que se estaban recuperando del ébola. Solo uno de los ocho pacientes murió (una tasa de mortalidad de 12.5%), que fue muy inferior a la tasa de mortalidad esperada de 80% por ébola en pacientes no tratados. 1 La inmunidad pasiva artificial también se utiliza para el tratamiento de enfermedades causadas por toxinas bacterianas, como el tétanos, el botulismo y la difteria.
La inmunidad activa artificial es la base de la vacunación. Implica la activación de la inmunidad adaptativa a través de la exposición deliberada de un individuo a patógenos debilitados o inactivados, o preparaciones consistentes en antígenos patógenos clave.
Ejercicio\(\PageIndex{1}\)
- ¿Cuál es la diferencia entre inmunidad activa y pasiva?
- ¿Qué tipo de inmunidad confiere una vacuna?
Inmunidad de rebaño
Los cuatro tipos de inmunidad que se acaban de describir son el resultado del sistema inmune adaptativo de un individuo. Para cualquier enfermedad dada, un individuo puede ser considerado inmune o susceptible dependiendo de su capacidad para montar una respuesta inmune efectiva tras la exposición. Por lo tanto, es probable que cualquier población dada tenga algunos individuos que son inmunes y otros individuos que son susceptibles. Si una población tiene muy pocos individuos susceptibles, incluso esos individuos susceptibles estarán protegidos por un fenómeno llamado inmunidad colectiva. La inmunidad colectiva no tiene nada que ver con la capacidad de un individuo para montar una respuesta inmune efectiva; más bien, ocurre porque hay muy pocos individuos susceptibles en una población para que la enfermedad se propague de manera efectiva.
Los programas de vacunación crean inmunidad colectiva al reducir en gran medida el número de individuos susceptibles en una población. Aunque algunos individuos de la población no estén vacunados, siempre y cuando un cierto porcentaje sea inmune (ya sea natural o artificialmente), es poco probable que los pocos individuos susceptibles estén expuestos al patógeno. Sin embargo, debido a que los nuevos individuos ingresan constantemente a las poblaciones (por ejemplo, por nacimiento o reubicación), los programas de vacunación son necesarios para mantener la inmunidad del rebaño.
Vacunación: Obligación o Elección
Un número creciente de padres optan por no vacunar a sus hijos. Se les llama “antivaxxers”, y la mayoría de ellos cree que las vacunas son una causa de autismo (u otras afecciones), un vínculo que ahora ha sido completamente desprobado. Otros se oponen a las vacunas por motivos religiosos o morales (por ejemplo, el argumento de que la vacunación Gardasil contra el VPH puede promover la promiscuidad sexual), por razones éticas personales (por ejemplo, una objeción de conciencia a cualquier intervención médica), o por razones políticas (por ejemplo, la noción de que las vacunas obligatorias son un violación de las libertades individuales). 2
Se cree que este creciente número de individuos no vacunados ha provocado nuevos brotes de tos ferina y sarampión. Esperaríamos que la inmunidad colectiva proteja a quienes no están vacunados en nuestra población, pero la inmunidad de rebaño solo se puede mantener si se están vacunando suficientes individuos.
La vacunación es claramente beneficiosa para la salud pública. Pero desde la perspectiva del padre individual la visión puede ser más turbia. Las vacunas, como todas las intervenciones médicas, tienen riesgos asociados, y si bien los riesgos de vacunación pueden ser extremadamente bajos en comparación con los riesgos de infección, es posible que los padres no siempre comprendan o acepten el consenso de la comunidad médica. ¿Dichos padres tienen derecho a retener la vacunación a sus hijos? ¿Se les debe permitir poner en riesgo a sus hijos y a la sociedad en general?
Muchos gobiernos insisten en las vacunas infantiles como condición para ingresar a la escuela pública, pero en la mayoría de los estados se ha vuelto fácil optar por no recibir el requisito o mantener a los niños fuera del sistema público. Desde la década de 1970, Virginia Occidental y Mississippi han tenido un estricto requisito para la vacunación infantil, sin excepciones, y ninguno de los estados ha tenido un caso de sarampión desde principios de la década de 1990. Los legisladores de California aprobaron recientemente una ley similar en respuesta a un brote de sarampión en 2015, lo que dificulta mucho más que los padres opten por no recibir vacunas si sus hijos asisten a escuelas públicas. Ante esta trayectoria y renovados esfuerzos legislativos, ¿deberían otros estados adoptar requisitos igualmente estrictos?
¿Qué papel deben desempeñar los proveedores de atención de salud en la promoción o aplicación de la vacunación universal? Los estudios han demostrado que la mente de muchos padres se puede cambiar en respuesta a la información que brindan los trabajadores de la salud, pero ¿es el lugar de los trabajadores de la salud tratar de persuadir a los padres de que vacunen a sus hijos? Algunos proveedores de atención médica son comprensiblemente reacios a tratar a pacientes no vacunados. ¿Tienen derecho a rechazar el servicio a los pacientes que declinan las vacunas? ¿Las compañías de seguros tienen derecho a denegar cobertura a los antivaxxers? Todas estas son cuestiones éticas que los formuladores de políticas pueden verse obligados a abordar a medida que más padres burlan las normas de vacunación.
Variolación y Vacunación
Hace miles de años, se reconoció por primera vez que los individuos que sobrevivieron a una infección de viruela eran inmunes a infecciones posteriores. La práctica de inocular individuos para protegerlos activamente de la viruela parece haberse originado en el siglo X en China, cuando se describió la práctica de la variolación (Figura\(\PageIndex{2}\)). La variolación se refiere a la inoculación deliberada de individuos con material infeccioso de costras o pústulas de víctimas de viruela. Los materiales infecciosos se inyectaron en la piel o se introdujeron por vía nasal. La infección que se desarrolló fue generalmente más leve que la viruela adquirida naturalmente, y la recuperación de la infección más leve brindó protección contra la enfermedad más grave.
Aunque la mayoría de los individuos tratados por variolación desarrollaron solo infecciones leves, la práctica no estuvo exenta de riesgos. Se presentaron infecciones más graves y a veces fatales, y debido a que la viruela es contagiosa, las infecciones resultantes de la variolación podrían llevar a epidemias. Aun así, la práctica de la variolación para la prevención de la viruela se extendió a otras regiones, entre ellas India, África y Europa.

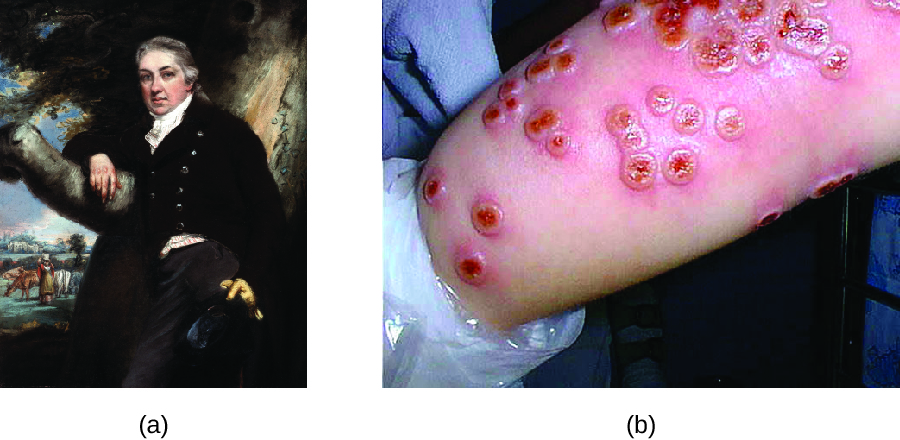
Aunque la variolación se había practicado durante siglos, al médico inglés Edward Jenner (1749—1823) generalmente se le atribuye el desarrollo del proceso moderno de vacunación. Jenner observó que las lecheras que desarrollaron viruela vacuna, una enfermedad similar a la viruela pero más leve, eran inmunes a la viruela más grave. Esto llevó a Jenner a plantear la hipótesis de que la exposición a un patógeno menos virulento podría proporcionar protección inmune contra un patógeno más virulento, proporcionando una alternativa más segura a la variolación. En 1796, Jenner probó su hipótesis obteniendo muestras infecciosas de una lesión activa de viruela de vaca de lechera e inyectando los materiales a un niño (Figura\(\PageIndex{3}\)). El niño desarrolló una infección leve que incluyó fiebre de bajo grado, molestias en las axilas (axila) y pérdida de apetito. Cuando el niño fue posteriormente infectado con muestras infecciosas de lesiones de viruela, no contrajo viruela. 3 Este nuevo enfoque se denominó vacunación, nombre derivado del uso de la viruela vacuna (latín vacca que significa “vaca”) para proteger contra la viruela. Hoy en día, sabemos que la vacuna de Jenner funcionó porque el virus de la viruela vacuna está genética y antigénicamente relacionado con los virus de la variola que causaron la viruela. La exposición a antígenos de la viruela de vaca resultó en una respuesta primaria y la producción de células de memoria que idénticos o relacionados epítopos del virus de la variola tras una exposición posterior a la viruela.
El éxito de la vacunación contra la viruela de Jenner llevó a otros científicos a desarrollar vacunas para otras enfermedades. Quizás el más notable fue Louis Pasteur, quien desarrolló vacunas contra la rabia, el cólera y el ántrax. Durante los siglos XX y XXI, se desarrollaron vacunas efectivas para prevenir una amplia gama de enfermedades causadas por virus (por ejemplo, varicela y herpes zóster, hepatitis, sarampión, paperas, polio y fiebre amarilla) y bacterias (por ejemplo, difteria, neumonía neumocócica, tétanos y ferina tos,).
Ejercicio\(\PageIndex{2}\)
- ¿Cuál es la diferencia entre variolación y vacunación para la viruela?
- Explicar por qué la vacunación es menos riesgosa que la variolación.
Clases de Vacunas
Para que una vacuna brinde protección contra una enfermedad, debe exponer a un individuo a antígenos específicos de patógenos que estimularán una respuesta inmune adaptativa protectora. Por su propia naturaleza, esto conlleva cierto riesgo. Al igual que con cualquier medicamento farmacéutico, las vacunas tienen el potencial de causar efectos adversos. Sin embargo, la vacuna ideal no causa efectos adversos graves y no plantea ningún riesgo de contraer la enfermedad que se pretende prevenir. Se han desarrollado diversos tipos de vacunas con estos objetivos en mente. Estas diferentes clases de vacunas se describen en la siguiente sección y se resumen en la Tabla\(\PageIndex{1}\).
Vacunas Vivas Atenuadas
Las vacunas vivas atenuadas exponen a un individuo a una cepa debilitada de un patógeno con el objetivo de establecer una infección subclínica que activará las defensas inmunitarias adaptativas. Los patógenos se atenúan para disminuir su virulencia utilizando métodos como la manipulación genética (para eliminar factores clave de virulencia) o el cultivo a largo plazo en un hospedador o ambiente no natural (para promover mutaciones y disminuir la virulencia).
Al establecer una infección activa, las vacunas vivas atenuadas estimulan una respuesta inmune más integral que algunos otros tipos de vacunas. Las vacunas vivas atenuadas activan tanto la inmunidad celular como la humoral y estimulan el desarrollo de la memoria para una inmunidad duradera. En algunos casos, la vacunación de un individuo con un patógeno vivo atenuado puede incluso conducir a la transmisión natural del patógeno atenuado a otros individuos. Esto puede hacer que los otros individuos desarrollen también una infección subclínica activa que activa sus defensas inmunitarias adaptativas.
Las desventajas asociadas con las vacunas vivas atenuadas incluyen los desafíos asociados con el almacenamiento y transporte a largo plazo, así como el potencial de que un paciente desarrolle signos y síntomas de enfermedad durante la infección activa (particularmente en pacientes inmunocomprometidos). También existe el riesgo de que el patógeno atenuado vuelva a la virulencia completa. En la\(\PageIndex{1}\) tabla se enumeran ejemplos de vacunas vivas atenuadas.
Vacunas inactivadas
Las vacunas inactivadas contienen patógenos enteros que han sido muertos o inactivados con calor, productos químicos o radiación. Para que las vacunas inactivadas sean efectivas, el proceso de inactivación no debe afectar la estructura de antígenos clave sobre el patógeno.
Debido a que el patógeno está muerto o inactivo, las vacunas inactivadas no producen una infección activa, y la respuesta inmune resultante es más débil y menos completa que la provocada por una vacuna viva atenuada. Por lo general, la respuesta implica solo inmunidad humoral, y el patógeno no puede transmitirse a otros individuos. Además, las vacunas inactivadas suelen requerir dosis más altas y múltiples refuerzos, posiblemente causando reacciones inflamatorias en el sitio de inyección.
A pesar de estas desventajas, las vacunas inactivadas tienen las ventajas de la estabilidad de almacenamiento a largo plazo y la facilidad de transporte. Además, no hay riesgo de causar infecciones activas graves. Sin embargo, las vacunas inactivadas no carecen de sus efectos secundarios. En la\(\PageIndex{1}\) tabla se enumeran ejemplos de vacunas inactivadas.
Vacunas de subunidad
Mientras que las vacunas vivas atenuadas e inactivas exponen a un individuo a un patógeno debilitado o muerto, las vacunas subunitarias solo exponen al paciente a los antígenos clave de un patógeno, no a células enteras o virus. Las vacunas subunitarias se pueden producir degradando químicamente un patógeno y aislando sus antígenos clave o produciendo los antígenos mediante ingeniería genética. Debido a que estas vacunas contienen solo los antígenos esenciales de un patógeno, el riesgo de efectos secundarios es relativamente bajo. La tabla\(\PageIndex{1}\) enumera ejemplos de vacunas subunitarias.
Vacunas Toxoides
Al igual que las vacunas subunitarias, las vacunas toxoides no introducen un patógeno completo al paciente; contienen toxinas bacterianas inactivadas, llamadas toxoides. Las vacunas toxoides se utilizan para prevenir enfermedades en las que las toxinas bacterianas juegan un papel importante en la patogénesis. Estas vacunas activan la inmunidad humoral que neutraliza las toxinas. En la\(\PageIndex{1}\) tabla se enumeran ejemplos de vacunas toxoides.
Vacunas Conjugadas
Una vacuna conjugada es un tipo de vacuna de subunidad que consiste en una proteína conjugada con un polisacárido de cápsula. Se han desarrollado vacunas conjugadas para potenciar la eficacia de las vacunas subunitarias contra patógenos que tienen cápsulas protectoras de polisacáridos que les ayudan a evadir la fagocitosis, provocando infecciones invasivas que pueden conducir a meningitis y otros padecimientos graves. Las vacunas subunitarias contra estos patógenos introducen antígenos polisacáridos capsulares independientes de T que dan como resultado la producción de anticuerpos que pueden opsonizar la cápsula y así combatir la infección; sin embargo, los niños menores de dos años no responden eficazmente a estas vacunas. Los niños sí responden eficazmente cuando se vacunan con la vacuna conjugada, en la que una proteína con antígenos T-dependientes se conjuga con el polisacárido de la cápsula. El antígeno conjugado proteína-polisacárido estimula la producción de anticuerpos tanto contra la proteína como contra el polisacárido de la cápsula. En la\(\PageIndex{1}\) tabla se enumeran ejemplos de vacunas conjugadas.
| Clase | Descripción | Ventajas | Desventajas | Ejemplos |
|---|---|---|---|---|
| Vivo atenuado | Cepa debilitada de patógeno completo | Inmunidad celular y humoral | Difícil de almacenar y transportar | Varicela, sarampión alemán, sarampión, paperas, tuberculosis, fiebre tifoidea, fiebre amarilla |
| Inmunidad de larga duración | Riesgo de infección en pacientes inmunocomprometidos | |||
| Transmisión a contactos | Riesgo de reversión | |||
| Inactivado | Patógeno completo muerto o inactivado con calor, productos químicos o radiación | Facilidad de almacenamiento y transporte | Inmunidad más débil (solo humoral) | Cólera, hepatitis A, influenza, peste, rabia |
| Sin riesgo de infección activa grave | Se requieren dosis más altas y más potenciadores | |||
| Subunidad | Antígenos inmunógenos | Menor riesgo de efectos secundarios | Longevidad limitada | Ántrax, hepatitis B, influenza, meningitis, virus del papiloma, neumonía neumocócica, tos ferina |
| Se requieren múltiples dosis | ||||
| Sin protección contra la variación antigénica | ||||
| Toxoide | Toxina bacteriana inactivada | Inmunidad humoral para neutralizar la toxina | No previene la infección | Botulismo, difteria, tos ferina, tétanos |
| Conjugado | Cápsula polisacárida conjugada a proteína | Respuesta dependiente de T a la cápsula | Costoso de producir |
Meningitis (Haemophilus influenzae, Streptococcus pneumoniae, Neisseria meningitides) |
| Sin protección contra la variación antigénica | ||||
| Mejor respuesta en niños pequeños | Puede interferir con otras vacunas |
Ejercicio\(\PageIndex{3}\)
- ¿Cuál es el riesgo asociado a una vacuna viva atenuada?
- ¿Por qué es necesaria en algunos casos una vacuna conjugada?
Las vacunas de ADN representan un enfoque relativamente nuevo y prometedor para la vacunación. Una vacuna de ADN se produce incorporando genes para antígenos en una vacuna plasmídica recombinante. La introducción de la vacuna de ADN en un paciente conduce a la captación del plásmido recombinante por parte de algunas de las células del paciente, seguido de la transcripción y traducción de antígenos y la presentación de estos antígenos con MHC I para activar la inmunidad adaptativa. Esto da como resultado la estimulación de la inmunidad tanto humoral como celular sin el riesgo de enfermedad activa asociada a vacunas vivas atenuadas.
Aunque la mayoría de las vacunas de ADN para humanos todavía están en desarrollo, es probable que se vuelvan más prevalentes en un futuro cercano ya que los investigadores están trabajando en la ingeniería de vacunas de ADN que activarán la inmunidad adaptativa contra varios patógenos diferentes a la vez. Las vacunas de ADN de primera generación probadas en la década de 1990 parecían prometedoras en modelos animales, pero fueron decepcionantes cuando se probaron en sujetos humanos. La mala captación celular de los plásmidos de ADN fue uno de los principales problemas que impactaron su eficacia. Los ensayos de vacunas de ADN de segunda generación han sido más prometedores gracias a las nuevas técnicas para mejorar la captación celular y optimizar los antígenos. Actualmente se están desarrollando vacunas de ADN para diversos tipos de cáncer y patógenos virales como VIH, VPH y hepatitis B y C.
Algunas vacunas de ADN ya están en uso. En 2005, se aprobó una vacuna de ADN contra el virus del Nilo Occidental para su uso en caballos en Estados Unidos. Canadá también ha aprobado una vacuna de ADN para proteger a los peces del virus de la necrosis hematopoyética infecciosa. 4 Una vacuna de ADN contra el virus de la encefalitis japonesa fue aprobada para su uso en humanos en 2010 en Australia.
Foco Clínico: Resolución
Con base en los síntomas de Olivia, su médico realizó un diagnóstico preliminar de meningitis bacteriana sin esperar una identificación positiva de las muestras de sangre y LCR enviadas al laboratorio. Olivia fue ingresada en el hospital y tratada con antibióticos intravenosos de amplio espectro y terapia de rehidratación. Durante los siguientes días, su condición comenzó a mejorar, y nuevas muestras de sangre y muestras de punción lumbar mostraron ausencia de microbios en la sangre y el LCR con niveles de glóbulos blancos volviendo a la normalidad. Durante este tiempo, el laboratorio produjo una identificación positiva de Neisseria meningitidis, el agente causante de la meningitis meningocócica, en su muestra original de LCR.
N. meningitidis produce una cápsula de polisacárido que sirve como factor de virulencia. N. meningitidis tiende a afectar a los lactantes después de que comienzan a perder la inmunidad pasiva natural proporcionada por los anticuerpos maternos. A un año de edad, los anticuerpos IgG maternos de Olivia habrían desaparecido, y no habría desarrollado células de memoria capaces de reconocer antígenos asociados a la cápsula polisacárida de la N. meningitidis. Como resultado, su sistema inmunitario adaptativo no pudo producir anticuerpos protectores para combatir la infección, y sin antibióticos puede que no haya sobrevivido. La infección de Olivia probablemente se habría evitado por completo si hubiera sido vacunada. Una vacuna conjugada para prevenir la meningitis meningocócica está disponible y aprobada para lactantes de tan solo dos meses de edad. Sin embargo, los calendarios de vacunación actuales en Estados Unidos recomiendan que la vacuna se administre a los 11 a 12 años con un refuerzo a los 16 años.
En países con sistemas de salud pública desarrollados, muchas vacunas se administran rutinariamente a niños y adultos. Los horarios de vacunas se cambian periódicamente, con base en la nueva información y resultados de investigación recopilados por las agencias de salud pública. En Estados Unidos, los CDC publican horarios y otra información actualizada sobre vacunas.
Conceptos clave y resumen
- La inmunidad adaptativa se puede dividir en cuatro clasificaciones distintas: inmunidad activa natural, inmunidad pasiva natural, inmunidad pasiva artificial e inmunidad activa artificial.
- La inmunidad activa artificial es la base para la vacunación y el desarrollo de vacunas. Los programas de vacunación no sólo confieren inmunidad artificial a los individuos, sino que también fomentan la inmunidad colectiva en las poblaciones.
- La variolación contra la viruela se originó en el siglo 10 en China, pero el procedimiento fue riesgoso porque podría causar la enfermedad que se pretendía prevenir. La vacunación moderna fue desarrollada por Edward Jenner, quien desarrolló la práctica de inocular a pacientes con materiales infecciosos a partir de lesiones de viruela vacuna para prevenir la viruela.
- Las vacunas vivas atenuadas y las vacunas inactivadas contienen patógenos enteros que son débiles, muertos o inactivados. Las vacunas subunitarias, las vacunas toxoides y las vacunas conjugadas contienen componentes acelulares con antígenos que estimulan una respuesta inmune.
Notas al pie
- 1 K. Mupapa, M. Massamba, K. Kibadi, K. Kivula, A. Bwaka, M. Kipasa, R. Colebunders, J. J. Muyembe-Tamfum. “Tratamiento de la Fiebre Hemorrágica del Ébola con Transfusiones de Sangre de Pacientes Convalecientes”. Revista de Enfermedades Infecciosas 179 Supl. (1999): S18—S23.
- 2 Elizabeth Yale. “Por qué los movimientos contra la vacunación nunca pueden ser domesticados”. Religion & Politics, 22 de julio de 2014. religionandpolitics.org/2014/... nunca-ser-domado.
- 3 N. J. Willis. “Edward Jenner y la Erradicación de la Viruela”. Scottish Medical Journal 42 (1997): 118—121.
- 4 M. Alonso y J. C. Leong. “Vacunas de ADN con licencia contra el virus de la necrosis hematopoyética infecciosa (IHNV)”. Patentes recientes sobre secuencias de ADN y genes (descontinuado) 7 núm. 1 (2013): 62—65, issn 1872-2156/2212-3431. doi 10.2174/1872215611307010009.
- 5 S.B. Halstead y S. J. Thomas. “Nuevas vacunas contra la encefalitis japonesa: alternativas a la producción en cerebro de ratón”. Revisión Pericial de Vacunas 10 núm. 3 (2011): 355—64.


