19.2: Trastornos autoinmunes
- Page ID
- 54594
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Explicar por qué se desarrollan trastornos autoinmunes
- Proporcionar algunos ejemplos de enfermedades autoinmunes sistémicas y específicas de órganos
En 1970, el artista Walt Kelly desarrolló un cartel promocionando el Día de la Tierra, con un personaje de Pogo, su tira cómica de diario. En el cartel, Pogo mira a través de un bosque sembrado de basura y dice irónicamente: “Hemos conocido al enemigo y él somos nosotros”. Pogo no estaba hablando del sistema inmunológico humano, pero muy bien podría haberlo sido. Si bien el sistema inmune protege al cuerpo atacando a los “enemigos” invasores (patógenos), en algunos casos, el sistema inmunitario puede identificar erróneamente a las propias células del cuerpo como el enemigo, resultando en una enfermedad autoinmune.
Las enfermedades autoinmunes son aquellas en las que el cuerpo es atacado por su propia respuesta inmune adaptativa específica. En estados normales y saludables, el sistema inmunitario induce tolerancia, que es la falta de una respuesta inmune anti-auto. Sin embargo, con la autoinmunidad, hay una pérdida de tolerancia inmune, y los mecanismos responsables de las enfermedades autoinmunes incluyen reacciones de hipersensibilidad tipo II, III y IV. Las enfermedades autoinmunes pueden tener una variedad de síntomas mixtos que estallan y desaparecen, dificultando el diagnóstico.
Las causas de las enfermedades autoinmunes son una combinación de la composición genética del individuo y el efecto de las influencias ambientales, como la luz solar, las infecciones, los medicamentos y los químicos ambientales. Sin embargo, la vaguedad de esta lista refleja nuestra escasa comprensión de la etiología de estas enfermedades. Excepto en muy pocas enfermedades específicas, el evento o eventos de iniciación de la mayoría de los estados autoinmunes no se han caracterizado completamente.
Existen varias causas posibles para el origen de las enfermedades autoinmunes y es probable que la autoinmunidad se deba a varios factores. La evidencia ahora sugiere que las células T y B reguladoras juegan un papel esencial en el mantenimiento de la tolerancia y la prevención de las respuestas autoinmunes. Las células T reguladoras son especialmente importantes para inhibir las células T autorreactivas que no se eliminan durante la selección tímica y escapan del timo (ver Linfocitos T e inmunidad celular). Además, la mimetización de antígenos entre antígenos patógenos y nuestros propios antígenos propios puede conducir a reactividad cruzada y autoinmunidad. Los autoantígenos ocultos pueden quedar expuestos debido a un trauma, interacciones farmacológicas o estados de enfermedad, y desencadenar una respuesta autoinmune. Todos estos factores podrían contribuir a la autoinmunidad. En última instancia, el daño a los tejidos y órganos en el estado de enfermedad autoinmune viene como resultado de respuestas inflamatorias que son inapropiadas; por lo tanto, el tratamiento a menudo incluye fármacos inmunosupresores y corticosteroides.
Enfermedades autoinmunes específicas de órganos
Algunas enfermedades autoinmunes se consideran específicas de órganos, lo que significa que el sistema inmunitario se dirige a órganos o tejidos específicos. Los ejemplos de enfermedades autoinmunes específicas de órganos incluyen la enfermedad celíaca, la enfermedad de Graves, la tiroiditis de Hashimoto, la diabetes mellitus tipo I y la enfermedad de Addison.
Enfermedad celíaca
La enfermedad celíaca es en gran parte una enfermedad del intestino delgado, aunque otros órganos pueden verse afectados. Las personas de entre 30 y 40 años, y los niños son los más afectados, pero la enfermedad celíaca puede comenzar a cualquier edad. Es el resultado de una reacción a las proteínas, comúnmente llamadas gluten, que se encuentran principalmente en el trigo, la cebada, el centeno y algunos otros granos. La enfermedad tiene varias causas genéticas (predisposiciones) e influencias ambientales poco entendidas. Al exponerse al gluten, el organismo produce diversos autoanticuerpos y una respuesta inflamatoria. La respuesta inflamatoria en el intestino delgado conduce a una reducción en la profundidad de las microvellosidades de la mucosa, lo que dificulta la absorción y puede conducir a la pérdida de peso y anemia. La enfermedad también se caracteriza por diarrea y dolor abdominal, síntomas que a menudo se diagnostican erróneamente como síndrome del intestino irritable.
El diagnóstico de la enfermedad celíaca se realiza a partir de pruebas serológicas para detectar la presencia principalmente de anticuerpos IgA contra componentes del gluten, la enzima transglutinaminasa y autoanticuerpos contra endomisio, un tejido conectivo que rodea las fibras musculares. Las pruebas serológicas suelen ser seguidas con endoscopia y biopsia de la mucosa duodenal. Las encuestas serológicas han encontrado que alrededor del 1% de los individuos en el Reino Unido son positivos a pesar de que no todos muestran síntomas. 1 Este reconocimiento temprano permite un seguimiento y prevención más cuidadosos de la enfermedad grave.
La enfermedad celíaca se trata con la eliminación completa de los alimentos que contienen gluten de la dieta, lo que resulta en una mejora de los síntomas y un menor riesgo de complicaciones. Otros enfoques teóricos incluyen la cría de granos que no contienen los componentes inmunológicamente reactivos o el desarrollo de suplementos dietéticos que contienen enzimas que descomponen los componentes proteicos que causan la respuesta inmune. 2
Trastornos de la Tiroides
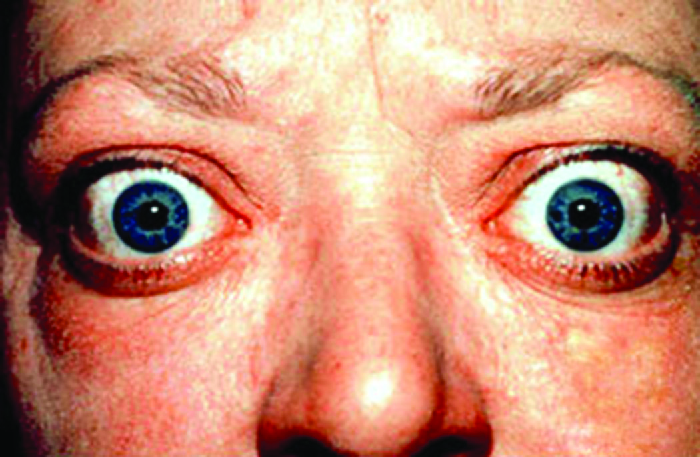
La enfermedad de Graves es la causa más común de hipertiroidismo en Estados Unidos. Los síntomas de la enfermedad de Graves son el resultado de la producción de inmunoglobulina estimulante de la tiroides (TSI) también llamada anticuerpo receptor TSH. TSI se dirige y se une al receptor de la hormona estimulante tiroidea (TSH), que es producida naturalmente por la glándula pituitaria. La ETI puede causar síntomas contradictorios porque puede estimular la tiroides para producir demasiada hormona tiroidea o bloquear completamente la producción de hormona tiroidea, dificultando el diagnóstico. Los signos y síntomas de la enfermedad de Graves incluyen intolerancia al calor, latidos cardíacos rápidos e irregulares, pérdida de peso, bocio (una glándula tiroides inflamada, que sobresale debajo de la piel de la garganta [Figura\(\PageIndex{1}\)]) y exoftalmia (ojos saltones) a menudo conocida como oftalmopatía de Graves (Figura\(\PageIndex{2}\)).
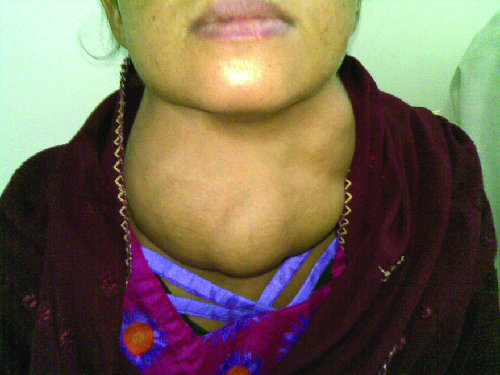
La causa más común de hipotiroidismo en Estados Unidos es la tiroiditis de Hashimoto, también llamada tiroiditis linfocítica crónica. Los pacientes con tiroiditis de Hashimoto a menudo desarrollan un espectro de diferentes enfermedades debido a que tienen más probabilidades de desarrollar enfermedades autoinmunes adicionales como la enfermedad de Addison (discutida más adelante en esta sección), diabetes tipo 1, artritis reumatoide y enfermedad celíaca. La tiroiditis de Hashimoto es una enfermedad mediada por células T H 1 que ocurre cuando la glándula tiroides es atacada por linfocitos citotóxicos, macrófagos y autoanticuerpos. Esta respuesta autoinmune conduce a numerosos síntomas que incluyen bocio (Figura\(\PageIndex{1}\)), intolerancia al frío, debilidad muscular, articulaciones dolorosas y rígidas, depresión y pérdida de memoria.
Diabetes tipo 1
La diabetes juvenil, o diabetes mellitus tipo 1, generalmente se diagnostica en niños y adultos jóvenes. Es una enfermedad autoinmune dependiente de células T caracterizada por la destrucción selectiva de las células β de los islotes de Langerhans en el páncreas por células T CD8 mediadas por CD4 T H 1, anticuerpos anti-células β y actividad de macrófagos. También hay evidencia de que las infecciones virales pueden tener un papel potenciador o inhibidor en el desarrollo de la diabetes mellitus tipo 1 (T1D). La destrucción de las células β provoca una falta de producción de insulina por parte del páncreas. En la T1D, la destrucción de células β puede ocurrir a lo largo de varios años, pero los síntomas de hiperglucemia, aumento extremo de sed y micción, pérdida de peso y fatiga extrema suelen tener un inicio repentino, y el diagnóstico generalmente no ocurre hasta que la mayoría de las células β ya han sido destruidas.
Enfermedad autoinmune de Addison
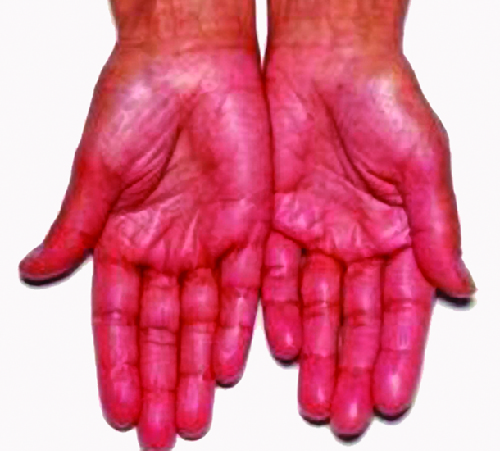
La destrucción de las glándulas suprarrenales (las glándulas que se encuentran por encima de los riñones que producen glucocorticoides, mineralocorticoides y esteroides sexuales) es la causa de la enfermedad de Addison, también llamada insuficiencia suprarrenal primaria (PAI). Hoy en día, hasta el 80% de los casos de la enfermedad de Addison se diagnostican como enfermedad autoinmune de Addison (AAD), la cual es causada por una respuesta autoinmune a los tejidos suprarrenales que interrumpen La interrupción de la función suprarrenal provoca procesos metabólicos deteriorados que requieren niveles normales de hormonas esteroideas, causando signos y síntomas en todo el cuerpo. Existe evidencia de que tanto los mecanismos inmunitarios humorales como los mediados por linfocitos T CD8 dirigidos por CD4 T H 1 están dirigidos a la corteza suprarrenal en la AAD. También hay evidencia de que la respuesta autoinmune está asociada con la destrucción autoinmune de otras glándulas endocrinas, como el páncreas y la tiroides, afecciones denominadas colectivamente síndromes poliendocrinos autoinmunes (APS). En hasta el 80% de los pacientes con AAD, se producen anticuerpos contra tres enzimas involucradas en la síntesis de esteroides: 21-hidroxilasa (21-OH), 17α-hidroxilasa y enzima de escisión de cadena lateral del colesterol. 3 El autoanticuerpo más común que se encuentra en la AAD es el 21-OH, y los anticuerpos contra cualquiera de las enzimas clave para la producción de esteroides son diagnósticos para la AAD. Las células de la corteza suprarrenal son dirigidas, destruidas y reemplazadas por tejido fibroso por inflamación mediada por el sistema inmune. En algunos pacientes, al menos el 90% de la corteza suprarrenal se destruye antes de que los síntomas se vuelvan diagnósticos.
Los síntomas de DAA incluyen debilidad, náuseas, disminución del apetito, pérdida de peso, hiperpigmentación (Figura\(\PageIndex{3}\)), hiperpotasemia (niveles elevados de potasio en la sangre), hiponatremia (disminución de los niveles de sodio en sangre), hipoglucemia (disminución de los niveles de azúcar en la sangre), hipotensión (disminución de la presión arterial), anemia, linfocitosis (disminución de los niveles de glóbulos blancos) y fatiga. Bajo estrés extremo, como cirugía, trauma accidental o infección, los pacientes con AAD pueden experimentar una crisis suprarrenal que hace que el paciente vomite, experimente dolor abdominal, calambres de espalda o piernas e incluso hipotensión severa que conduce a shock.
Ejercicio\(\PageIndex{1}\)
- ¿Cuáles son los nombres de las enfermedades autoinmunes que interfieren con la función hormonal de la glándula
- Describir cómo difieren los mecanismos de la enfermedad de Graves y la tiroiditis de Hashimoto.
- Nombra las células que se destruyen en la diabetes mellitus tipo 1 y describe el resultado.
Enfermedades autoinmunes sistémicas
Mientras que las enfermedades autoinmunes específicas de órganos se dirigen a órganos o tejidos específicos, las enfermedades autoinmunes sistémicas son más generalizadas, dirigidas a múltiples órganos o tejidos en todo el cuerpo. Los ejemplos de enfermedades autoinmunes sistémicas incluyen esclerosis múltiple, miastenia grave, psoriasis, artritis reumatoide y lupus eritematoso sistémico.
Esclerosis Múltiple
La esclerosis múltiple (EM) es una enfermedad autoinmune del sistema nervioso central que afecta el cerebro y la médula espinal. Las lesiones en múltiples ubicaciones dentro del sistema nervioso central son un sello distintivo de la esclerosis múltiple y son causadas por la infiltración de células inmunes a través de la barrera hematoencefálica. Las células inmunitarias incluyen células T que promueven la inflamación, la desmielinización y la degeneración neuronal, todas las cuales interrumpen la señalización neuronal. Los síntomas de la EM incluyen alteraciones visuales; debilidad muscular; dificultad con la coordinación y el equilibrio; sensaciones como entumecimiento, hormigueo o “alfileres y agujas”; y problemas cognitivos y de memoria.
Miastenia Gravis
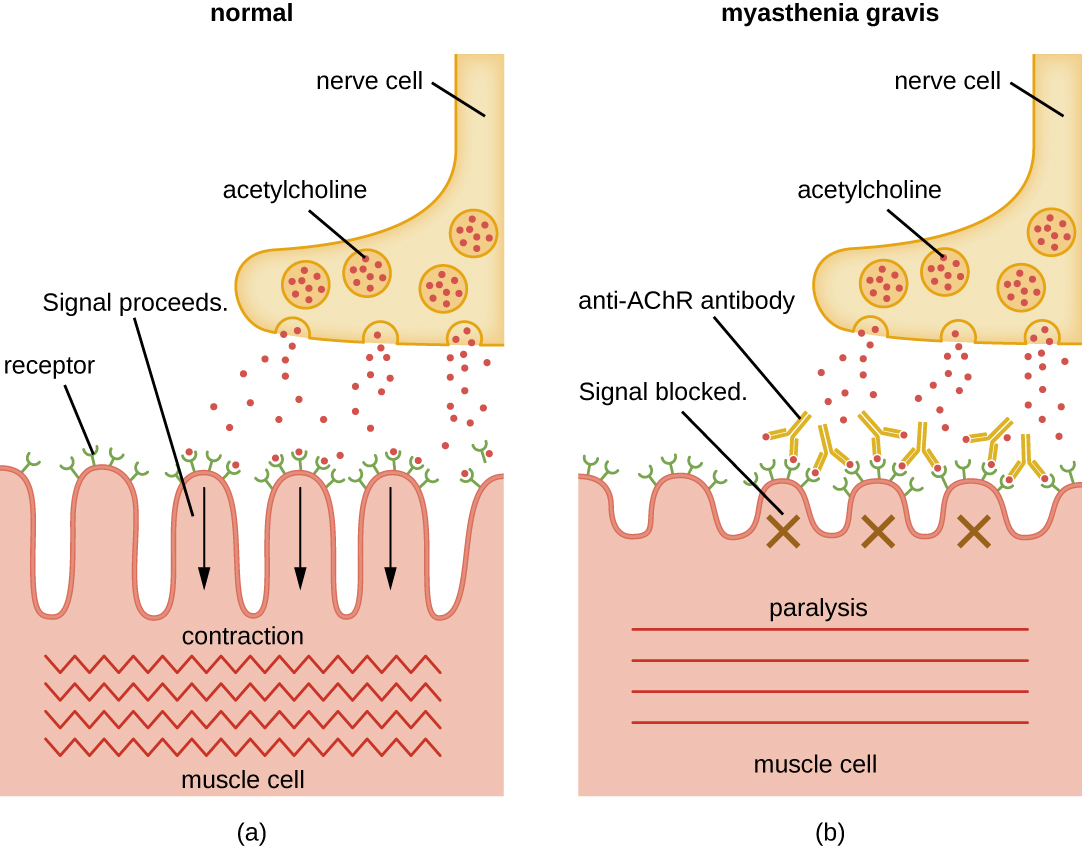
Los autoanticuerpos dirigidos contra los receptores de acetilcolina (AChR) en la hendidura sináptica de las uniones neuromusculares conducen a miastenia grave (Figura\(\PageIndex{4}\)). Los anticuerpos anti-AChR son IgG de alta afinidad y su síntesis requiere células T CD4 activadas para interactuar y estimular las células B. Una vez producidos, los anticuerpos anti-AChR afectan la transmisión neuromuscular por al menos tres mecanismos:
- Unión y activación del complemento en la unión neuromuscular
- Endocitosis AChR acelerada de moléculas reticuladas por anticuerpos
- Bloqueo funcional de AChR, que impide la unión normal de acetilcolina a, y la activación de, AChR
Independientemente del mecanismo, el efecto del anti-AChR es debilidad muscular extrema y potencialmente muerte por paro respiratorio en casos severos.
Psoriasis
La psoriasis es una enfermedad de la piel que causa picazón o dolor en parches de piel gruesa y roja con escamas plateadas en codos, rodillas, cuero cabelludo, espalda, cara, palmas, pies y, a veces, otras áreas. Algunos individuos con psoriasis también contraen una forma de artritis llamada artritis psoriásica, en la que las articulaciones pueden inflamarse. La psoriasis es el resultado de la compleja interacción entre los queratinocitos, las células dendríticas y las células T, y las citocinas producidas por estas diversas células. En un proceso llamado recambio celular, las células de la piel que crecen profundamente en la piel se elevan a la superficie. Normalmente, este proceso lleva un mes. En la psoriasis, como resultado de la activación de citocinas, el recambio celular ocurre en tan solo unos días. Los gruesos parches inflamados de la piel que son característicos de la psoriasis se desarrollan debido a que las células de la piel se elevan demasiado rápido.
Artritis Reumatoide
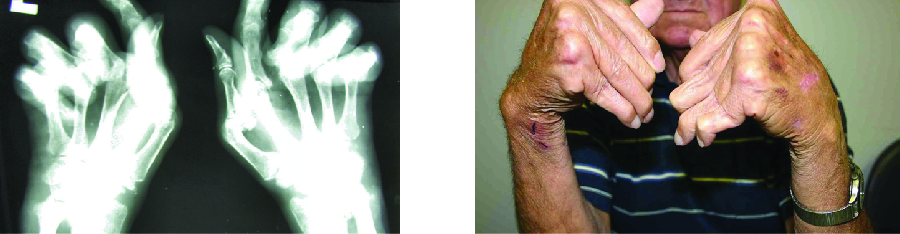
La enfermedad articular inflamatoria crónica más común es la artritis reumatoide (AR) (Figura\(\PageIndex{5}\)) y sigue siendo un reto médico importante debido a preguntas sin resolver relacionadas con las causas ambientales y genéticas de la enfermedad. La AR implica reacciones de hipersensibilidad tipo III y la activación de células T CD4, dando como resultado la liberación crónica de las citocinas inflamatorias IL-1, IL-6 y factor de necrosis tumoral α (TNF-α). Las células T CD4 activadas también estimulan la producción de anticuerpos contra el factor reumatoide (RF) y anticuerpos anticíclicos citrulinados peptídicos (anti-CCP) que forman complejos inmunes. El aumento de los niveles de proteínas de fase aguda, como la proteína C reactiva (PCR), también se producen como parte del proceso inflamatorio y participan en la fijación del complemento con los anticuerpos en los complejos inmunes. La formación de complejos inmunes y la reacción a los factores inmunes provocan un proceso inflamatorio en las articulaciones, particularmente en las manos, los pies y las piernas. El diagnóstico de AR se basa en niveles elevados de RF, anti-CCP, PCR cuantitativa y la velocidad de sedimentación globular (VSG) (Westergren modificada). Además, las radiografías, las ecografías o las exploraciones por resonancia magnética pueden identificar daños en las articulaciones, como erosiones, pérdida de hueso dentro de la articulación y estrechamiento del espacio articular.
Lupus eritematoso sistémico
El daño y patología del lupus eritematoso sistémico (LES) es causado por reacciones de hipersensibilidad tipo III. Los autoanticuerpos producidos en el LES están dirigidos contra proteínas nucleares y citoplásmicas. Los anticuerpos antinucleares (ANAs) están presentes en más del 95% de los pacientes con LES, 4 con autoanticuerpos adicionales que incluyen ADN anti-bicatenario (dsADN) y anticuerpos anti-Sm (anticuerpos contra ribonucleoproteína nuclear pequeña). Los anticuerpos anti-ds-ADN y anti-SM son únicos para los pacientes con LES, por lo que su presencia se incluye en los criterios de clasificación del LES. La interacción celular con autoanticuerpos conduce a la destrucción nuclear y celular, con componentes liberados después de la muerte celular que conducen a la formación de complejos inmunes.
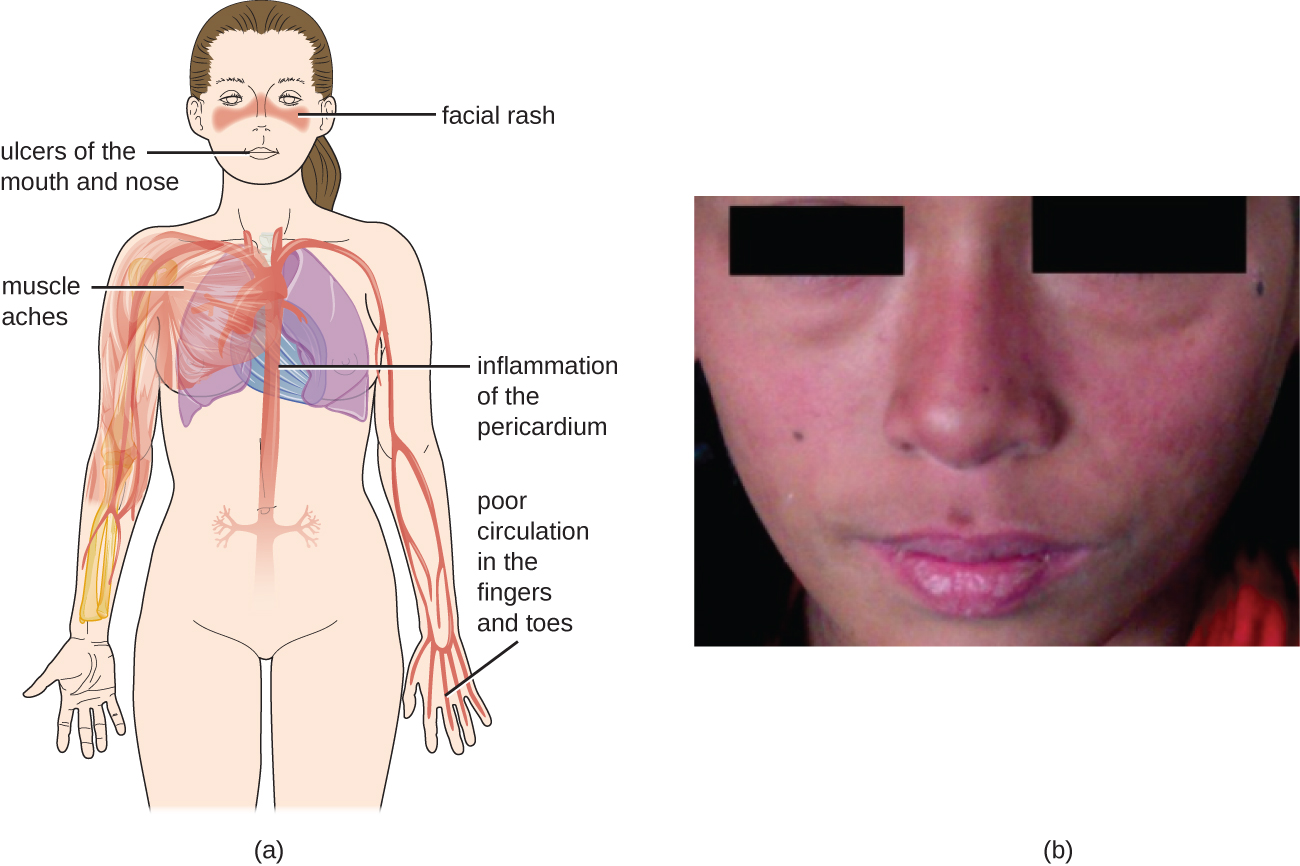
Debido a que los autoanticuerpos en el LES pueden dirigirse a una amplia variedad de células, los síntomas del LES pueden ocurrir en muchas ubicaciones corporales. Sin embargo, los síntomas más comunes incluyen fatiga, fiebre sin otra causa, caída del cabello y una erupción “mariposa” o máscara de lobo (lupus) sensible a la luz solar que se encuentra en aproximadamente el 50% de las personas con LES (Figura\(\PageIndex{6}\)). El sarpullido se ve con mayor frecuencia sobre las mejillas y el puente de la nariz, pero puede estar muy extendido. Otros síntomas pueden aparecer dependiendo de las zonas afectadas. Las articulaciones pueden verse afectadas, lo que lleva a la artritis de los dedos, manos, muñecas y rodillas. Los efectos sobre el cerebro y el sistema nervioso pueden provocar dolores de cabeza, entumecimiento, hormigueo, convulsiones, problemas de visión y cambios de personalidad. También puede haber dolor abdominal, náuseas, vómitos, arritmias, dificultad para respirar y sangre en el esputo. Los efectos sobre la piel pueden dar lugar a áreas adicionales de lesiones cutáneas, y la vasoconstricción puede provocar cambios de color en los dedos cuando están fríos (fenómeno Raynaud). Los efectos en los riñones pueden provocar edema en las piernas y aumento de peso. El diagnóstico de LES depende de la identificación de cuatro de 11 de los síntomas más comunes y de la producción confirmada de una serie de autoanticuerpos únicos para LES. Una prueba positiva para ANAs por sí sola no es diagnóstica.
Ejercicio\(\PageIndex{2}\)
- Enumere las formas en que los anticuerpos contribuyen a la patogenia de la miastenia gravis.
- Explicar por qué la artritis reumatoide se considera una hipersensibilidad tipo III.
- Describir los síntomas del lupus eritematoso sistémico y explicar por qué afectan a tantas partes diferentes del cuerpo.
- ¿Qué se reconoce como antígeno en la miastenia gravis?
| Enfermedad | Causa | Signos y síntomas |
|---|---|---|
| Enfermedad de Addison | Destrucción de células de la glándula suprarrenal por células T | Debilidad, náuseas, hipotensión, fatiga; crisis suprarrenal con dolor intenso en abdomen, espalda baja y piernas; colapso del sistema circulatorio, insuficiencia renal |
| Enfermedad celíaca | Los anticuerpos contra el gluten se convierten en autoanticuerpos que se dirigen a las células del intestino delgado | Diarrea severa, dolor abdominal, anemia, desnutrición |
| Diabetes mellitus (tipo I) | Destrucción de células T citotóxicas de las células β productoras de insulina del páncreas | Hiperglucemia, aumento extremo de sed y micción, pérdida de peso, fatiga extrema |
| Enfermedad de Graves | Los autoanticuerpos se dirigen a los receptores de la hormona estimulante de la tiroides, lo que resulta en una sobreestimulación | Hipertiroidismo con latidos cardíacos rápidos e irregulares, intolerancia al calor, pérdida de peso, bocio, exoftalmia |
| Tiroiditis de Hashimoto | La glándula tiroides es atacada por células T citotóxicas, linfocitos, macrófagos y autoanticuerpos | Tiroiditis con bocio, intolerancia al frío, debilidad muscular, articulaciones dolorosas y rígidas, depresión, pérdida de memoria |
| Esclerosis múltiple (EM) | Destrucción de células T citotóxicas de la vaina de mielina que rodea los axones nerviosos del sistema nervioso central | Alteraciones visuales, debilidad muscular, alteración de la coordinación y el equilibrio, entumecimiento, sensaciones punzantes o “alfileres y agujas”, deterioro de la función cognitiva y la memoria |
| Miastenia grave | Autoanticuerpos dirigidos contra receptores de acetilcolina dentro de la unión neuromuscular | Debilidad muscular extrema que finalmente conduce a un paro respiratorio fatal |
| Psoriasis | La activación de citocinas de los queratinocitos provoca un recambio celular epidérmico rápido y excesivo | Parches con picazón o dolor de piel gruesa y roja con escamas plateadas; comúnmente afecta codos, rodillas, cuero cabelludo, espalda, cara, palmas, pies |
| Artritis reumatoide | Los autoanticuerpos, los complejos inmunes, la activación del complemento, los fagocitos y las células T dañan las membranas y los huesos de las articulaciones | Inflamación articular, dolor y desfiguración, inflamación sistémica crónica |
| Lupus eritematoso sistémico (LES) | Los autoanticuerpos dirigidos contra moléculas nucleares y citoplásmicas forman complejos inmunes que se depositan en los tejidos. Las células fagocíticas y la activación del complemento causan daño tisular e inflamación | Fatiga, fiebre, dolor e hinchazón en las articulaciones, pérdida de cabello, anemia, coagulación, erupción “mariposa” sensible a la luz solar, lesiones cutáneas, fotosensibilidad, disminución de la función renal, pérdida de memoria, confusión, depresión |
Conceptos clave y resumen
- Las enfermedades autoinmunes son el resultado de una ruptura de la tolerancia inmunológica. El evento o eventos de inducción reales para estados autoinmunes son en gran parte desconocidos.
- Algunas enfermedades autoinmunes atacan órganos específicos, mientras que otras son más sistémicas.
- Las enfermedades autoinmunes específicas de órganos incluyen enfermedad celíaca, enfermedad de Graves, tiroiditis de Hashimoto, diabetes mellitus tipo I y enfermedad de Addison.
- Las enfermedades autoinmunes sistémicas incluyen esclerosis múltiple, miastenia grave, psoriasis, artritis reumatoide y lupus eritematoso sistémico.
- Los tratamientos para enfermedades autoinmunes generalmente implican fármacos antiinflamatorios e inmunosupresores.
Notas al pie
- 1 D.A. Van Heel, J. Oeste. “Avances recientes en la enfermedad celíaca”. Gut 55 núm. 7 (2006) :1037—1046.
- 2 ibíd.
- 3 P. Martorell et al. “La autoinmunidad en la enfermedad de Addison”. Netherlands Journal of Medicine 60 núm. 7 (2002) :269—275.
- 4 C.C. Mok, C.S. Lau. “Patogenia del Lupus Eritematoso Sistémico”. Revista de Patología Clínica 56 núm. 7 (2003) :481—490.


