6.3: Comunicación Dentro Y Entre Neuronas
- Última actualización
- Guardar como PDF
- Page ID
- 134993
Hasta el momento, hemos descrito las principales características de las neuronas, incluyendo cómo sus procesos entran en estrecho contacto entre sí para formar sinapsis. En esta sección, consideramos la conducción de la comunicación dentro de una neurona y cómo se transmite esta señal a la siguiente neurona. Hay dos etapas de esta acción electroquímica en las neuronas. La primera etapa es la conducción eléctrica de entrada dendrítica a la iniciación de un potencial de acción dentro de una neurona. La segunda etapa es una transmisión química a través de la brecha sináptica entre la neurona presináptica y la neurona postsináptica de la sinapsis. Para entender estos procesos, primero debemos considerar lo que ocurre dentro de una neurona cuando se encuentra en un estado estacionario, llamado potencial de membrana en reposo.
Potencial de membrana en reposo
El fluido intracelular (dentro de la célula) y el fluido extracelular (fuera de la célula) de las neuronas está compuesto por una combinación de iones (moléculas cargadas eléctricamente; ver Figura\(\PageIndex{1}\)). Los cationes son iones cargados positivamente y los aniones son iones cargados negativamente. La composición del fluido intracelular y extracelular es similar al agua salada, que contiene sodio (Na+), potasio (K+), cloruro (Cl−) y aniones (A−).
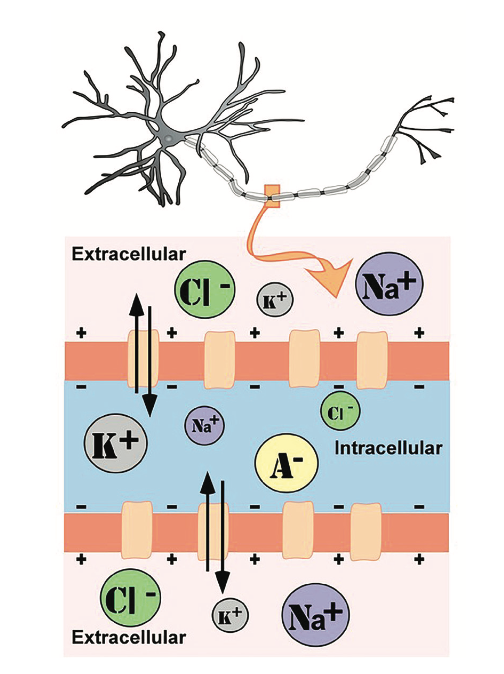
La membrana celular, que está compuesta por una bicapa lipídica de moléculas de grasa, separa la célula del fluido extracelular circundante. Existen proteínas que atraviesan la membrana, formando canales iónicos que permiten que determinados iones pasen entre el fluido intracelular y extracelular (ver Figura\(\PageIndex{1}\)). Estos iones se encuentran en diferentes concentraciones dentro de la célula en relación con el exterior de la célula, y los iones tienen diferentes cargas eléctricas. Debido a esta diferencia de concentración y carga, dos fuerzas actúan para mantener un estado estacionario cuando la celda está en reposo: difusión y presión electrostática. La difusión es la fuerza sobre las moléculas para pasar de áreas de alta concentración a áreas de baja concentración. La presión electrostática es la fuerza sobre dos iones con carga similar para repelerse entre sí y la fuerza de dos iones con carga opuesta para atraerse entre sí. ¿Recuerdas el dicho, los opuestos se atraen?
Independientemente del ion, existe un potencial de membrana en el que la fuerza de difusión es igual y opuesta a la fuerza de la presión electrostática. Esta tensión, llamada potencial de equilibrio, es la tensión a la que no fluyen iones. Dado que hay varios iones que pueden permear la membrana de la célula, la carga eléctrica de la línea base dentro de la célula en comparación con el exterior de la célula, denominada potencial de membrana en reposo, se basa en el impulso colectivo de fuerza sobre varios iones. En relación con el líquido extracelular, el potencial de membrana de una neurona en reposo está cargado negativamente a aproximadamente −70 mV (ver Figura\(\PageIndex{2}\)). Se trata de voltajes muy pequeños en comparación con los voltajes de baterías y tomas de corriente, que encontramos a diario, que van desde 1.5 a 240 V.
Veamos cómo estas dos fuerzas, la difusión y la presión electrostática, actúan sobre los cuatro grupos de iones mencionados anteriormente.
- Aniones (A −): Los aniones están altamente concentrados dentro de la célula y contribuyen a la carga negativa del potencial de membrana en reposo. La difusión y la presión electrostática no son fuerzas que determinan la concentración de A− porque A- es impermeable a la membrana celular. No hay canales iónicos que permitan que A- se mueva entre el fluido intracelular y extracelular.
- Potasio (K +): La membrana celular es muy permeable al potasio en reposo, pero el potasio permanece en altas concentraciones dentro de la célula. La difusión empuja a K+ fuera de la célula porque está en alta concentración dentro de la célula. Sin embargo, la presión electrostática empuja K+ dentro de la celda porque la carga positiva de K+ es atraída por la carga negativa dentro de la celda. En combinación, estas fuerzas se oponen entre sí con respecto a K+.
- Cloruro (Cl −): La membrana celular también es muy permeable al cloruro en reposo, pero el cloruro permanece en alta concentración fuera de la célula. La difusión empuja a Cl− dentro de la célula porque está en alta concentración fuera de la célula. Sin embargo, la presión electrostática empuja a Cl- fuera de la celda porque la carga negativa de Cl- es atraída hacia la carga positiva fuera de la celda. Similar a K +, estas fuerzas se oponen entre sí con respecto a Cl−.
- Sodio (Na +): La membrana celular no es muy permeable al sodio en reposo. La difusión empuja a Na+ dentro de la célula porque está en alta concentración fuera de la célula. La presión electrostática también empuja a Na+ dentro de la celda porque la carga positiva de Na+ es atraída por la carga negativa dentro de la celda. Ambas fuerzas empujan a Na+ dentro de la célula; sin embargo, Na+ no puede permear la membrana celular y permanece en alta concentración fuera de la célula. Las pequeñas cantidades de Na+ dentro de la célula se eliminan mediante una bomba de sodio-potasio, que utiliza la energía de la neurona (trifosfato de adenosina, ATP) para bombear 3 iones Na+ fuera de la célula a cambio de traer 2 iones K+ dentro de la célula.
Potencial de acción
Ahora que hemos considerado lo que ocurre en una neurona en reposo, consideremos qué cambios ocurren en el potencial de membrana en reposo cuando una neurona recibe entrada, o información, del botón terminal presináptico de otra neurona. Nuestra comprensión de las señales eléctricas o potenciales que ocurren dentro de una neurona es el resultado del trabajo seminal de Hodgkin y Huxley que comenzó en la década de 1930 en un conocido laboratorio de biología marina en Woodshole, Massachusetts. Su trabajo, por el que ganaron el Premio Nobel de Medicina en 1963, ha dado como resultado el modelo general de transducción electroquímica que aquí se describe (Hodgkin & Huxley, 1952). Hodgkin y Huxley estudiaron un axón muy grande en el calamar, una especie común para esa región de Estados Unidos. El axón gigante del calamar es aproximadamente 100 veces más grande que el de los axones en el cerebro de los mamíferos, por lo que es mucho más fácil de ver. La activación del axón gigante es responsable de una respuesta de abstinencia que usa el calamar cuando intenta escapar de un depredador, como peces grandes, aves, tiburones e incluso humanos. ¿Cuándo fue la última vez que tuviste calamares? El gran tamaño del axón no es un error en el diseño de la naturaleza; permite una transmisión muy rápida de una señal eléctrica, permitiendo un rápido movimiento de escape en el calamar de sus depredadores.
Al estudiar esta especie, Hodgkin y Huxley notaron que si aplicaban un estímulo eléctrico al axón, una gran corriente eléctrica transitoria conducía por el axón. Esta corriente eléctrica transitoria se conoce como potencial de acción (ver Figura\(\PageIndex{2}\)). Un potencial de acción es una respuesta de todo o nada que ocurre cuando hay un cambio en la carga o potencial de la célula a partir de su potencial de membrana en reposo (−70 mV) en una dirección más positiva, que es una despolarización (ver Figura\(\PageIndex{2}\)). ¿Qué se entiende por una respuesta de todo o nada? Encuentro que este concepto se compara mejor con el código binario utilizado en las computadoras, donde solo hay dos posibilidades, 0 o 1. No hay ni medio camino ni entre estos posibles valores; por ejemplo, 0.5 no existe en código binario. Sólo hay dos posibilidades, ya sea el valor de 0 o el valor de 1. El potencial de acción es el mismo en este sentido. No hay a mitad de camino; ocurre, o no ocurre. Existe un potencial específico de membrana que la neurona debe alcanzar para iniciar un potencial de acción. Este potencial de membrana, llamado el umbral de excitación, es típicamente alrededor de −50 mV. Si se alcanza el umbral de excitación, entonces se activa un potencial de acción.
¿Cómo se inicia un potencial de acción? En cualquier momento, cada neurona está recibiendo cientos de entradas de las células que sinapsan con ella. Estas entradas pueden causar varios tipos de fluctuaciones en los potenciales de membrana de la neurona (ver Figura\(\PageIndex{2}\)):
- Potenciales possinápticos excitatorios (EPSP): una corriente de izacion despolar que hace que el potencial de membrana se vuelva más positivo y se acerque al umbral de excitación; o
- Potenciales post-sinápticos inhibitorios (IPSP): una corriente hiperpolarizante que hace que el potencial de membrana se vuelva más negativo y más alejado del umbral de excitación.
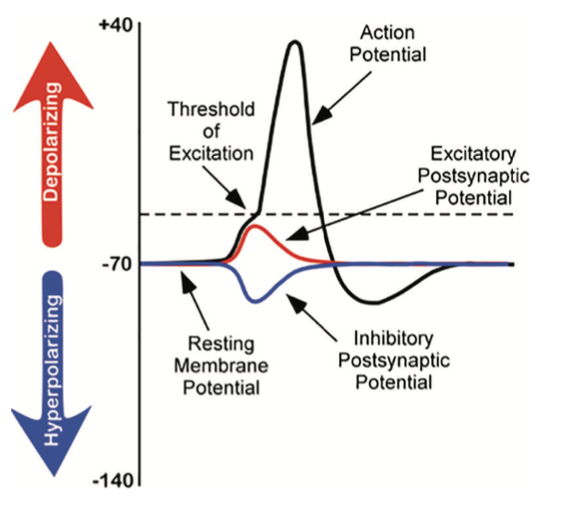
Estos potenciales post sinápticos, EPSP e IPSP, suman o se suman en tiempo y espacio. Los IPSP hacen que el potencial de membrana sea más negativo, pero cuánto depende de la fuerza de los IPSP. Los EPSP hacen que el potencial de membrana sea más positivo; nuevamente, cuánto más positivo depende de la fuerza de los EPSP. Si tienes dos EPSP pequeños al mismo tiempo y la misma sinapsis entonces el resultado será un EPSP grande. Si tienes un EPSP pequeño y un IPSP pequeño al mismo tiempo y la misma sinapsis entonces se cancelarán entre sí. A diferencia del potencial de acción, que es una respuesta de todo o nada, los IPSP y los EPSP son potenciales más pequeños y graduados, variando en fuerza. El cambio de voltaje durante un potencial de acción es de aproximadamente 100 mV. En comparación, los EPSP e IPSP son cambios de voltaje entre 0.1 y 40 mV. Pueden ser diferentes resistencias, o gradientes, y se miden por qué tan lejos divergen los potenciales de membrana del potencial de membrana en reposo.
Sé que el concepto de suma puede resultar confuso. Cuando era niño, uso para jugar un juego en la primaria con un paracaídas muy grande donde tratarías de sacar bolas del centro del paracaídas. Este juego ilustra bastante bien las propiedades de la suma. En este juego, un grupo de niños uno al lado del otro trabajaría al unísono para producir olas en el paracaídas con el fin de provocar una ola lo suficientemente grande como para sacar la pelota del paracaídas. Los niños iniciarían las olas al mismo tiempo y en la misma dirección. El resultado aditivo fue una ola mayor en el paracaídas, y las bolas rebotarían fuera del paracaídas. No obstante, si las olas que iniciaron ocurrieron en sentido contrario o con el tiempo equivocado, las olas se cancelarían entre sí, y las bolas permanecerían en el centro del paracaídas. Los EPSP o IPSP en una neurona trabajan de la misma manera con las propiedades de las olas en el paracaídas; o bien se agregan o cancelan entre sí. Si tienes dos EPSP, entonces se suman y se convierten en una despolarización más grande. De igual manera, si dos IPSP entran en la célula al mismo tiempo, sumarán y se convertirán en una mayor hiperpolarización en el potencial de membrana. Sin embargo, si dos entradas se oponían entre sí, moviendo el potencial en direcciones opuestas, como una EPSP y una IPSP, su suma se cancelaría entre sí.
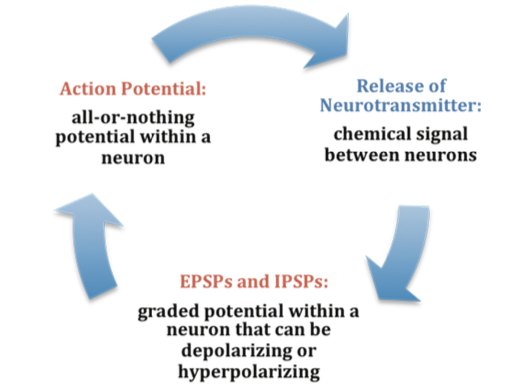
En cualquier momento, cada celda está recibiendo mensajes mixtos, tanto EPSP como IPSP. Si la suma de EPSP es lo suficientemente fuerte como para despolarizar el potencial de membrana para alcanzar el umbral de excitación, entonces inicia un potencial de acción. El potencial de acción luego viaja por el axón, lejos del soma, hasta llegar a los extremos del axón (el botón terminal). En el botón terminal, el potencial de acción desencadena la liberación de neurotransmisores desde el botón terminal presináptico hacia la brecha sináptica. Estos neurotransmisores, a su vez, causan EPSP e IPSP en las espinas dendríticas possinápticas de la siguiente célula (ver Figura\(\PageIndex{1}\) y Figura\(\PageIndex{3}\)). El neurotransmisor liberado por el botón terminal presináptico se une con receptores ionotrópicos de una manera de bloqueo y clave en la columna dendrítica possináptica. Los receptores ionotrópicos son receptores en canales iónicos que se abren, permitiendo que algunos iones entren o salgan de la célula, dependiendo de la presencia de un neurotransmisor particular. El tipo de neurotransmisor y la permeabilidad del canal iónico que activa determinará si ocurre un EPSP o IPSP en la dendrita de la célula possináptica. Estos EPSP e IPSP suman de la misma manera descrita anteriormente, y todo el proceso ocurre nuevamente en otra celda.
El cambio en el potencial de membrana durante un potencial de acción
Se discutió previamente qué iones están involucrados en el mantenimiento del potencial de la membrana en reposo. No es sorprendente que algunos de estos mismos iones estén involucrados en el potencial de acción. Cuando la celda se despolariza (carga más positiva) y alcanza el umbral de excitación, esto provoca que se abra un canal de Na+ dependiente del voltaje. Un canal iónico dependiente del voltaje es un canal que se abre, permitiendo que algunos iones entren o salgan de la célula, dependiendo de cuándo la célula alcance un potencial de membrana particular. Cuando la celda está en el potencial de membrana en reposo, estos canales de Na+ dependientes del voltaje están cerrados. Como aprendimos anteriormente, tanto la difusión como la presión electrostática están empujando a Na+ dentro de las celdas. Sin embargo, Na+ no puede permear la membrana cuando la célula está en reposo. Ahora que estos canales están abiertos, Na+ se precipita dentro de la celda, provocando que la celda se cargue muy positivamente en relación con el lado exterior de la celda. Esto es responsable de la fase ascendente o despolarizante del potencial de acción (ver Figura\(\PageIndex{2}\)). El interior de la celda se carga muy positivamente, +40 mV. En este punto, los canales de Na+ se cierran y se vuelven refractarios. Esto significa que los canales de Na+ no pueden volver a abrirse hasta después de que la célula regrese al potencial de la membrana en reposo. Así, un nuevo potencial de acción no puede ocurrir durante el periodo refractario. El periodo refractario también asegura que el potencial de acción solo pueda moverse en una dirección hacia abajo del axón, alejándose del soma. A medida que la celda se vuelve más despolarizada, se abre un segundo tipo de canal dependiente del voltaje; este canal es permeable a K+. Con la celda muy positiva en relación con el exterior de la celda (despolarizada) y la alta concentración de K+ dentro de la celda, tanto la fuerza de difusión como la fuerza de presión electrostática impulsan K+ fuera de la celda. El movimiento de K+ fuera de la célula hace que el potencial celular regrese al potencial de la membrana en reposo, la fase descendente o hiperpolarizante del potencial de acción (ver Figura\(\PageIndex{2}\)). Una hiperpolarización corta se produce parcialmente debido al cierre gradual de los canales de K+. Con el Na+ cerrado, la presión electrostática continúa empujando a K+ fuera de la celda. Además, la bomba de sodio-potasio está empujando a Na+ fuera de la celda. La célula regresa al potencial de la membrana en reposo y el exceso de K+ extracelular se difunde. Este intercambio de iones Na+ y K+ ocurre muy rápidamente, en menos de 1 mseg. El potencial de acción se produce en un movimiento ondulatorio hacia abajo del axón hasta que alcanza el botón terminal. Solo se ven afectados los canales iónicos muy próximos al potencial de acción.
Antes aprendiste que los axones están cubiertos de mielina. Consideremos cómo la mielina acelera el proceso del potencial de acción. Hay huecos en las vainas de mielina llamados nodos de Ranvier. La mielina aísla el axón y no permite que exista ningún líquido entre la mielina y la membrana celular. Bajo la mielina, cuando los canales de Na+ y K+ se abren, no fluyen iones entre el fluido intracelular y extracelular. Esto evita que la célula tenga que gastar la energía necesaria para rectificar o recuperar el potencial de la membrana en reposo. (Recuerde, las bombas necesitan ATP para funcionar). Bajo la mielina, el potencial de acción degrada algunos, pero sigue siendo lo suficientemente grande en potencial para desencadenar un nuevo potencial de acción en el siguiente nodo de Ranvier. Así, el potencial de acción salta activamente de nodo a nodo; este proceso se conoce como conducción saltatoria.
En el botón terminal presináptico, el potencial de acción desencadena la liberación de neurotransmisores (ver Figura 6.2.2). Los neurotransmisores cruzan la brecha sináptica y abren los subtipos de receptores de forma de llave y llave (ver Figura 6.2.2). Dependiendo del tipo de neurotransmisor, se produce un EPSP o IPSP en la dendrita de la célula possináptica. Los neurotransmisores que abren canales de Na+ o calcio (Ca+) provocan una EPSP; un ejemplo son los receptores NMDA, los cuales son activados por el glutamato (el principal neurotransmisor excitatorio en el cerebro). En contraste, los neurotransmisores que abren los canales Cl- o K+ provocan una IPSP; un ejemplo son los receptores de ácido gamma-amino butrírico (GABA), los cuales son activados por GABA, el principal neurotransmisor inhibidor en el cerebro. Una vez que los EPSP y los IPSP ocurren en el sitio postsináptico, el proceso de comunicación dentro y entre neuronas se activa en ciclos (ver Figura\(\PageIndex{3}\)). Un neurotransmisor que no se une a receptores es descompuesto e inactivado por enzimas o células gliales, o bien es retomado al botón terminal presináptico en un proceso llamado recaptación, que se discutirá más a fondo en el módulo sobre psicofarmacología.
REFERENCIAS
De Carlos, J. A., & Borrell, J. (2007). Una reflexión histórica de las contribuciones de Cajal y Golgi a los fundamentos de la neurociencia. Brain Research Reviews, 55 (1), 8—16. doi.org/10.1016/j. brainresrev.2007.03.010
Furtak, S. C., Moyer, J. R., Jr., & Brown, T. H. (2007). Morfología y ontogenia de neuronas corticales perirrinales de rata. Revista de Neurología Comparada, 505 (5), 493—510. doi.org/10.1002/cne.21516
Grant, G. (2007). Cómo se compartió el Premio Nobel de Fisiología o Medicina de 1906 entre Golgi y Cajal. Brain Research Reviews, 55 (2), 490—498. https://doi.org/10.1016/j.brainresrev.2006.11.004
Hodgkin, A. L., & Huxley, A. F. (1952). Descripción cuantitativa de la corriente de membrana y su aplicación a la conducción y excitación en nervio. Revista de Fisiología, 117 (4), 500—544. doi.org/10.1113/ jphysiol.1952.sp004764
López-Muñoz, F., Boya, J., & Alamo, C. (2006). La teoría de las neuronas, piedra angular de la neurociencia, en el centenario del Premio Nobel a Santiago Ramón y Cajal. Boletín de Investigación Cerebral, 70 (4—6), 391—405. https://doi.org/10.1016/j.brainresbull.2006.07.010
Pasternak, J. F., & Woolsey, T. A. (1975). Sobre la “selectividad” del método Golgi-Cox. Revista de Neurología Comparada, 160 (3), 307—312. doi.org/10.1002/cne.901600304
Ramón y Cajal, S. (1911). Histología del sistema nervioso del hombre y vertebrados. Prensa de la Universidad de Oxford.
Simons, M., & Trotter, J. (2007). Envolviéndolo: La biología celular de la mielinización. Opinión Actual en Neurobiología, 17 (5), 533—540. https://doi.org/10.1016/j.conb.2007.08.003
Smit, G. J., & Colon, E. J. (1969). Análisis cuantitativo de la corteza cerebral. I. Aelectividad de la técnica de tinción de Golgi-Cox. Investigación Cerebral, 13 (3), 485—510. doi.org/10.1016/ 0006-8993 (69) 90262-5
Williams, R. W., & Herrup, K. (1988). El control del número de neuronas. Revisión Anual de Neurociencia, 11, 423—453. doi.org/10.1146/ annurev.ne.11.030188.002231


