1.10: Agua y Vida
- Page ID
- 107998
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
Óxido de dihidrógeno o monóxido de dihidrógeno. ¿Este químico suena peligroso?
Otro nombre para este compuesto es... agua. El agua puede crear algunas vistas absolutamente hermosas. Las Cataratas del Iguazú son la serie de cascadas más grande del planeta, ubicadas en Brasil, Argentina y Paraguay. Y el agua es necesaria para la vida. No se puede enfatizar lo suficiente la importancia del agua para la vida. Toda la vida necesita agua. La vida comenzó en el agua. Esencialmente, sin esta simple molécula de tres átomos, la vida no existiría.
Agua
El agua, como el carbono, tiene un papel especial en los seres vivos. Es necesario por todas las formas de vida conocidas. El agua es una molécula simple, que contiene solo tres átomos. Sin embargo, la estructura del agua le otorga propiedades únicas que ayudan a explicar por qué es vital para todos los organismos vivos.
Agua, agua en todas partes
El agua es una sustancia química común en el planeta Tierra. De hecho, a la Tierra a veces se le llama el “planeta acuático” porque casi el 75% de su superficie está cubierta de agua. Si miras la Figura a continuación, verá dónde se encuentra el agua de la Tierra. El término agua generalmente se refiere a su estado líquido, y el agua es un líquido en un amplio rango de temperaturas en la Tierra. Sin embargo, el agua también se presenta en la Tierra como un sólido (hielo) y como un gas (vapor de agua).
 La mayor parte del agua en la Tierra consiste en agua salada en los océanos. ¿Qué porcentaje del agua de la Tierra es agua dulce? ¿Dónde se encuentra la mayor parte del agua dulce?
La mayor parte del agua en la Tierra consiste en agua salada en los océanos. ¿Qué porcentaje del agua de la Tierra es agua dulce? ¿Dónde se encuentra la mayor parte del agua dulce? Estructura y Propiedades del Agua
Sin duda, ya estás al tanto de algunas de las propiedades del agua. Por ejemplo, probablemente sepas que el agua es insípida e inodora. Probablemente también sepas que el agua es transparente, lo que significa que la luz puede pasar a través de ella. Esto es importante para los organismos que viven en el agua, ya que algunos de ellos necesitan luz solar para hacer comida.
Estructura Química del Agua
Para entender algunas de las propiedades del agua, es necesario conocer más sobre su estructura química. Como has visto, cada molécula de agua consiste en un átomo de oxígeno y dos átomos de hidrógeno. El átomo de oxígeno en una molécula de agua atrae electrones cargados negativamente más fuertemente que los átomos de hidrógeno. Como resultado, el átomo de oxígeno tiene una carga ligeramente negativa, y los átomos de hidrógeno tienen una carga ligeramente positiva. Una diferencia en la carga eléctrica entre diferentes partes de una misma molécula se llama polaridad, haciendo del agua una molécula polar. El diagrama de la siguiente figura muestra la polaridad del agua.
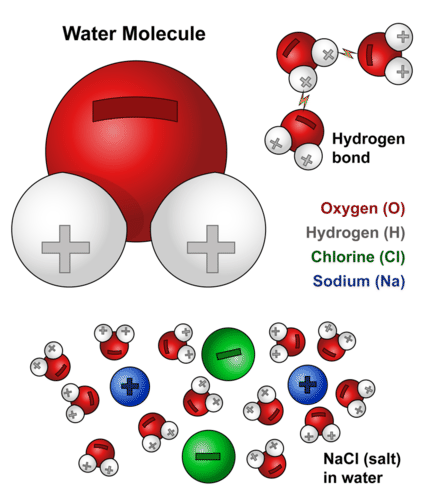 Molécula de Agua. Este diagrama muestra las partes positiva y negativa de una molécula de agua. También describe cómo una carga, como en un ion (Na o Cl, por ejemplo) puede interactuar con una molécula de agua.
Molécula de Agua. Este diagrama muestra las partes positiva y negativa de una molécula de agua. También describe cómo una carga, como en un ion (Na o Cl, por ejemplo) puede interactuar con una molécula de agua. Los opuestos se atraen cuando se trata de moléculas cargadas. En el caso del agua, el extremo positivo (hidrógeno) de una molécula de agua es atraído hacia el extremo negativo (oxígeno) de una molécula de agua cercana. Debido a esta atracción, se forman enlaces débiles entre las moléculas de agua adyacentes, como se muestra en la Figura a continuación. El tipo de enlace que se forma entre las moléculas se denomina enlace de hidrógeno. Los enlaces entre moléculas no son tan fuertes como los enlaces dentro de las moléculas. Solo hay muchos más enlaces de hidrógeno en el agua (entre moléculas de agua) que enlaces covalentes dentro de una molécula. Los enlaces de hidrógeno pueden no ser fuertes, pero en el agua son lo suficientemente fuertes como para mantener unidas las moléculas cercanas.
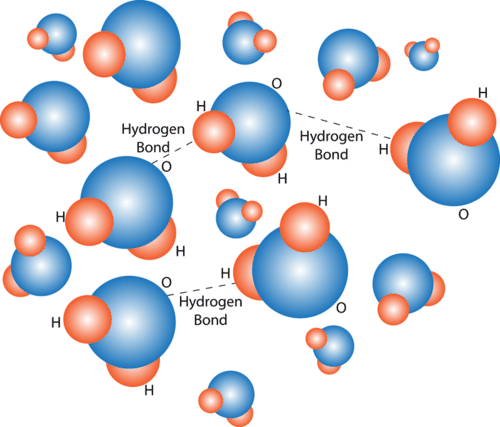 Enlace de hidrógeno en moléculas de agua. Se forman enlaces de hidrógeno entre moléculas de agua cercanas. ¿Cómo crees que esto podría afectar las propiedades del agua?
Enlace de hidrógeno en moléculas de agua. Se forman enlaces de hidrógeno entre moléculas de agua cercanas. ¿Cómo crees que esto podría afectar las propiedades del agua? Propiedades del Agua
Los enlaces de hidrógeno entre las moléculas de agua explican algunas de las propiedades del agua. Por ejemplo, los enlaces de hidrógeno explican por qué las moléculas de agua tienden a pegarse. ¿Alguna vez has visto gotear agua de un grifo con fugas o de un carcillo que se derrite? Si tienes, entonces sabes que el agua siempre cae en gotas más que como moléculas separadas. Las gotas de rocío en la Figura a continuación son otro ejemplo de moléculas de agua pegadas entre sí.
 Gotitas de Rocío. Gotas de rocío se aferran a una telaraña en esta imagen. ¿Se te ocurren otros ejemplos de gotas formadoras de agua? (Pista: ¿Qué sucede cuando cae lluvia sobre un auto recién encerado?)
Gotitas de Rocío. Gotas de rocío se aferran a una telaraña en esta imagen. ¿Se te ocurren otros ejemplos de gotas formadoras de agua? (Pista: ¿Qué sucede cuando cae lluvia sobre un auto recién encerado?) Los enlaces de hidrógeno hacen que el agua tenga un punto de ebullición relativamente alto de 100°C (212°F). Debido a su alto punto de ebullición, la mayor parte del agua en la Tierra se encuentra en estado líquido y no en estado gaseoso. El agua en su estado líquido es necesaria para todos los seres vivos. Los enlaces de hidrógeno también hacen que el agua se expanda cuando se congela. Esto, a su vez, hace que el hielo tenga una densidad (masa/volumen) menor que el agua líquida. La menor densidad de hielo significa que flota sobre el agua. Por ejemplo, en climas fríos, el hielo flota sobre el agua en los lagos. Esto permite que los animales del lago como los peces sobrevivan al invierno permaneciendo en el agua bajo el hielo.
Agua y Vida
El cuerpo humano es aproximadamente 70% de agua (sin contar el agua en la grasa corporal, que varía de persona a persona). El cuerpo necesita toda esta agua para funcionar normalmente. ¿Por qué tanta agua requieren los seres humanos y otros organismos? El agua puede disolver muchas sustancias que los organismos necesitan, y es necesaria para muchas reacciones bioquímicas. Los ejemplos a continuación se encuentran entre los procesos bioquímicos más importantes que ocurren en los seres vivos, pero son solo dos de las muchas formas en que el agua está involucrada en las reacciones bioquímicas.
- Fotosíntesis: en este proceso, las células utilizan la energía de la luz solar para cambiar el dióxido de carbono y el agua a glucosa y oxígeno. El agua es un reactivo en este proceso. Las reacciones de la fotosíntesis pueden ser representadas por la ecuación química
6CO 2 + 6H 2 O + Energía → C 6 H 12 O 6 + 6O 2.
- Respiración celular: en este proceso, las células descomponen la glucosa en presencia de oxígeno y liberan dióxido de carbono, agua (un producto) y energía. Las reacciones de la respiración celular pueden ser representadas por la ecuación química
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + Energía.
El agua está involucrada en muchas otras reacciones bioquímicas. Como resultado, casi todos los procesos de vida dependen del agua. Claramente, la vida tal como la conocemos no podría existir sin agua.
Resumen
- El agua es necesaria para todas las formas de vida conocidas.
- Debido a la diferencia en la distribución de carga, el agua es una molécula polar.
- Los enlaces de hidrógeno mantienen unidas las moléculas de agua adyacentes.
- El agua está involucrada en muchas reacciones bioquímicas. Como resultado, casi todos los procesos de vida dependen del agua.
Revisar
- ¿Dónde se encuentra la mayor parte del agua de la Tierra?
- ¿Qué porcentaje del agua de la Tierra es agua dulce?
- ¿Qué es la polaridad? Describir la polaridad del agua.
- ¿Cómo podría demostrarle a un niño que el agua sólida es menos densa que el agua líquida?
- Explique cómo se relaciona la polaridad del agua con su punto de ebullición.
- Explicar por qué el metabolismo en los organismos depende del agua.
| Imagen | Referencia | Atribuciones |
 |
[Figura 1] | Crédito: flickr:devra Fuente: http://www.flickr.com/photos/minicooper93402/6181554829/ Licencia: CC BY-NC 3.0 |
 |
[Figura 2] | Crédito: Mariana Ruiz Villarreal (LadyOFHats) para la Fundación CK-12 Fuente: Fundación CK-12 Licencia: CC BY-NC 3.0 |
 |
[Figura 3] | Crédito: Mariana Ruiz Villarreal (LadyOFHats) para la Fundación CK-12 Fuente: Fundación CK-12 Licencia: CC BY-NC 3.0 |
 |
[Figura 4] | Crédito: Jodi So Fuente: Fundación CK-12 Licencia: CC BY-NC 3.0 |
 |
[Figura 5] | Crédito: Flickr:devra; Mariana Ruiz Villarreal (LadyOFHats) para la Fundación CK-12 Fuente: http://www.flickr.com/photos/minicooper93402/6181554829/; Fundación CK-12 Licencia: CC BY 2.0; CC BY-NC 3.0 |

