1.9: Función enzimática
- Page ID
- 107971
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
¿Las células tienen una enzima con muchas funciones, o muchas enzimas, cada una con una sola función?
Enzimas. Proteínas vitales necesarias para la vida. Entonces, ¿cómo funcionan las enzimas? ¿Cómo catalizan una sola reacción bioquímica específica? En un rompecabezas, solo dos piezas encajarán correctamente. Comprender ese es uno de los principales pasos para entender cómo funcionan las enzimas.
Función Enzimática
¿Cómo aceleran las enzimas las reacciones bioquímicas tan dramáticamente? Como todos los catalizadores, las enzimas funcionan disminuyendo la energía de activación de las reacciones químicas. La energía de activación es la energía necesaria para iniciar una reacción química. Esto se ilustra en la Figura a continuación. La reacción bioquímica mostrada en la figura requiere aproximadamente tres veces más energía de activación sin la enzima que con la enzima.
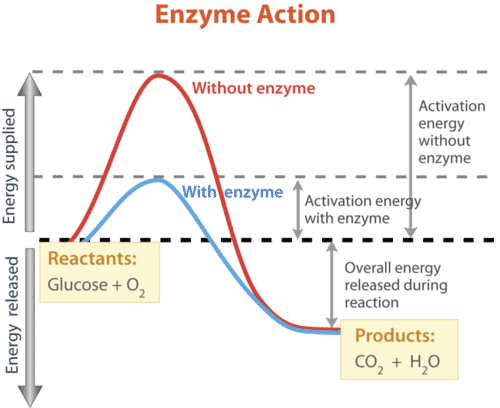
La reacción representada por esta gráfica es una reacción de combustión que involucra a los reactivos glucosa (C 6 H 12 O 6) y oxígeno (O 2). Los productos de la reacción son dióxido de carbono (CO 2) y agua (H 2 O). La energía también se libera durante la reacción. La enzima acelera la reacción al disminuir la energía de activación necesaria para que comience la reacción. Comparar la energía de activación con y sin la enzima.
Las enzimas generalmente reducen la energía de activación al reducir la energía necesaria para que los reactivos se unan y reaccionen. Por ejemplo:
- Las enzimas unen a los reactivos para que no tengan que gastar energía moviéndose hasta que choquen al azar. Las enzimas se unen a ambas moléculas reaccionantes (llamadas sustrato), de manera firme y específica, en un sitio de la molécula enzimática llamado sitio activo (Figura a continuación).
- Al unir los reactivos en el sitio activo, las enzimas también posicionan correctamente los reactivos, por lo que no tienen que superar fuerzas intermoleculares que de otro modo los separarían. Esto permite que las moléculas interactúen con menos energía.
- Las enzimas también pueden permitir que se produzcan reacciones por diferentes vías que tienen menor energía de activación.
El sitio activo es específico para los reactivos de la reacción bioquímica que cataliza la enzima. Al igual que las piezas del rompecabezas que encajan entre sí, el sitio activo solo puede unir ciertos sustratos.
 Esta molécula enzimática se une a moléculas reaccionantes, llamadas sustrato, en su sitio activo, formando un complejo enzima-sustrato. Esto une a los reactivos y los posiciona correctamente para que pueda ocurrir la reacción. Después de la reacción, los productos se liberan del sitio activo de la enzima. Esto libera la enzima para que pueda catalizar reacciones adicionales.
Esta molécula enzimática se une a moléculas reaccionantes, llamadas sustrato, en su sitio activo, formando un complejo enzima-sustrato. Esto une a los reactivos y los posiciona correctamente para que pueda ocurrir la reacción. Después de la reacción, los productos se liberan del sitio activo de la enzima. Esto libera la enzima para que pueda catalizar reacciones adicionales. Las actividades de las enzimas también dependen de la temperatura, las condiciones iónicas y el pH del entorno. Algunas enzimas funcionan mejor a pH ácidos, mientras que otras funcionan mejor en ambientes neutros.
- Las enzimas digestivas secretadas en el ambiente ácido (pH bajo) del estómago ayudan a descomponer las proteínas en moléculas más pequeñas. La principal enzima digestiva en el estómago es la pepsina, que funciona mejor a un pH de aproximadamente 1.5. Estas enzimas no funcionarían óptimamente a otros pH. La tripsina es otra enzima en el sistema digestivo, que rompe las cadenas proteicas de los alimentos en partes más pequeñas. La tripsina actúa en el intestino delgado, que no es un ambiente ácido. El pH óptimo de la tripsina es de aproximadamente 8.
- Las reacciones bioquímicas son óptimas a temperaturas fisiológicas. Por ejemplo, la mayoría de las reacciones bioquímicas funcionan mejor a la temperatura corporal normal de 98.6˚F Muchas enzimas pierden función a temperaturas cada vez más bajas. A temperaturas más altas, la forma de una enzima se deteriora. Sólo cuando la temperatura vuelve a la normalidad la enzima vuelve a recuperar su forma y actividad normal.
Resumen
- Las enzimas funcionan disminuyendo la energía de activación necesaria para iniciar reacciones bioquímicas.
- Las actividades de las enzimas dependen de la temperatura, las condiciones iónicas y el pH del entorno.
Revisar
- ¿Cómo aceleran las enzimas las reacciones bioquímicas?
- ¿Dónde se encuentra el sitio activo? ¿Explicar el papel del sitio activo?
- Completa esta frase: Las actividades de las enzimas dependen de las condiciones __________, __________ y __________ de los alrededores.
- Distinguir entre las condiciones necesarias para el correcto funcionamiento de la pepsina y la tripsina.
| Imagen | Referencia | Atribuciones |
 |
[Figura 1] | Crédito: Jerry Crimson Mann (Wikimedia: Mcy jerry); Hana Zavadska; Laura Guerin Fuente: Commons.wikimedia.org/wiki/Archivo:alosteric_competitive_inhibition_3.svg; CK-12 Licencia de Fundación: CC BY-NC 3.0 |
 |
[Figura 2] | Crédito: Hana Zavadska; Jerry Crimson Mann (Wikimedia: Mcy jerry) Fuente: Fundación CK-12; Commons.wikimedia.org/wiki/Archivo:alosteric_competitive_inhibition_3.svg Licencia: CC BY-NC 3.0 |
 |
[Figura 3] | Crédito: Laura Guerin; Jerry Crimson Mann (Wikimedia: Mcy jerry) Fuente: Fundación CK-12; Commons.wikimedia.org/wiki/Archivo:allosteric_competitive_inhibition_3.svg Licencia: CC BY-NC 3.0 |

