5.4: La estructura del átomo
- Page ID
- 127669
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
Al final de esta sección, podrás:
- Describir la estructura de los átomos y los componentes de los núcleos
- Explicar el comportamiento de los electrones dentro de los átomos y cómo los electrones interactúan con la luz para moverse entre los niveles de energía
La idea de que la materia está compuesta por partículas diminutas llamadas átomos tiene al menos 25 siglos de antigüedad. Se tardó hasta el siglo XX, sin embargo, para que los científicos inventaran instrumentos que les permitieran sondear dentro de un átomo y encontrar que no es, como se había pensado, duro e indivisible. En cambio, el átomo es una estructura compleja compuesta por partículas aún más pequeñas.
Sondeando el Átomo
La primera de estas partículas más pequeñas fue descubierta por el físico británico James (J. J.) Thomson en 1897. Denominada el electrón, esta partícula está cargada negativamente. (Es el flujo de estas partículas el que produce corrientes de electricidad, ya sea en los relámpagos o en los cables que conducen a su lámpara). Debido a que un átomo en su estado normal es eléctricamente neutro, cada electrón en un átomo debe ser equilibrado por la misma cantidad de carga positiva.
El siguiente paso fue determinar en qué parte del átomo se encuentran las cargas positivas y negativas. En 1911, el físico británico Ernest Rutherford ideó un experimento que proporcionó parte de la respuesta a esta pregunta. Bombardeó una pieza extremadamente delgada de lámina de oro, de sólo unos 400 átomos de espesor, con un haz de partículas alfa (Figura\(\PageIndex{1}\)). Las partículas alfa (partículas α) son átomos de helio que han perdido sus electrones y por lo tanto están cargadas positivamente. La mayoría de estas partículas pasaban por la lámina de oro como si ésta y los átomos en ella fueran un espacio casi vacío. Aproximadamente 1 de cada 8000 de las partículas alfa, sin embargo, invirtieron completamente la dirección y rebotaron hacia atrás desde la lámina. Rutherford escribió: “Fue el evento más increíble que me haya pasado en mi vida. Fue casi tan increíble como si dispararas un caparazón de 15 pulgadas a un trozo de papel tisú y volviera y te golpeara”.
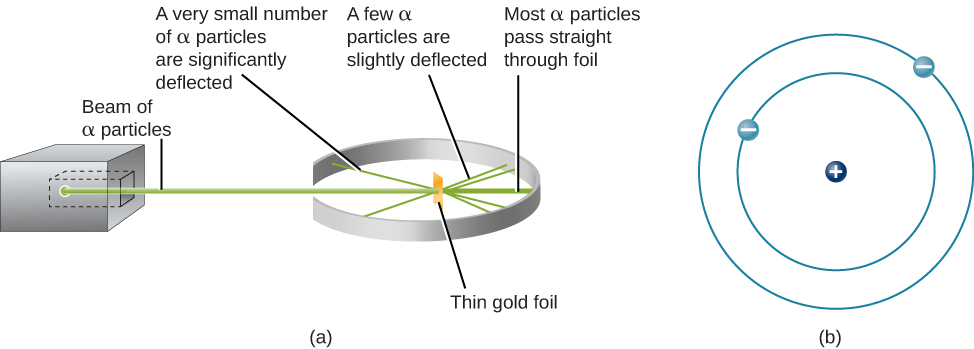
La única manera de dar cuenta de las partículas que invertieron dirección cuando golpearon la lámina de oro era asumir que casi toda la masa, así como toda la carga positiva en cada átomo de oro individual, se concentra en un diminuto centro o núcleo. Cuando una partícula alfa cargada positivamente golpea un núcleo, invierte la dirección, tanto como una bola cue invierte la dirección cuando golpea otra bola de billar. El modelo de Rutherford colocó el otro tipo de carga, los electrones negativos, en órbita alrededor de este núcleo.
El modelo de Rutherford requería que los electrones estén en movimiento. Las cargas positivas y negativas se atraen entre sí, por lo que los electrones estacionarios caerían en el núcleo positivo. Además, debido a que tanto los electrones como el núcleo son extremadamente pequeños, la mayor parte del átomo está vacío, razón por la cual casi todas las partículas de Rutherford pudieron pasar a través de la lámina de oro sin chocar con nada. El modelo de Rutherford fue una explicación muy exitosa de los experimentos que realizó, aunque eventualmente los científicos descubrirían que incluso el núcleo mismo tiene estructura.
El Núcleo Atómico
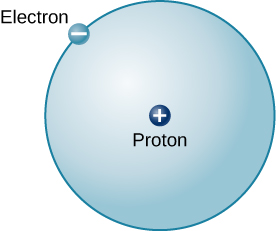
El átomo más simple posible (y el más común en el Sol y las estrellas) es el hidrógeno. El núcleo de hidrógeno ordinario contiene un solo protón. Moverse alrededor de este protón es un solo electrón. La masa de un electrón es casi 2000 veces menor que la masa de un protón; el electrón lleva una cantidad de carga exactamente igual a la del protón pero de signo opuesto (Figura\(\PageIndex{2}\)). Las cargas opuestas se atraen entre sí, por lo que es una fuerza electromagnética que mantiene unidos al protón y al electrón, así como la gravedad es la fuerza que mantiene a los planetas en órbita alrededor del Sol.
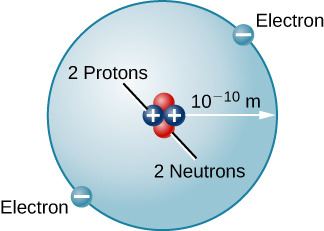
Hay muchos otros tipos de átomos en la naturaleza. El helio, por ejemplo, es el segundo elemento más abundante en el Sol. El helio tiene dos protones en su núcleo en lugar del protón único que caracteriza al hidrógeno. Además, el núcleo de helio contiene dos neutrones, partículas con una masa comparable a la del protón pero sin carga eléctrica. Moviéndose alrededor de este núcleo hay dos electrones, por lo que la carga neta total del átomo de helio también es cero (Figura\(\PageIndex{3}\)).
A partir de esta descripción de hidrógeno y helio, quizás hayas adivinado el patrón para construir todos los elementos (diferentes tipos de átomos) que encontramos en el universo. El tipo de elemento está determinado por el número de protones en el núcleo del átomo. Por ejemplo, cualquier átomo con seis protones es el elemento carbono, con ocho protones es oxígeno, con 26 es hierro, y con 92 es uranio. En la Tierra, un átomo típico tiene el mismo número de electrones que los protones, y estos electrones siguen patrones orbitales complejos alrededor del núcleo. En lo profundo de las estrellas, sin embargo, hace tanto calor que los electrones se sueltan del núcleo y (como veremos) llevan vidas separadas pero productivas.
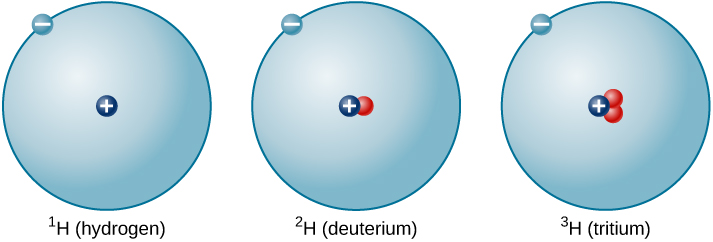
La proporción de neutrones a protones aumenta a medida que aumenta el número de protones, pero cada elemento es único. El número de neutrones no es necesariamente el mismo para todos los átomos de un elemento dado. Por ejemplo, la mayoría de los átomos de hidrógeno no contienen neutrones en absoluto. Sin embargo, hay átomos de hidrógeno que contienen un protón y un neutrón, y otros que contienen un protón y dos neutrones. Los diversos tipos de núcleos de hidrógeno con diferentes números de neutrones se denominan isótopos de hidrógeno (Figura\(\PageIndex{4}\)), y todos los demás elementos tienen isótopos también. Se puede pensar en los isótopos como hermanos en el mismo elemento “familia” —estrechamente relacionados pero con diferentes características y comportamientos.
Para explorar la estructura de los átomos, vaya al sitio web PhET Build an Atom donde puede agregar protones, neutrones o electrones a un modelo y aparecerá el nombre del elemento que ha creado. También se puede ver la carga neta, el número de masa, si es estable o inestable, y si es un ion o un átomo neutro.
El átomo de Bohr
El modelo de Rutherford para los átomos tiene un problema grave. La teoría de Maxwell de la radiación electromagnética dice que cuando los electrones cambian ya sea de velocidad o de dirección de movimiento, deben emitir energía. Los electrones orbitantes cambian constantemente su dirección de movimiento, por lo que deben emitir una corriente constante de energía. Aplicando la teoría de Maxwell al modelo de Rutherford, todos los electrones deberían entrar en espiral en el núcleo del átomo a medida que pierden energía, y este colapso debería ocurrir muy rápidamente, en unos 10 —16 segundos.
Fue el físico danés Niels Bohr (1885—1962) quien resolvió el misterio de cómo los electrones permanecen en órbita. Estaba tratando de desarrollar un modelo del átomo que explicara también ciertas regularidades observadas en el espectro del hidrógeno. Sugirió que el espectro del hidrógeno se puede entender si asumimos que órbitas de sólo ciertos tamaños son posibles para el electrón. Bohr asumió además que mientras el electrón se mueva en solo una de estas órbitas permitidas, no irradia energía: su energía cambiaría sólo si se movía de una órbita a otra.
Esta sugerencia, en palabras del historiador de la ciencia Abraham Pais, fue “una de las hipótesis más audaces jamás introducidas en la física”. Si algo equivalente estuviera funcionando en el mundo cotidiano, podrías encontrar que, al salir a caminar después de la clase de astronomía, la naturaleza te permitía caminar dos pasos por minuto, cinco pasos por minuto y 12 pasos por minuto, pero sin velocidades en el medio. No importa cómo trataras de mover las piernas, solo se permitirían ciertas velocidades de caminata. Para hacer las cosas más extrañas, no se necesitaría ningún esfuerzo caminar a ninguna de las velocidades permitidas, pero sería difícil cambiar de una velocidad a otra. Por suerte, no se aplican tales reglas a nivel de comportamiento humano. Pero a nivel microscópico del átomo, experimento tras experimento ha confirmado la validez de la extraña idea de Bohr. Las sugerencias de Bohr se convirtieron en una de las bases del nuevo (y mucho más sofisticado) modelo del mundo subatómico llamado mecánica cuántica.
En el modelo de Bohr, si el electrón se mueve de una órbita a otra más cerca del núcleo atómico, debe renunciar a algo de energía en forma de radiación electromagnética. Si el electrón va de una órbita interna a una más alejada del núcleo, sin embargo, requiere algo de energía adicional. Una forma de obtener la energía necesaria es absorber la radiación electromagnética que puede estar fluyendo más allá del átomo desde una fuente externa.
Una característica clave del modelo de Bohr es que cada una de las órbitas de electrones permitidas alrededor de un átomo dado tiene un cierto valor energético; por lo tanto, podemos pensar en cada órbita como un nivel de energía. Para pasar de una órbita a otra (que tendrá su propio valor energético específico) requiere un cambio en la energía del electrón, un cambio determinado por la diferencia entre los dos valores de energía. Si el electrón va a un nivel inferior, se emitirá la diferencia de energía; si el electrón va a un nivel superior, la diferencia de energía debe obtenerse de otro lugar. Cada salto (o transición) a un nivel diferente tiene asociado un cambio energético fijo y definido.
Una cruda analogía para esta situación podría ser la vida en una torre de departamentos de lujo donde la renta está determinada por la calidad de la vista. Dicho edificio tiene ciertos niveles o pisos numerados definidos en los que se encuentran los departamentos. Nadie puede vivir en el piso 5.37 o 22.5. Además, la renta sube a medida que vas subiendo a pisos superiores. Si quieres cambiar un departamento en el piso veinte por uno en el segundo piso, no debes tanta renta. No obstante, si quieres pasar del tercer piso al vigésimo quinto piso, tu renta aumentará. En un átomo, también, el lugar “más barato” para que un electrón viva es el nivel más bajo posible, y se requiere energía para pasar a un nivel superior.
Aquí tenemos una de las situaciones en las que es más fácil pensar en la radiación electromagnética como partículas (fotones) más que como ondas. A medida que los electrones se mueven de un nivel a otro, emiten o absorben pequeños paquetes de energía. Cuando un electrón se mueve a un nivel superior, absorbe un fotón de la energía justa (siempre que esté disponible). Cuando se mueve a un nivel inferior, emite un fotón con la cantidad exacta de energía que ya no necesita en su “situación de vida de menor costo”.
Las perspectivas de fotón y onda deben ser equivalentes: la luz es luz, no importa cómo la veamos. Así, cada fotón lleva una cierta cantidad de energía que es proporcional a la frecuencia (\(f\)) de la onda que representa. El valor de su energía (\(E\)) viene dado por la fórmula
\[E=hf \nonumber\]
donde la constante de proporcionalidad\(h\),, se llama constante de Planck.
La constante lleva el nombre de Max Planck, el físico alemán que fue uno de los originadores de la teoría cuántica (Figura\(\PageIndex{5}\)). Si se utilizan unidades métricas (es decir, si la energía se mide en julios y la frecuencia en hercios), entonces la constante de Planck tiene el valor\(h = 6.626 \times 10^{–34}\) julio-segundos (J-s). Los fotones de mayor energía corresponden a ondas de mayor frecuencia (que tienen una longitud de onda más corta); los fotones de menor energía son ondas de menor frecuencia.

Para tomar un ejemplo específico, considere un átomo de calcio dentro de la atmósfera del Sol en el que un electrón salta de un nivel inferior a un nivel superior. Para ello, necesita alrededor de 5 × 10 —19 julios de energía, que puede obtener convenientemente absorbiendo un fotón que pasa de esa energía proveniente de lo más profundo del interior del Sol. Este fotón es equivalente a una onda de luz cuya frecuencia es de aproximadamente 7.5 × 10 14 hertz y cuya longitud de onda es de aproximadamente 3.9 × 10 —7 metros (393 nanómetros), en la parte violeta profunda del espectro de luz visible. Aunque puede parecer extraño al principio cambiar de la imagen de la luz como un fotón (o paquete de energía) a imaginarla como una onda, tal conmutación se ha convertido en una segunda naturaleza para los astrónomos y puede ser una herramienta útil para hacer cálculos sobre espectros.
Ejemplo\(\PageIndex{1}\): La energía de un fotón
Ahora que sabemos calcular la longitud de onda y frecuencia de un fotón, podemos usar esta información, junto con la constante de Planck, para determinar cuánta energía transporta cada fotón. ¿Cuánta energía tiene un fotón rojo de longitud de onda 630 nm?
Solución
Primero, como aprendimos antes, podemos encontrar la frecuencia del fotón:
\[f= \frac{c}{ \lambda} = \frac{3 \times 10^8 \text{ m/s}}{630 \times 10^{–9} \text{ m}} = 4.8 \times 10^{14} \text{ Hz} \nonumber\]
A continuación, podemos usar la constante de Planck para determinar la energía (recuerde que un Hz es lo mismo que 1/s):
\[E=hf= \left( 6.626 \times 10^{–34} \text{ J-s} \right) \left( 4.8 \times 10^{14} (1/\text{s}) \right)=3.2 \times 10^{–19} \text{ J} \nonumber\]
Ejercicio\(\PageIndex{1}\)
¿Cuál es la energía de un fotón amarillo con una frecuencia de 5.5 × 10 14 Hz?
- Contestar
-
\[E=hf= \left(6.626 \times10^{–34} \right) \left(5.5 \times 10^{14} \right) = 3.6 \times 10^{–19} \text{ J} \nonumber\]
Conceptos clave y resumen
Los átomos consisten en un núcleo que contiene uno o más protones cargados positivamente. Todos los átomos excepto el hidrógeno también pueden contener uno o más neutrones en el núcleo. Los electro ns cargados negativamente orbitan el núcleo. El número de protones define un elemento (el hidrógeno tiene un protón, el helio tiene dos, y así sucesivamente) del átomo. Los núcleos con el mismo número de protones pero diferentes números de neutrones son diferentes isótopos del mismo elemento. En el modelo Bohr del átomo, los electrones en órbitas permitidas (o niveles de energía) no emiten ninguna radiación electromagnética. Pero cuando los electrones pasan de niveles inferiores a niveles superiores, deben absorber un fotón de la energía justa, y cuando pasan de niveles superiores a niveles inferiores, emiten un fotón de la energía justa. La energía de un fotón está conectada a la frecuencia de la onda electromagnética que representa por la fórmula de Planck,\(E=hf\).
Glosario
- nivel de energía
- un nivel particular, o cantidad, de energía que posee un átomo o ion por encima de la energía que posee en su estado menos energético; también se utiliza para referirse a los estados de energía que un electrón puede tener en un átomo
- isótopo
- cualquiera de dos o más formas del mismo elemento cuyos átomos tienen el mismo número de protones pero diferentes números de neutrones
- núcleo (de un átomo)
- la parte masiva de un átomo, compuesta principalmente por protones y neutrones, y sobre la cual giran los electrones


