12.6: Descubrimiento del Núcleo Atómico
- Page ID
- 133801
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Describir cómo se descubrieron los electrones.
- Describir el experimento de lámina de oro de Rutherford y su papel en el descubrimiento del núcleo atómico.
- Describir el modelo planetario del átomo de Rutherford.
Muchos estudiantes de física hoy dan por sentado que los átomos constituyen toda la materia y que estos átomos están formados por partículas subatómicas, electrones, protones y neutrones. En esta sección nos fijamos en el descubrimiento de estas partes, con el fin de observar los conceptos mecánicos cuánticos que se desarrollaron para construir un modelo autoconsistente del átomo.
El electrón
Aunque ya hemos estado usando la idea (y objeto físico) del electrón para discutir la electricidad y algunos conceptos fundamentales de la mecánica cuántica, aún no hemos mirado cómo se descubrieron los electrones por primera vez, mucho antes del descubrimiento de otras partículas subatómicas. Se descubrieron electrones y se midieron sus propiedades en tubos de descarga de gas, similares a los mostrados en la Figura\(\PageIndex{1}\), los cuales también se conocían como tubos de rayos catódicos. Consiste en un tubo de vidrio evacuado que contiene dos electrodos metálicos y un gas enrarecido. Cuando se aplica un alto voltaje a los electrodos, el gas brilla. Primero fueron estudiados seriamente por Heinrich Geissler, un inventor y soplador de vidrio alemán, a partir de la década de 1860. El científico inglés William Crookes, entre otros, continuó estudiándolos (a veces los tubos de rayos catódicos se llaman “tubos Crookes”). El gas brilla por la interacción de los “rayos catódicos” y el gas enrarecido. Las partículas de rayos catódicos (las llamamos ahora “electrones”) se aceleran alejándose del cátodo cargado negativamente por el alto voltaje que se le aplica. A medida que los electrones colisionan con los átomos y moléculas de gas (más comúnmente se usa argón, pero se pueden usar otros tipos de gas inerte), los átomos y moléculas de gas fluorescen y brillan, haciendo visible la trayectoria de los electrones como un rayo que se propaga y se desvanece a medida que se aleja del cátodo.

El físico inglés J. J. Thomson (1856—1940) mejoró y amplió el alcance de los experimentos con tubos de descarga de gas. (Ver Figura\(\PageIndex{2}\) y Figura\(\PageIndex{3}\).) Verificó la carga negativa de los rayos catódicos tanto con campos magnéticos como eléctricos. Adicionalmente, recolectó los rayos en una copa metálica y encontró un exceso de carga negativa. Thomson también pudo medir la relación de la carga del electrón a su masa,\(q_{e} / m_{e}\) —un paso importante para encontrar los valores reales de ambos\(q_{e}\) y\(m_{e}\). La figura\(\PageIndex{4}\) muestra un tubo de rayos catódicos, que produce un haz estrecho de electrones que pasa a través de placas de carga conectadas a una fuente de alimentación de alto voltaje. \(\mathbf{E}\)Se produce un campo eléctrico entre las placas de carga, y el tubo de rayos catódicos se coloca entre los polos de un imán para que el campo eléctrico\(\mathbf{E}\) sea perpendicular al campo magnético\(\mathbf{B}\) del imán. Estos campos, al ser perpendiculares entre sí, producen fuerzas opuestas sobre los electrones, con las dos fuerzas equilibrándose entre sí cuando la velocidad de la partícula cargada es\(v=E / B\). De esta manera, Thomson determinó la velocidad de los electrones y luego movió el haz hacia arriba y hacia abajo ajustando el campo eléctrico.

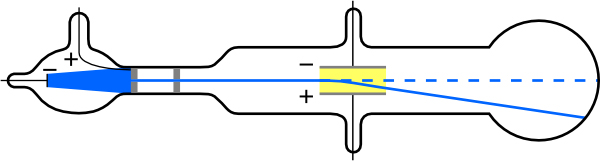

Esta deflexión con la aplicación adicional de campo eléctrico se puede utilizar para medir y calcular la relación carga-masa\(q_{e} / m_{e}\), considerando la fuerza eléctrica y la cinemática de la partícula cargada que se mueve mientras se acelera a una velocidad constante por una fuerza eléctrica. Otra forma de medir la relación carga-masa es aplicando un campo magnético y analizando el movimiento circular que resulta de la fuerza magnética centrípeta.
¿Qué tiene de importante\(q_{e} / m_{e}\), la relación entre la carga del electrón y su masa? El valor obtenido es
\[\frac{q_{e}}{m_{e}}=-1.76 \times 10^{11} \mathrm{C} / \mathrm{kg} \text { (electron). } \nonumber \]
Se trata de un número enorme, como se dio cuenta Thomson, e implica que el electrón tiene una masa muy pequeña. Se sabía por galvanoplastia que\(10^{8} ~\mathrm{C} / \mathrm{kg}\) se necesita aproximadamente para platear un material, un factor de aproximadamente 1000 menos que la carga por kilogramo de electrones. Thomson pasó a hacer el mismo experimento para iones de hidrógeno cargados positivamente (ahora conocidos por ser protones desnudos) y encontró una carga por kilogramo aproximadamente 1000 veces menor que la del electrón, lo que implica que el protón es aproximadamente 1000 veces más masivo que el electrón. Hoy en día, sabemos más precisamente que
\[\frac{q_{p}}{m_{p}}=9.58 \times 10^{7} \mathrm{C} / \mathrm{kg} \text { (proton) }, \nonumber \]
donde\(q_{p}\) está la carga del protón y\(m_{p}\) es su masa. Esta relación (a cuatro cifras significativas) es 1836 veces menos carga por kilogramo que para el electrón. Dado que las cargas de electrones y protones son iguales en magnitud, esto implica\(m_{p}=1836 m_{e}\).
Thomson realizó una variedad de experimentos usando diferentes gases en tubos de descarga y empleando otros métodos, como el efecto fotoeléctrico, para liberar electrones de átomos. Siempre encontró las mismas propiedades para el electrón, demostrando que es una partícula independiente. Por su obra, las piezas importantes de las que comenzó a publicar en 1897, Thomson fue galardonado con el Premio Nobel de Física de 1906. En retrospectiva, es difícil apreciar lo asombroso que fue encontrar que el átomo tiene una subestructura. El propio Thomson dijo: “Fue solo cuando estaba convencido de que el experimento no dejó escapatoria de él que publiqué mi creencia en la existencia de cuerpos más pequeños que los átomos”.
Hoy en día, los valores numéricos de carga de electrones y protones (cuya magnitud también se conoce como “carga elemental” y se denota con el símbolo ee) y las masas de electrones y protones se miden y se conocen con muy alta precisión. Sus valores (sólo hasta tres cifras significativas) son,
\[e=1.60 \times 10^{-19} ~\mathrm{C} \text { (elementary charge), } \nonumber \]
\[m_{e}=9.11 \times 10^{-31} \mathrm{~kg} \text { (electron's mass), } \nonumber \]
y
\[m_{p}=1.67 \times 10^{-27} \mathrm{~kg} \text { (proton's mass). } \nonumber \]
Dada la masa extremadamente pequeña del electrón, la masa de protones es casi idéntica a la masa de un átomo de hidrógeno. Lo que Thomson (y otros que midieron las propiedades del electrón) había hecho fue probar la existencia de una subestructura de átomos, el electrón, y además mostrar que solo tenía una pequeña fracción de la masa de un átomo. Lo que ahora conocemos como núcleo atómico contiene la mayor parte de la masa del átomo, y la naturaleza del núcleo era completamente imprevista, como veremos.
El Núcleo
Aquí se examina la primera evidencia directa del tamaño y la masa del núcleo.
La radiactividad nuclear fue descubierta en 1896, y pronto fue objeto de intenso estudio por parte de varios de los mejores científicos del mundo. Entre ellos se encontraba el neozelandés Lord Ernest Rutherford, quien realizó numerosos descubrimientos fundamentales y se ganó el título de “padre de la física nuclear”. Nacido en Nelson, Rutherford realizó sus estudios de posgrado en los Laboratorios Cavendish en Inglaterra antes de ocupar un puesto en la Universidad McGill en Canadá donde realizó el trabajo que le valió el Premio Nobel de Química en 1908. En el área de la física atómica y nuclear, hay mucho solapamiento entre la química y la física, proporcionando la física las teorías habilitadoras fundamentales. Regresó a Inglaterra en años posteriores y tuvo seis futuros ganadores del Premio Nobel como estudiantes. Rutherford utilizó la radiación nuclear para examinar directamente el tamaño y la masa del núcleo atómico. El experimento que ideó se muestra en la Figura\(\PageIndex{5}\). Una fuente radiactiva que emite radiación alfa se colocó en un contenedor de plomo con un agujero en un lado para producir un haz de partículas alfa, que son un tipo de radiación ionizante expulsada por los núcleos de una fuente radiactiva. Se colocó una fina lámina de oro en el haz, y la dispersión de las partículas alfa se observó por el resplandor que provocaron al impactar contra una pantalla de fósforo.
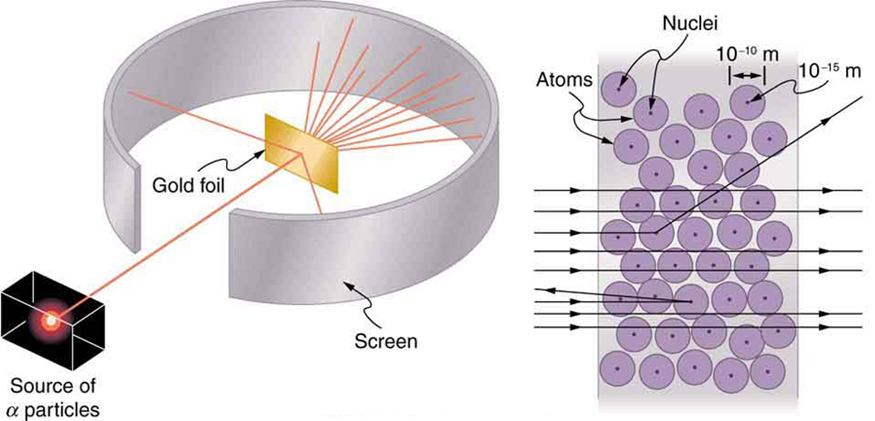
Se sabía que las partículas alfa eran los núcleos positivos doblemente cargados de átomos de helio que tenían energías cinéticas del orden de\(5 ~\mathrm{MeV}\) cuando se emitían en la desintegración nuclear, que es la desintegración del núcleo de un nucleido inestable por la emisión espontánea de partículas cargadas. Estas partículas interactúan con la materia principalmente a través de la fuerza de Coulomb, y la manera en que se dispersan de los núcleos puede revelar el tamaño y la masa nuclear. Esto es análogo a observar cómo una bola de boliche es dispersada por un objeto que no se puede ver directamente. Debido a que la energía de la partícula alfa es tan grande en comparación con las energías típicas asociadas con los átomos (\(\mathrm{MeV}\)versus\(\mathrm{eV}\)), se esperaría que las partículas alfa simplemente chocaran a través de una lámina delgada de manera muy similar a que una bola de boliche supersónica se estrellaría a través de unas pocas docenas de filas de bolos. Thomson había imaginado que el átomo era una pequeña esfera en la que cantidades iguales de carga positiva y negativa se distribuyeran uniformemente. Las partículas alfa masivas incidentes sufrirían solo pequeñas deflexiones en tal modelo. En cambio, Rutherford y sus colaboradores encontraron que las partículas alfa ocasionalmente se dispersaban en grandes ángulos, ¡algunas incluso de vuelta en la dirección de donde venían! Un análisis detallado utilizando la conservación del impulso y la energía, particularmente del pequeño número que regresó directamente, implicó que había una subestructura muy pequeña y estrechamente ligada del átomo de oro que contiene casi toda la masa del átomo (ahora llamamos a este núcleo de oro). Dado que el núcleo de oro es varias veces más masivo que la partícula alfa, una colisión frontal dispersaría la partícula alfa directamente hacia la fuente.
Si bien los resultados del experimento fueron publicados por sus colegas en 1909, Rutherford tardó dos años en convencerse de su significado. Al igual que Thomson antes que él, Rutherford se mostró reacio a aceptar resultados tan radicales. La naturaleza a pequeña escala es tan diferente a nuestro mundo clásico que incluso a quienes están a la vanguardia del descubrimiento a veces se sorprenden. Rutherford escribió más tarde: “Fue casi tan increíble como si dispararas un caparazón de 15 pulgadas a un trozo de papel tisú y volviera y te golpeara. En consideración, me di cuenta de que esta dispersión hacia atrás... [significaba]... la mayor parte de la masa del átomo estaba concentrada en un núcleo minúsculo”. En 1911, Rutherford publicó su análisis junto con un modelo propuesto del átomo. Se determinó que el tamaño del núcleo era aproximadamente\(10^{-15} \mathrm{~m}\), o 100.000 veces menor que el átomo. Esto implica una enorme densidad, del orden de\(10^{15} \mathrm{~g} / \mathrm{cm}^{3}\), muy diferente a cualquier materia macroscópica. También está implícita la existencia de fuerzas nucleares previamente desconocidas para contrarrestar las enormes fuerzas repulsivas de Coulomb entre las cargas positivas en el núcleo. Enormes fuerzas también serían consistentes con las grandes energías emitidas en la radiación nuclear.
El pequeño tamaño del núcleo también implica que el átomo está mayormente vacío por dentro; hoy usamos la “nube de electrones” para describir cuánto del volumen del átomo está lleno con los electrones, pero como los electrones tienen masas tan pequeñas, las partículas alfa energéticas pasan a través de ellos en su mayoría sin afectar. Ya había indicios de esto en el momento en que Rutherford realizó sus experimentos, ya que se había observado que los electrones energéticos penetraban en láminas delgadas con mayor facilidad de lo esperado. La figura\(\PageIndex{6}\) muestra un esquema de los átomos en una lámina delgada con círculos que representan el tamaño de los átomos (aproximadamente\(10^{-10} \mathrm{~m}\)) y puntos que representan los núcleos. (Los puntos no están a escala, si lo fueran, se necesitaría un microscopio para verlos). La mayoría de las partículas alfa pierden los núcleos pequeños y solo están ligeramente dispersadas por la fuerza de Coulomb de largo alcance. Ocasionalmente, (aproximadamente una vez cada 8000 veces en el experimento de Rutherford), un alfa golpea un núcleo de frente y se dispersa directamente hacia atrás.

Con base en el tamaño y masa del núcleo revelado por su experimento, así como la masa de electrones, Rutherford propuso el modelo planetario del átomo. El modelo planetario del átomo representa electrones de baja masa orbitando un núcleo de gran masa. Los tamaños de las órbitas de electrones son grandes en comparación con el tamaño del núcleo, con la mayoría de vacío dentro del átomo. Esta imagen es análoga a cómo los planetas de baja masa de nuestro sistema solar orbitan el Sol de gran masa a distancias grandes en comparación con el tamaño del sol. En el átomo, la atractiva fuerza de Coulomb es análoga a la gravitación en el sistema planetario. La figura\(\PageIndex{7}\) es una ilustración de este modelo, o una imagen mental.
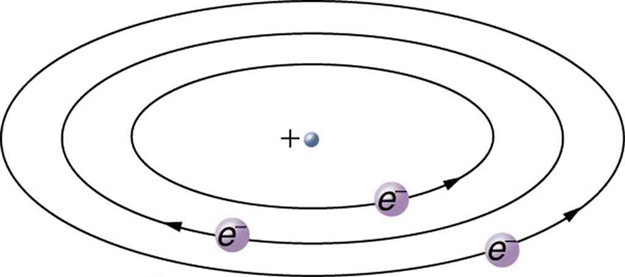
El modelo planetario del átomo de Rutherford fue crucial para comprender las características de los átomos y sus interacciones y energías. También, fue una indicación de cuán diferente es la naturaleza del mundo clásico familiar en la pequeña escala mecánica cuántica. El descubrimiento de una subestructura a toda la materia en forma de átomos y moléculas se estaba dando ahora un paso más allá para revelar una subestructura de átomos que era más simple que los 92 elementos entonces conocidos. Hemos seguido buscando subestructuras más profundas, como las que están dentro del núcleo, con cierto éxito. En un capítulo posterior, seguiremos esta búsqueda en la discusión de quarks y otras partículas elementales, y veremos la dirección en la que ahora parece dirigirse la búsqueda.
Resumen de la Sección
- Los átomos están compuestos por electrones cargados negativamente, primero se demostró que existían en experimentos de tubo de rayos catódicos y un núcleo cargado positivamente.
- Todos los electrones son idénticos y tienen una relación carga-masa de
\[\frac{q_{e}}{m_{e}}=-1.76 \times 10^{11} ~\mathrm{C} / \mathrm{kg}. \nonumber\]
-
La carga positiva en los núcleos es transportada por partículas llamadas protones, que tienen una relación carga-masa de
\[\frac{q_{p}}{m_{p}}=9.57 \times 10^{7} ~\mathrm{C} / \mathrm{kg}. \nonumber\]
- Masa de electrón,
\[m_{e}=9.11 \times 10^{-31} \mathrm{~kg}. \nonumber\]
-
Masa de protón,
\[m_{p}=1.67 \times 10^{-27} \mathrm{~kg}. \nonumber\]
- El modelo planetario del átomo representa electrones orbitando el núcleo de la misma manera que los planetas orbitan sobre el sol.
Glosario
- tubo de rayos catódicos
- un tubo de vacío que contiene una fuente de electrones y una pantalla para ver imágenes
- modelo planetario del átomo
- el modelo o ilustración más familiar de la estructura del átomo


