13.6: Equilbrio de Fase
- Page ID
- 128154
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)objetivos de aprendizaje
- Ilustrar las causas de evaporación cerca de la superficie de un líquido
La evaporación es un tipo de vaporización de un líquido que solo ocurre en la superficie del líquido. Por lo general, las moléculas en un vaso de agua no tienen suficiente energía térmica para escapar del líquido. Sin embargo, con suficiente calor, el líquido se convertiría rápidamente en vapor. Cuando las moléculas chocan, transfieren energía entre sí en diversos grados. A veces la transferencia es tan unilateral para una molécula cerca de la superficie que logra suficiente energía para escapar del líquido.
Tres partes clave para la evaporación son el calor, la presión atmosférica (determina el porcentaje de humedad) y el movimiento del aire. Para que las moléculas de un líquido se evaporen, deben ubicarse cerca de la superficie, moverse en la dirección adecuada y tener suficiente energía cinética para superar las fuerzas intermoleculares en fase líquida. Cuando sólo una pequeña proporción de las moléculas cumple con estos criterios, la tasa de evaporación es baja. Dado que la energía cinética de una molécula es proporcional a su temperatura, la evaporación avanza más rápidamente a temperaturas más altas. A medida que escapan las moléculas que se mueven más rápido, las moléculas restantes tienen menor energía cinética promedio y la temperatura del líquido disminuye. Este fenómeno también se llama enfriamiento evaporativo. Es por ello que el sudor evaporado enfría el cuerpo humano. La evaporación también tiende a proceder más rápidamente con mayores caudales entre las fases gaseosa y líquida y en líquidos con mayor presión de vapor. Por ejemplo, la ropa en un tendedero se secará (por evaporación) más rápidamente en un día ventoso que en un día inmóvil.
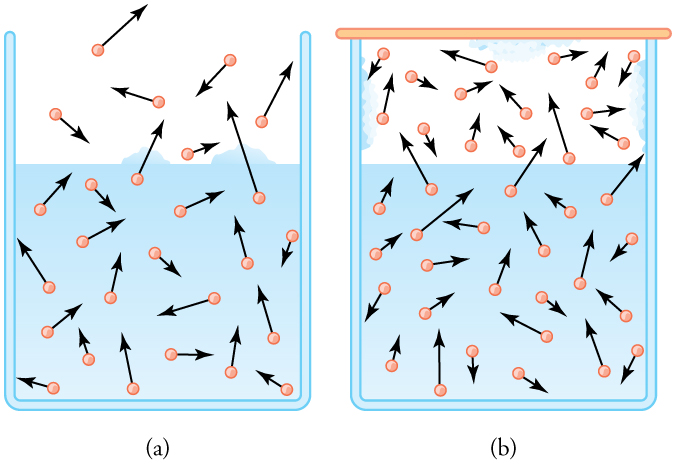
Diagrama de presión de vapor: (a) Debido a la distribución de velocidades y energías cinéticas, algunas moléculas de agua pueden desprenderse a la fase de vapor incluso a temperaturas por debajo del punto de ebullición ordinario. (b) Si el recipiente está sellado, la evaporación continuará hasta que haya suficiente densidad de vapor para que la velocidad de condensación sea igual a la velocidad de evaporación. Esta densidad de vapor y la presión parcial que crea son los valores de saturación. Aumentan con la temperatura y son independientes de la presencia de otros gases, como el aire. Dependen únicamente de la presión de vapor del agua.
La evaporación es una parte esencial del ciclo del agua. El sol (energía solar) impulsa la evaporación del agua de los océanos, lagos, humedad en el suelo y otras fuentes de agua. En hidrología, la evaporación y la transpiración (que implica la evaporación dentro de los estomas de las plantas) se llaman colectivamente evapotranspiración. La evaporación del agua ocurre cuando se expone la superficie del líquido, permitiendo que las moléculas escapen y formen vapor de agua; este vapor puede entonces elevarse y formar nubes.
La Atmósfera Evaporante
En equilibrio, los procesos de evaporación y condensación se equilibran exactamente y no hay cambio neto en el volumen de ninguna de las fases.
objetivos de aprendizaje
- Explicar cómo una sustancia puede tener múltiples fases distintas en un mismo entorno
Equilibrio de fase
Dejadas en equilibrio, muchas composiciones formarán una sola fase uniforme, pero dependiendo de la temperatura y presión incluso una sola sustancia puede separarse en dos o más fases distintas. Dentro de cada fase, las propiedades son uniformes pero entre las dos fases las propiedades difieren.
El agua en una jarra cerrada con un espacio de aire sobre ella forma un sistema bifásico. La mayor parte del agua se encuentra en fase líquida, donde es retenida por la atracción mutua de moléculas de agua. Incluso en equilibrio, las moléculas están constantemente en movimiento y, de vez en cuando, una molécula en fase líquida gana suficiente energía cinética para separarse de la fase líquida y entrar en la fase gaseosa. Asimismo, de vez en cuando una molécula de vapor choca con la superficie del líquido y se condensa en el líquido. En equilibrio, los procesos de evaporación y condensación se equilibran exactamente y no hay cambio neto en el volumen de ninguna de las fases.
A temperatura y presión ambiente, la jarra de agua alcanza el equilibrio cuando el aire sobre el agua tiene una humedad de aproximadamente 3%. Este porcentaje aumenta a medida que sube la temperatura. A 100 °C y presión atmosférica, no se alcanza el equilibrio hasta que el aire es 100% agua. Si el líquido se calienta un poco más de 100 °C, la transición de líquido a gas ocurrirá no solo en la superficie, sino a lo largo del volumen de líquido: el agua hierve.
La atmósfera de la Tierra no es inmutable. El vapor de agua que contiene cambia de fase. Se encuentra en un equilibrio de fase. Las colisiones entre moléculas de agua en la atmósfera permiten que algunas se condensen y otras permanezcan en vapor. De igual manera, varios gases más ligeros pueden escapar del campo gravitacional por completo.

Vapor de agua en la atmósfera: El vapor de agua se condensa en la atmósfera
Puntos Clave
- La evaporación convierte los líquidos en gas.
- La evaporación puede tener lugar a temperaturas por debajo del punto de ebullición ya que las moléculas en el líquido tienen diferentes energías.
- A medida que las moléculas en un líquido chocan, algunas logran mayores energías, lo que les permite escapar. Este proceso disminuye la energía de las moléculas restantes y es la fuente de enfriamiento en los líquidos que se evaporan.
- La atmósfera está hecha de gases en equilibrio de fase.
- A medida que las moléculas en la atmósfera chocan, ganan y pierden energía.
- A medida que el agua se evapora de la superficie de la tierra, el agua se condensa en la atmósfera.
Términos Clave
- Vaporización: una conversión de un sólido o un líquido en un gas
- Evaporación: El proceso de conversión de un líquido al estado gaseoso.
- condensación: La conversión de un gas en líquido; el condensado así formado
- equilibrio: El estado de un cuerpo en reposo o en movimiento uniforme, el resultante de todas las fuerzas sobre las que es cero.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- Evaporación. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Evaporación. Licencia: CC BY-SA: Atribución-CompartirIgual
- Vaporización. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Vaporización. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Colegio de Física. 3 de noviembre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42219/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Atmósfera terrestre. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Earth's_Atmosphere. Licencia: CC BY-SA: Atribución-CompartirIgual
- Fase (materia). Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Phase_ (matter) %23Phase_equilibrium. Licencia: CC BY-SA: Atribución-CompartirIgual
- Evaporación. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Evaporación. Licencia: CC BY-SA: Atribución-CompartirIgual
- condensación. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/condensacion. Licencia: CC BY-SA: Atribución-CompartirIgual
- equilibrio. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/equilibrium. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Colegio de Física. 3 de noviembre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42219/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Vapor de agua. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Water_Vapour%23air_and_water_vapor_density_interactions_at_equal_temperaturas_. Licencia: CC BY: Atribución


