29.5: Ambiente
- Page ID
- 125479
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La atmósfera es una interacción dinámica muy compleja entre muchas especies diferentes de átomos y moléculas. Las composiciones porcentuales promedio de los once gases más abundantes en la atmósfera hasta una altitud de 25 km se muestran en el Cuadro 1.
Cuadro 1: Composición promedio de la atmósfera hasta una altitud de 25 km.
| Nombre del gas | Fórmula química | Volumen porcentual |
| Nitrógeno | \({N}_{2}\) | 78.08% |
| Oxígeno | \({O}_{2}\) | 20.95% |
| *Agua | \({H}_{2}O\) | 0 a 4% |
| Argón | \(Ar\) | 0.93% |
| *Dióxido de Carbono | \({CO}_{2}\) | 0.0360% |
| Neón | \(Ne\) | 0.0018% |
| Helio | \(He\) | 0.0005% |
| *Metano | \(\mathrm{CH}_{4}\) | 0.00017% |
| Hidrógeno | \(H_{2}\) | 0.00005% |
| *Óxido nitroso | \(\mathrm{N}_{2} \mathrm{O}\) | 0.00003% |
| *Ozono | \(O_{3}\) | 0.000004% |
* gases variables
En la atmósfera, el nitrógeno forma una molécula diatómica con masa molar\(M_{\mathrm{N}_{2}}=28.0 \mathrm{g} \cdot \mathrm{mol}^{-1}\) y el oxígeno también forma una molécula diatómica\(O_{2}\) con masa molar\(M_{\mathrm{O}}=32.0 \mathrm{g} \cdot \mathrm{mol}^{-1}\). Dado que estos dos gases se combinan para formar el 99% de la atmósfera, la masa molar promedio de O2 de la atmósfera es\[M_{\mathrm{atm}} \simeq(0.78)\left(28.0 \mathrm{g} \cdot \mathrm{mol}^{-1}\right)+(0.21)\left(32.0 \mathrm{g} \cdot \mathrm{mol}^{-1}\right)=28.6 \mathrm{g} \cdot \mathrm{mol}^{-1} \nonumber \]
La densidad\(\rho\) de la atmósfera en función de la masa molar\(M_{\mathrm{atm}}\), el volumen V y el número atm de moles\(n_{m}\) contenidos en el volumen viene dada por\[\rho=\frac{M^{\text {total }}}{V}=\frac{n_{\mathrm{m}} M_{\text {molar }}}{V} \nonumber \] ¿Cómo varía la presión de la atmósfera en función de la altura sobre la superficie de la tierra? En la Figura 29.4, se traza la altura sobre el nivel del mar en kilómetros frente a la presión. (También trazada en la gráfica en función de la altura se encuentra la densidad en kilogramos por metro cúbico.)

Atmósfera Isotérmica de Gas Ideal
Modelemos la atmósfera como un gas ideal en equilibrio estático a temperatura constante\(T=250 \mathrm{K}\). La presión en la superficie de la tierra es\(P_{0}=1.02 \times 10^{5} \mathrm{Pa}\). La presión de un gas ideal, utilizando la ecuación de estado de gas ideal (Ecuación (29.4.23)) se puede expresar en términos de la presión P, la constante de gas universal R, masa molar de la atmósfera\(M_{\mathrm{atm}}\) y la temperatura T,\[P=n_{\mathrm{m}} R \frac{T}{V}=\frac{M^{\text {total }}}{V} \frac{R T}{M_{\text {atm }}}=\rho \frac{R T}{M_{\text {atm }}} \nonumber \] Así la ecuación de estado para la densidad del gas se puede expresar como \[\rho=\frac{M_{\text {atm }}}{R T} P \nonumber \]Utilizamos la Segunda Ley de Newton para determinar la condición sobre las fuerzas que están actuando sobre un pequeño volumen cilíndrico de la atmósfera (Figura 29.5a) en equilibrio estático del área de sección transversal A ubicada entre las alturas\(z\) y\(z+\Delta z\)

La masa contenida en este elemento es producto de la densidad\(\rho\) y el elemento de volumen\(\Delta V=A \Delta z\),\[\Delta m=\rho \Delta V=\rho A \Delta z \nonumber \]
La fuerza debida a la presión en la parte superior del cilindro se dirige hacia abajo y es igual a\(\overrightarrow{\mathbf{F}}(z+\Delta z)=-P(z+\Delta z) A \hat{\mathbf{k}}\) (Figura 29.5 (b)) donde\(\hat{\mathbf{k}}\) se dirige el vector unitario hacia arriba. La fuerza debida a la presión en la parte inferior del cilindro se dirige hacia arriba y es igual a\(\overrightarrow{\mathbf{F}}(z)=P(z) A \hat{\mathbf{k}}\). La presión en la parte superior\(P(z+\Delta z)\) e inferior\(P(z)\) de este elemento no son iguales sino que difieren en una cantidad\(\Delta P=P(z+\Delta z)-P(z)\). El diagrama de fuerza para este elemento se muestra en la Figura 29.5b.
Debido a que la atmósfera está en equilibrio estático en nuestro modelo, la suma de las fuerzas sobre el elemento de volumen son cero,\[\overrightarrow{\mathbf{F}}^{\text {total }}=\Delta m \overrightarrow{\mathbf{a}}=\overrightarrow{\mathbf{0}} \nonumber \] Así la condición para el equilibrio estático de las fuerzas en la dirección z es\[-P(z+\Delta z) A+P(z) A-\Delta m g=0 \nonumber \] El cambio es la presión se da entonces por\[\Delta P A=-\Delta m g \nonumber \] Usando la Ecuación (29.5.5) para la masa Δm, sustituto en Ecuación (29.5.8), rindiendo\[\Delta P A=-\rho A \Delta z g=-\frac{M_{\mathrm{atm}} g}{R T} A \Delta z P \nonumber \] La derivada de la presión en función de la altura es entonces linealmente proporcional a la presión,\[\frac{d P}{d z}=\lim _{\Delta z \rightarrow 0} \frac{\Delta P}{\Delta z}=-\frac{M_{\text {atm }} g}{R T} P \nonumber \] Esta es una ecuación diferencial separable; separando las variables,\[\frac{d P}{P}=-\frac{M_{\text {atm }} g}{R T} d z \nonumber \] Integrar Ecuación (29.5.11) para rendir\[\int_{P_{0}}^{P(z)} \frac{d P}{P}=\ln \left(\frac{P(z)}{P_{0}}\right)=-\int_{0}^{z} \frac{M_{\text {atm }} g}{R T} d z=-\frac{M_{\text {atm }} g}{R T} z \nonumber \] Exponentiate ambos lados de la Ecuación (29.5.12) para encontrar la presión P (z) en la atmósfera en función de la altura z sobre la superficie de la tierra,\[P(z)=P_{0} \exp \left(-\frac{M_{\mathrm{atm}} g}{R T} z\right) \nonumber \]
Ejemplo 29.2 Presión atmosférica de gas ideal
¿Cuál es la relación entre la presión atmosférica a z = 9.0 km y la presión atmosférica en la superficie de la tierra para nuestra atmósfera de gas ideal?
Solución\[\frac{P(9.0 \mathrm{km})}{P_{0}}=\exp \left(-\frac{\left(28.6 \times 10^{-3} \mathrm{kg} \cdot \mathrm{mol}^{-1}\right)\left(9.8 \mathrm{m} \cdot \mathrm{s}^{-2}\right)}{\left(8.31 \mathrm{J} \cdot \mathrm{K}^{-1} \cdot \mathrm{mol}^{-1}\right)(250 \mathrm{K})}\left(9.0 \times 10^{3} \mathrm{m}\right)\right) = 30 \nonumber \]
Atmósfera de la Tierra
Hicimos dos suposiciones sobre la atmósfera, que la temperatura era uniforme y que las diferentes moléculas de gas estaban uniformemente mezcladas. La temperatura real varía según la región específica de la atmósfera. En la Figura 29.6 se muestra una gráfica de la temperatura en función de la altura.

En la troposfera, la temperatura disminuye con la altitud; la tierra es la principal fuente de calor en la que hay absorción de radiación infrarroja (IR) por gases traza y nubes, y hay convección y conducción de energía térmica. En la estratosfera, la temperatura aumenta con la altitud debido a la absorción de la radiación ultravioleta (UV) del sol por el ozono. En la mesosfera, la temperatura disminuye con la altitud. La atmósfera y la tierra por debajo de la mesosfera son la principal fuente de IR que es absorbida por el ozono. En la termosfera, el sol calienta la termosfera por la absorción de rayos X y UV por el oxígeno. Las temperaturas oscilan entre 500 K y 2000 K dependiendo de la actividad solar.
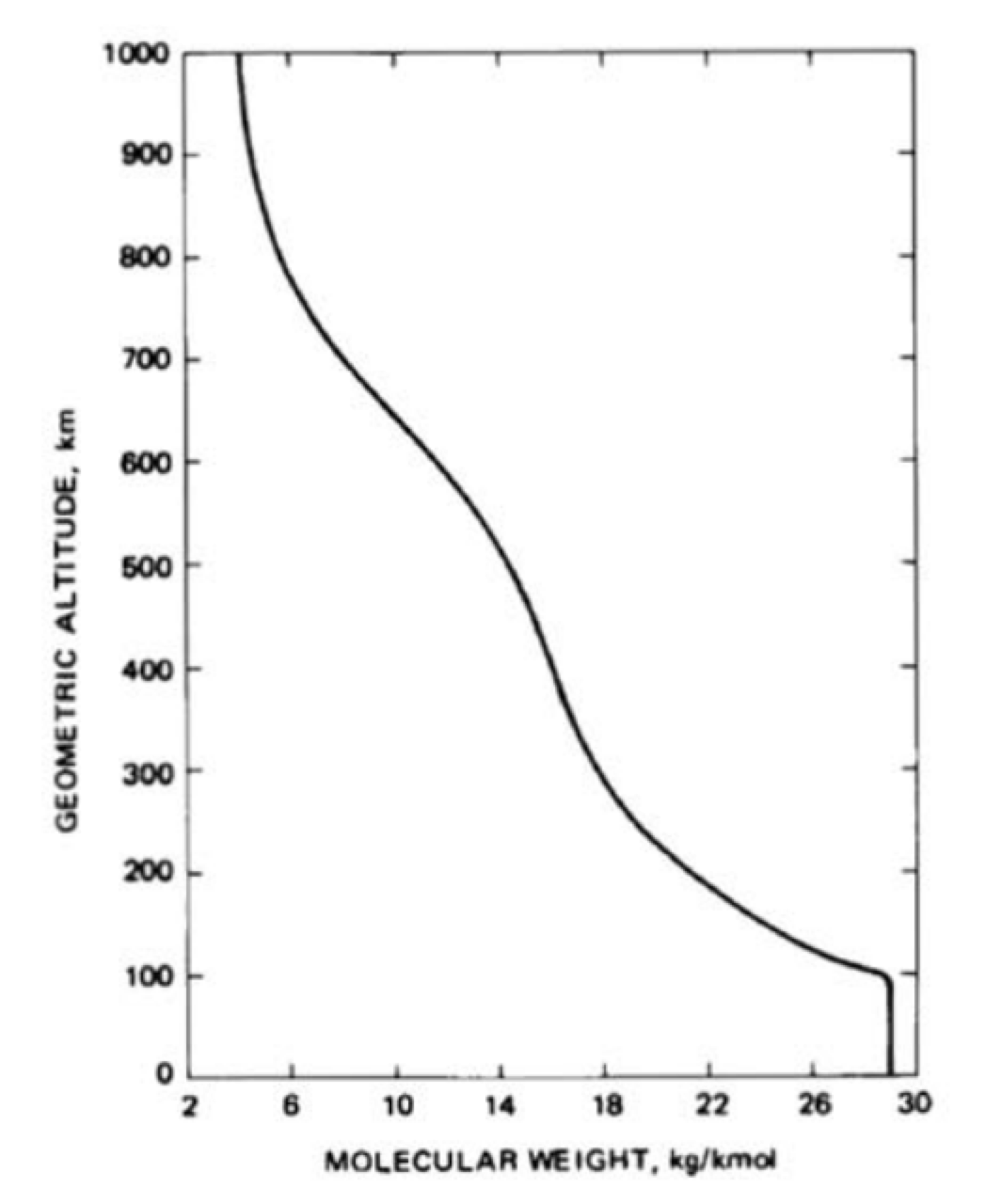
La atmósfera inferior está dominada por la mezcla turbulenta que es independiente de la masa molecular. Cerca de 100 km, se producen tanto la difusión como la mezcla turbulenta. La composición de la atmósfera superior se debe a la difusión. La relación de mezcla de gases cambia y la masa molar media disminuye en función de la altura. Solo los gases más ligeros están presentes en niveles más altos. Los componentes variables como el vapor de agua y el ozono también afectarán la absorción de la radiación solar y la radiación IR de la tierra. La gráfica de altura vs peso molecular medio se muestra en la Figura 29.7. La densidad numérica de especies individuales y la densidad numérica total se representan en la Figura 29.8.

(Obsérvese que en la etiqueta y leyenda del eje anterior para la Figura 29.8, se usa el término “peso molecular” en lugar de la “masa molecular” o “masa molar” más apropiada).


