1.5: Química del Suelo
- Page ID
- 89510
Darshani Kumaragamage, Jim Warren y Graeme Spiers
Objetivos de aprendizaje
Al término de este capítulo, los alumnos podrán:
- Definir y describir la importancia de las principales propiedades químicas del suelo en el sustento de la vida en la Tierra
- Describir y comparar las estructuras, el desarrollo de cargas y las propiedades de coloides orgánicos e inorgánicos del suelo
- Explicar la influencia de los minerales del suelo en las propiedades del suelo
- Definir la capacidad de intercambio catiónico, explicar la importancia del intercambio catiónico y la adsorción aniónica e identificar los factores que influyen en el intercambio iónico en los suelos
- Discutir las causas de acidez y alcalinidad del suelo, características de suelos fuertemente ácidos y alcalinos, y su efecto sobre el crecimiento de las plantas
- Describir las causas de la salinidad del suelo, las principales características de los suelos salinos, salino-sódicos y sódicos y la recuperación de suelos afectados por la sal
- Describir la importancia de las reacciones redox en la dinámica nutrimental y en las emisiones de gases
- Explicar los principios básicos en la medición de la capacidad de intercambio catiónico, pH, conductividad eléctrica y potencial redox en suelos, y la interpretación de sus valores
INTRODUCCIÓN
La química del suelo es una rama de la ciencia del suelo que se ocupa de la composición química, las reacciones químicas y las propiedades químicas en los suelos. Las fases abióticas del suelo incluyen sólidos (materia orgánica y minerales inorgánicos), líquidos (agua del suelo) y gases (aire del suelo), mientras que la fase biótica consiste en organismos vivos. El suelo, por lo tanto, es un sistema vivo dinámico en el que los iones y las moléculas pueden moverse constantemente de una fase a la otra, mientras interactúan entre sí.
Las propiedades químicas del suelo se basan en las concentraciones y/o proporciones de especies disueltas en el agua del suelo y/o en el complejo de intercambio iónico. Las propiedades químicas del suelo como la capacidad de intercambio catiónico (CEC), el pH, el potencial redox (Eh o pe) y la conductividad eléctrica (CE) son importantes ya que influyen en la disponibilidad de nutrientes, el crecimiento de las plantas, el destino de los contaminantes, la actividad biológica, etc. medida de la cantidad de carga negativa capaz de adsorber cationes sobre superficies minerales u orgánicas, generalmente expresada en centimoles de carga [cmol (+)] por kg de suelo. El pH del suelo es una medida de la concentración de H + en la solución del suelo, mientras que el Eh (o pe) se relaciona con concentraciones de especies oxidadas/reducidas de elementos sensibles a la redox como el hierro (Fe 3+ /Fe 2+). La conductividad eléctrica (EC) es otra propiedad importante del suelo que proporciona una indicación de la abundancia de sales solubles en un suelo.
La mayoría de las propiedades químicas importantes de los suelos están controladas por reacciones que ocurren entre la solución del suelo y las superficies de partículas coloidales (partículas <0.002 mm de diámetro; Brady y Weil, 2010) partículas minerales del suelo y materia orgánica del suelo. En la primera parte de este capítulo nos centraremos en la química de la solución del suelo y la fracción coloidal. Las secciones restantes del capítulo se centrarán en importantes propiedades químicas del suelo; a saber, CEC, intercambio de aniones, pH del suelo, EC y Eh, con énfasis en su importancia para sostener la vida en la Tierra.
Solución de SUELO
El agua del suelo, incluidos los solutos disueltos, se conoce como la solución del suelo y es el alma del suelo. Todas las reacciones químicas, reacciones de precipitación/disolución mineral, reacciones de intercambio iónico, reacciones redox y absorción de nutrientes por las plantas ocurren en, o están mediadas por la solución del suelo. Sin el agua del suelo, muy pocas reacciones químicas o biológicas se producirían en el suelo; de hecho, no habría vida en este planeta.
La solución del suelo es muy compleja y contiene una gran variedad de cationes y aniones (tanto como iones libres e iones complejos) así como moléculas orgánicas disueltas, generalmente en bajas concentraciones. Para que los nutrientes del suelo sean absorbidos por las raíces de las plantas, deben existir en forma disuelta en la solución del suelo. Se requieren al menos 17 elementos para apoyar el crecimiento de la mayoría de las plantas (ver Capítulo 7), con cuatro elementos adicionales esenciales para el crecimiento de algunas plantas (Havlin et al., 2013). Por ejemplo, algunos cationes y aniones importantes que las plantas absorben de la solución del suelo son: nitrógeno como amonio (NH 4 +) y nitrato (NO 3 —), fósforo como varias especies de fosfato (por ejemplo, HPO 4 2- y H 2 PO 4 —), potasio (K +), calcio (Ca 2+), magnesio (Mg 2+) y azufre como sulfato (SO 4 2-). Todos los nutrientes son absorbidos de la solución del suelo por las raíces de las plantas.
La solución del suelo también contiene otros iones y moléculas no nutritivas, algunas de las cuales son inocuas, mientras que otras son tóxicas, dependiendo de la concentración. Estos incluyen algunos oligoelementos (por ejemplo, plomo, arsénico), pesticidas (por ejemplo, clorpirifos, glifosato), iones y compuestos antimicrobianos (por ejemplo, desinfectantes, antibióticos) y moléculas orgánicas complejas. Estos también pueden ser absorbidos por las raíces de las plantas. Los nutrientes y otros productos químicos en la solución del suelo también pueden perderse del suelo a través de la escorrentía superficial y/o la lixiviación descendente, particularmente bajo eventos de lluvia excesiva y riego.
COLOIDES DEL SUELO
La fracción coloidal del suelo se define como aquella fracción del suelo compuesta colectivamente por pequeñas partículas inorgánicas y orgánicas (<0.002 mm) (Brady y Weil, 2010). La alta superficie específica y la presencia de cargas eléctricas en la mayoría de las partículas son responsables de características importantes del suelo como la capacidad de hinchamiento, la capacidad del suelo para retener agua, la adsorción de cationes y aniones y el intercambio iónico.
La importancia de los coloides en el suelo se relaciona con la relación de su tamaño con la cantidad de superficie disponible para reaccionar con la solución del suelo. El Cuadro 5.1 muestra la relación entre el tamaño de partícula y la magnitud de la superficie asociada con el rango de tamaño de partícula para un suelo franco arcilloso. El área superficial específica se define como el área superficial por unidad de masa de la partícula sólida y se expresa como m 2 g -1 de suelo. Como puede verse en el Cuadro 5.1, aunque este suelo contiene proporciones iguales de arena, limo y arcilla por masa, con mucho la mayor parte de la superficie se asocia con la fracción de menor tamaño.
Cuadro 5.1. Relación entre el rango de tamaño de partícula y la superficie específica de las partículas del suelo.
| Fracción de tamaño de partícula | Rango de tallas | Diámetro mediano | Porcentaje de Suelo Margoso Arcilloso a |
Superficie Específica b |
Superficie porcentual |
|---|---|---|---|---|---|
| (µm) | (µm) | (%) | (cm 2 g -1) | (%) | |
| Arena | 2000-50 | 1000 | 33.3 | 22.6 | 0.2 |
| Limo | 50-2 | 25 | 33.3 | 90.9 | 0.8 |
| Arcilla | <2 | 1 | 33.3 | 11,320 | 99 |
| a Supuso un suelo franco arcilloso con proporciones iguales de arena, limo y arcilla. b Calculado en base a partículas esféricas uniformes con diámetro medio de partícula. | |||||
Las fases minerales en la fracción coloidal o de tamaño arcilloso son principalmente minerales de filosilicato y oxi-hidróxido (Figura 5.1). Los coloides orgánicos también están en el rango de tamaño de arcilla y están compuestos por pequeñas partículas de humus que son relativamente estables y resistentes a una mayor descomposición biológica. Estas diversas partículas coloidales pueden existir independientemente en el ambiente del suelo o pueden ocurrir en asociación en complejos órgano-minerales (Newman y Hayes, 1990).
Filosilicatos
Es importante entender que existen diferencias entre los minerales arcillosos de aluminosilicato (también llamados filosilicatos o silicatos de capa) que conforman la gran mayoría de los coloides minerales y que estos imparten diferencias sustanciales en las propiedades importantes del suelo, como el intercambio iónico.
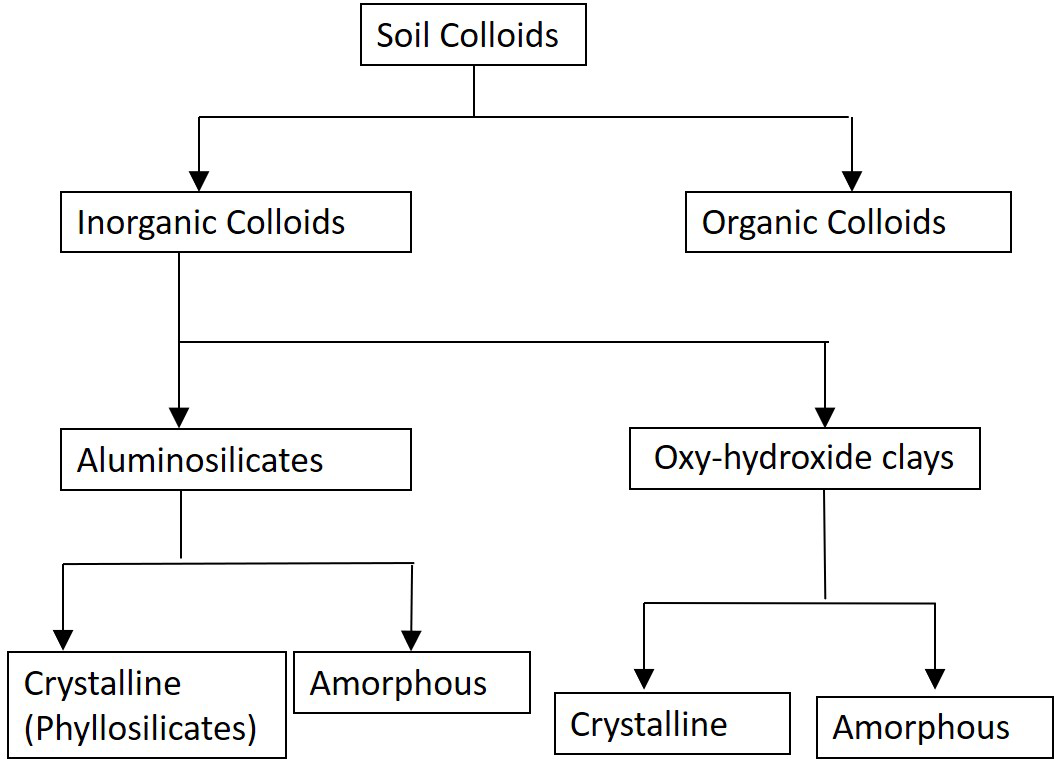
Los filosilicatos (filón significa hoja u hoja en griego) son minerales cristalinos, con una estructura que consiste en capas de unidades atómicas repetitivas. Existen dos unidades fundamentales compuestas por capas de oxígeno y grupos hidroxilo unidos con silicio, aluminio, magnesio y otros cationes. Las capas fundamentales están compuestas por láminas tetraédricas y octaédricas que se presentan en diferentes combinaciones para formar los diferentes minerales arcillosos.
Las láminas tetraédricas están compuestas por unidades repetitivas de tetraedro, conteniendo cada una típicamente un átomo de silicio rodeado por cuatro átomos de oxígeno: un átomo de oxígeno apical y tres átomos de oxígeno basales formando una configuración de cuatro lados (tetraédrica) (Figura 5.2A). Las láminas tetraédricas que se extienden en dos dimensiones se forman compartiendo los átomos de oxígeno basales entre los átomos de silicio (Figura 5.2B).
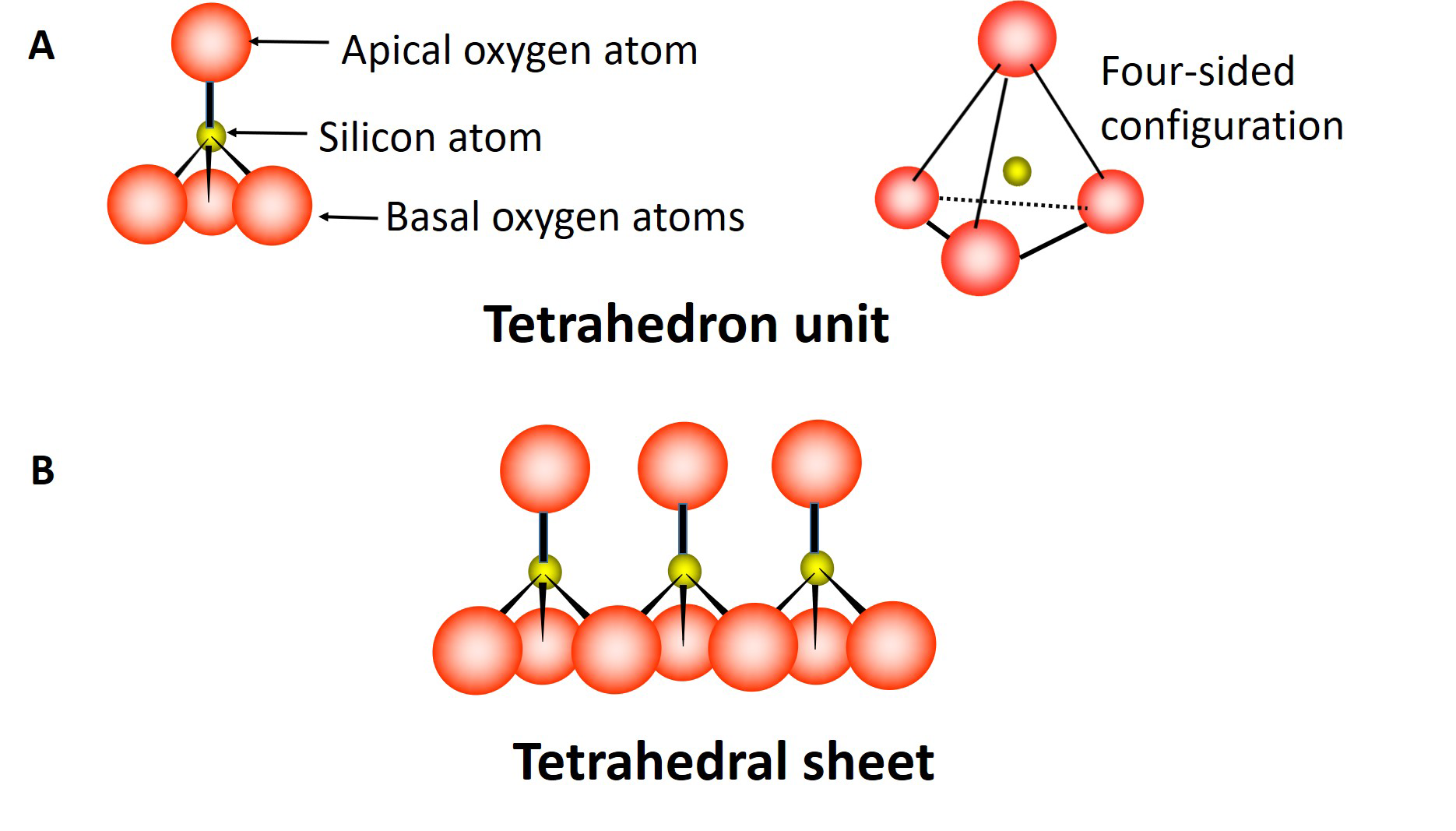
La lámina octaédrica está compuesta por múltiples unidades octaedros (Figura 5.3A), cada unidad contiene átomos de aluminio (o magnesio) rodeados por seis átomos de oxígeno y/o grupos hidroxilo. Tres átomos de oxígeno (o grupos hidroxilo) ocurren en el plano inferior, los tres átomos de oxígeno restantes (o grupos hidroxilo) ocurren en el plano superior con los átomos de aluminio o magnesio intercalados entre ellos, formando una configuración de ocho lados (octaédrica). Estas unidades se combinan compartiendo átomos de oxígeno para formar una lámina octaédrica que se extiende en dos dimensiones (Figura 5.3B).
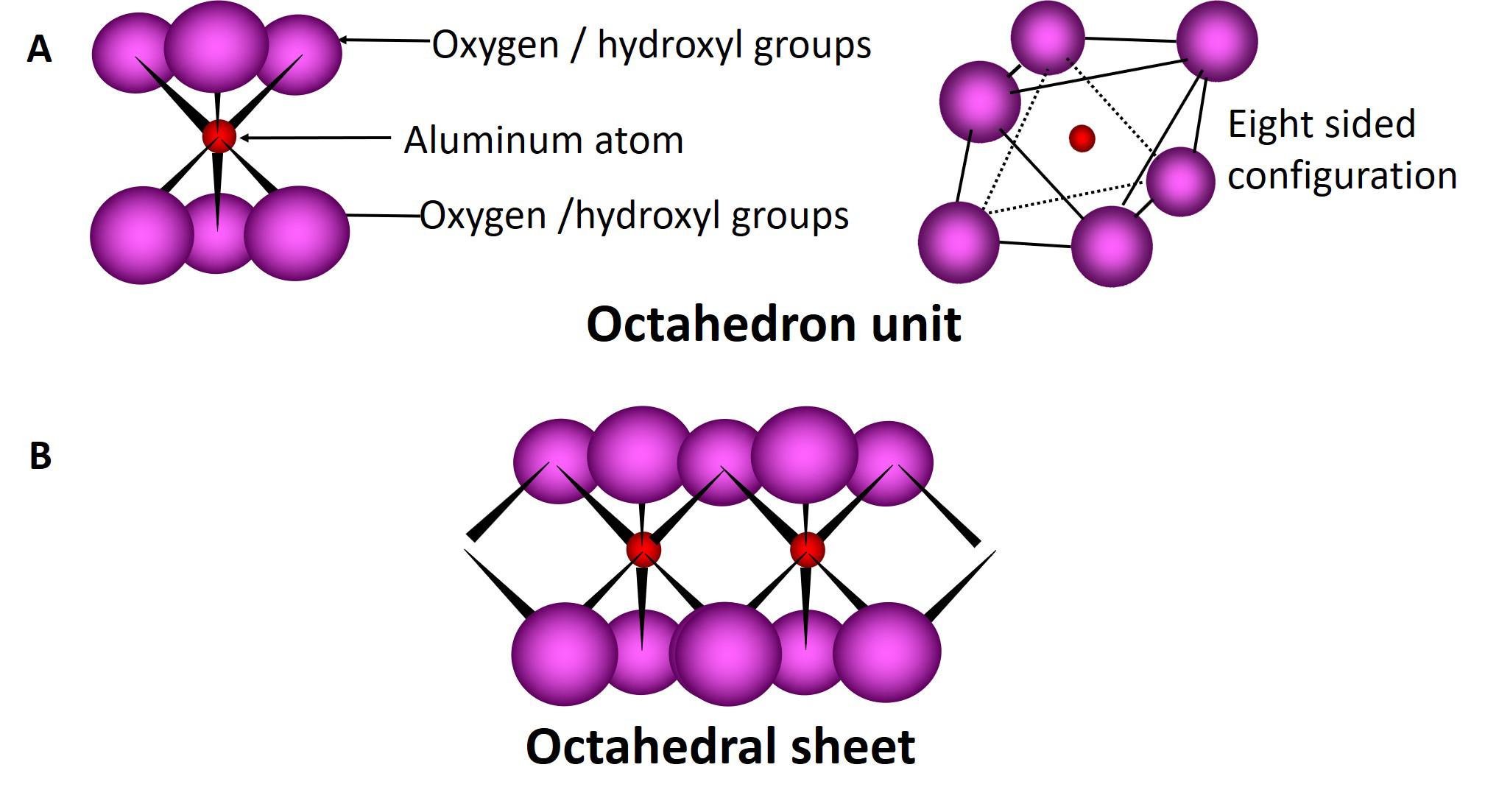
Las láminas tetraédricas y octaédricas se combinan para formar capas unitarias de diferentes filosilicatos a través del intercambio del átomo de oxígeno apical de la lámina tetraédrica con los átomos de oxígeno en la lámina octaédrica. Los filosilicatos compuestos por una lámina tetraédrica y una lámina octaédrica se denominan filosilicatos de tipo 1:1; los compuestos por una lámina octaédrica intercalada entre dos láminas tetraédricas se denominan filosilicatos de tipo 2:1 (Figura 5.4). La fórmula de celda unitaria ideal para un mineral de arcilla 1:1 es Si 4 Al 4 O 10 (OH) 8, mientras que la de un mineral de arcilla 2:1 es Si 8 Al 4 O 20 (OH) 4.
Los filosilicatos constan de muchas capas (tipo 1:1 o tipo 2:1) apiladas una encima de la otra con diferentes formas de unión entre las capas. La región ubicada entre dos capas adyacentes se denomina región de capa intermedia. El comportamiento químico básico y las propiedades físicas de los diferentes filosilicatos están dictados en gran parte por las características asociadas a la región intercapa de las arcillas.
Sustitución isomorfa
Además de su gran superficie (ver Cuadro 5.1), los filosilicatos también se cargan eléctricamente debido a la sustitución de los cationes centrales dentro de las láminas tetraédricas u octaédricas por otros iones de tamaño similar (ver Tabla 5.2) pero diferente valencia. Esto imparte una carga neta negativa a la estructura del mineral.
La sustitución isomorfa se define como “la sustitución de un átomo por otro de tamaño similar en una estructura cristalina sin alterar o cambiar la estructura cristalina del mineral” (Canada Department of Agriculture, 1976). Cuando un catión sustitutivo es de menor valencia que el catión que está reemplazando, hay un exceso de cargas negativas asociadas con los átomos de oxígeno que lo rodean y por lo tanto se imparte una carga negativa neta a la estructura. Por ejemplo, el aluminio trivalente (Al 3+) puede sustituir parte del silicio tetravalente (Si 4+) en la lámina tetraédrica. La menor carga del aluminio en comparación con el silicio crea un déficit de carga y una carga negativa dentro de la lámina tetraédrica de la estructura. De igual manera, en la lámina octaédrica, Mg 2+, Fe 2+, u otros cationes divalentes, pueden sustituir a algún Al trivalente (Al 3+), resultando en una carga extra negativa asociada con la lámina octaédrica de la estructura. Estas cargas negativas atraen cationes cargados positivamente a la superficie de los minerales para neutralizar la carga negativa. Estos cationes neutralizantes de carga se localizan principalmente dentro de la región intercapa de los filosilicatos. La abundancia de sitios de carga negativa (es decir, la densidad de carga), la ubicación de las cargas negativas (lámina tetraédrica vs. octaédrica), y el tipo de catión en la región intercapa neutralizando la carga (por ejemplo, Na +, Ca 2+, Mg 2+, K + u otro) determina el grado en que los filosilicatos se expanden o hinchan, y su capacidad para retener cationes.
Cuadro 5.2. Radio de cationes comunes y ubicación en estructuras de filosilicato
| Catión | Radio (nm) | Ubicación |
|---|---|---|
| Si 4+ | 0.041 | tetraedros |
| Al 3+ | 0.05 | tetraedros, octaedros, capa intermedia |
| Fe 3+ | 0.064 | octaedros |
| Fe 2+ | 0.076 | octaedros, capa intermedia |
| Mg 2+ | 0.065 | octaedros, capa intermedia |
| Ca 2+ | 0.099 | Interlayer |
| Na + | 0.095 | Interlayer |
| K + | 0.133 | Interlayer |
Minerales de filosilicato
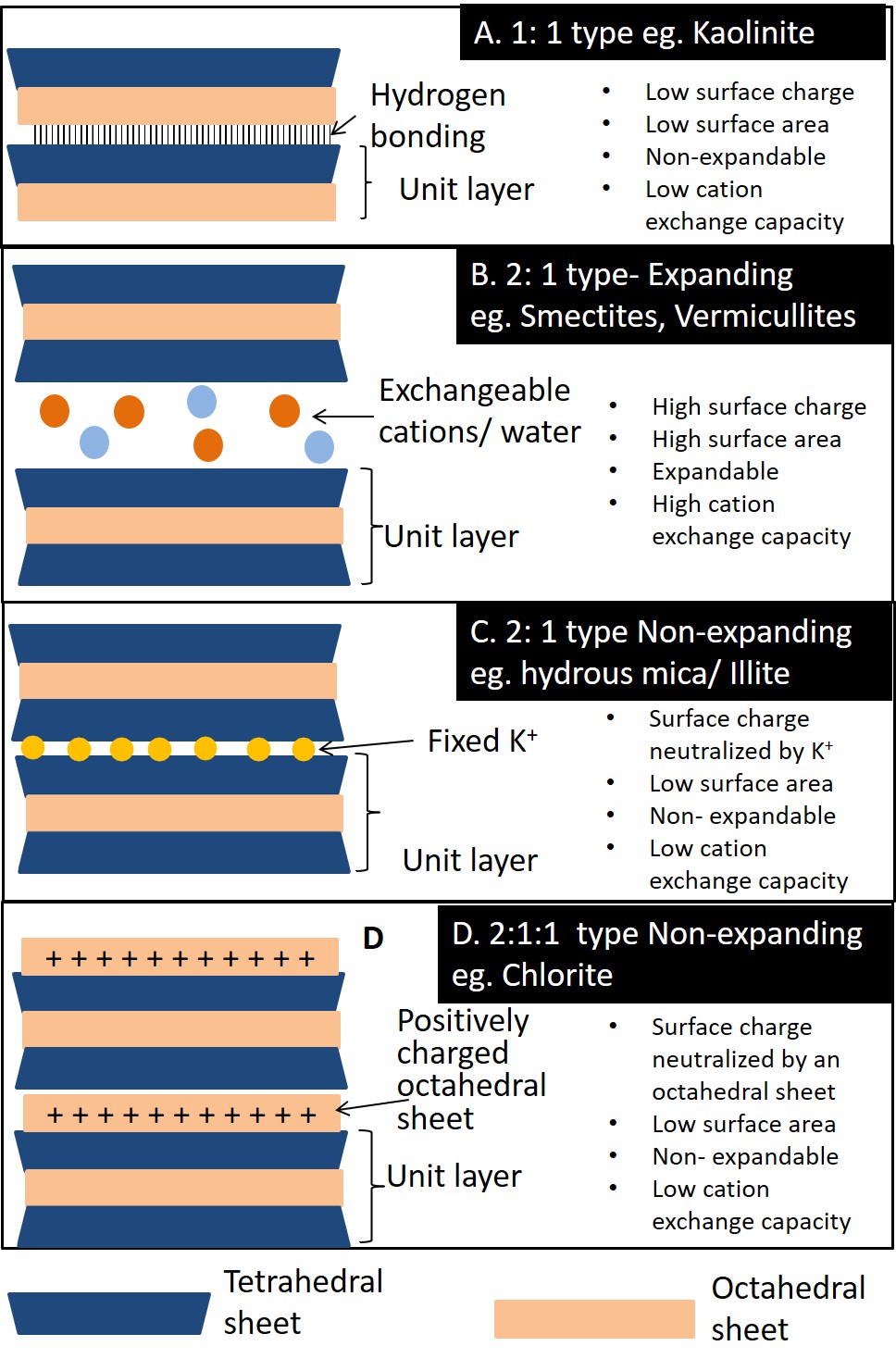
Hay alrededor de 50 especies de minerales de filosilicato, pero sólo cinco son comunes en suelos canadienses (ver Capítulo 14). Estos se esbozan en la Figura 5.5 y se describen de la siguiente manera:
La caolinita (Figura 5.5A) es un mineral arcilloso de tipo 1:1 mantenido unido por enlaces de hidrógeno en la región de la capa intermedia. El enlace de hidrógeno ocurre entre el hidroxilo en la lámina octaédrica de una capa unitaria, y los oxígenos (basales) en la lámina tetraédrica de la capa adyacente. Los enlaces de hidrógeno mantienen las capas estrechamente juntas para formar una estructura muy estable. Esto combinado con muy poca sustitución isomorfa inhibe la intrusión de cationes y agua en la región de la capa intermedia. Este mineral no es expandible ya que las moléculas de agua no pueden ingresar al espacio intercapa. La caolinita exhibe muy poca hinchazón cuando está húmeda, o contracción cuando está seca. La capa intermedia no está expuesta y por lo tanto la superficie específica es baja. Casi sin sustitución isomórfica, los minerales de caolinita tienen una carga superficial baja y una baja capacidad de intercambio catiónico.
¡Puedes Cavar!
Las rocas que son ricas en caolinita se conocen como caolín que se deriva de la palabra china “Gaoling” (que significa literalmente 'High Ridge'), que es el nombre de un pueblo en el sureste de China donde la caolinita fue extraída históricamente. La caolinita en su forma pura es blanca y su característica mínima de encogimiento/hinchamiento y su capacidad de no agrietarse cuando se seca la hicieron muy apreciada para hacer porcelana y vajilla de “China fina”.
La esmectita (Figura 5.5B) es un grupo de filosilicatos expandibles de tipo 2:1. La montmorillonita y la beidellita son las dos especies más comunes del grupo de minerales esmectita en suelos canadienses. La cantidad de sustitución isomorfa en ambos minerales es moderada en comparación con otros filosilicatos de tipo 2:1 (por ejemplo, mica hidratada), y las dos especies se diferencian en función de la ubicación de la carga de capa en la estructura. La mayor parte de la carga de capa en montmorillonita es resultado de la sustitución isomorfa en la lámina octaédrica, mientras que en la beidelita la carga de capa deriva principalmente de la sustitución isomorfa en la lámina tetraédrica. Los enlaces de hidrógeno no ocurren en minerales arcillosos 2:1 ya que no hay grupos hidroxilo asociados con los oxígenos basales de las láminas tetraédricas de capas adyacentes enfrentadas entre sí. Así, las capas estructurales solo se mantienen unidas por fuerzas electrostáticas de cualquier catión neutralizante que se encuentre en la región intercapa para neutralizar las cargas negativas asociadas con la subestación isomorfa dentro de las estructuras de capas. Los cationes intercambiables en la capa intermedia suelen estar rodeados por seis moléculas de agua en coordinación octaédrica. Los minerales de esmectita tienen una alta capacidad de intercambio catiónico. Dado que las capas están unidas libremente, tanto las moléculas de agua como los cationes pueden entrar libremente en el espacio entre capas. Por lo tanto, estas arcillas tienen un área específica alta, y son expandibles; hinchándose cuando están mojadas y encogiendo cuando están secas.
La vermicullita (Figura 5.5B) es un filosilicato tipo 2:1 similar a la esmectita pero con una carga de capa intermedia entre mica/illita hidratada (ver más abajo) y las esmectitas. El mineral tiene una capacidad de expansión limitada, con características moderadas de encogimiento/oleaje. La mayor parte de la sustitución isomorfa ocurre en la lámina tetraédrica impartiendo una alta carga superficial y una alta capacidad de intercambio catiónico. La estructura es capaz de capturar iones K + en la región intercapa similar a la mica/ilita hidratada, pero como la carga de capa es ligeramente menor, el K + atrapado puede ser liberado de nuevo en la solución del suelo a diferencia de mica/ilita hidratada.
La mica hidratada también llamada ilita (Figura 5.5C) es otro mineral arcilloso tipo 2:1, la mica hidratada se deriva de la meteorización parcial de la mica, un mineral primario común en las rocas graníticas del Escudo Canadiense. La estructura de la mica/ilita hidratada es similar a las esmectitas y vermicullita, excepto que la carga de capa es mayor con la sustitución isomorfa que ocurre casi exclusivamente en la lámina tetraédrica donde Al 3+ se sustituye por Si 4+. El potasio ocupa casi exclusivamente la región de la capa intermedia, neutralizando la carga de la capa y manteniendo unida la estructura. El ion potasio (K +) es casi un ajuste exacto para los agujeros de forma hexagonal que ocurren en las láminas tetraédricas de las capas 2:1, y así se acerca aún más a los sitios cargados y une fuertemente las capas adyacentes entre sí. Esto evita la entrada de agua en la región de capa intermedia y hace que los minerales del grupo de la mica no sean expandibles. Entonces, aunque la carga de capa es mayor que las esmectitas y vermiculita, la capacidad de intercambio catiónico de mica/ilita hidratada es baja, ya que la carga es neutralizada por K +.
El clorito (Figura 5.5D) es un filosilicato de tipo 2:1:1 (o 2:2). El mineral tiene una estructura tipo 2:1, pero con una lámina octaédrica adicional, compuesta por una capa de hidróxido de aluminio, magnesio o hierro en coordinación de seis veces (octaédrica), en la región intercalada entre las capas de tipo 2:1. Esta capa hidroxílica intercalada no comparte oxígenos con la capa principal 2:1, sino que está unida por hidrógeno a la capa 2:1; en consecuencia, el mineral es no expandible. La cantidad de sustitución isomorfa en la estructura es variable, pero las cargas son neutralizadas por la lámina octaédrica cargada positivamente en la capa intermedia, por lo que la capacidad de intercambio iónico es baja.
Los aluminosilicatos amorfos son otros aluminosilicatos que se encuentran en el suelo pero estos no son filosilicatos. Estos se describen como amorfos o como minerales de orden de corto alcance, lo que significa que carecen de las unidades estructurales definidas de los filosilicatos. El alofano y la imogolita son ejemplos de minerales de aluminosilicato amorfo. Estos minerales se forman en abundancia en suelos de ceniza volcánica que se encuentran en países como Japón y Nueva Zelanda, pero también se encuentran en cantidades muy pequeñas en algunos suelos podzólicos y solonetzicos en Canadá. Los aluminosilicatos amorfos no son expandibles. Son extremadamente pequeños (<4 nm de diámetro) con una superficie específica muy alta y una capacidad de intercambio iónico muy alta.
Minerales oxi-hidróxido
Los minerales oxi-hidróxido (sesquióxidos) son principalmente óxidos, hidróxidos y óxidos hidratados de hierro, aluminio y manganeso, y se encuentran entre las fases minerales más jóvenes que se encuentran en el suelo. Algunos están bien cristalizados (por ejemplo, gibbsita, hematita, goetita), mientras que otros son amorfos (por ejemplo, ferrihidrita). Las arcillas de óxido cristalino están compuestas de oxígeno y/o grupos hidroxilo, generalmente en una disposición octaédrica con hierro, aluminio o manganeso. Las estructuras octaédricas de estos minerales se mantienen unidas por unión H. Los oxihidróxidos no cristalinos (amorfos) son minerales complejos de hierro, aluminio y manganeso que normalmente precipitan muy rápidamente de la solución del suelo en respuesta a ciclos de humectación y secado. La precipitación de estos minerales ocurre cuando se excede el producto de solubilidad para una combinación de concentraciones de cationes y aniones, y generalmente otros solutos incluyendo carbonato, fosfato y sulfato pueden quedar atrapados en la estructura durante la precipitación rápida. Los oxihidróxidos amorfos son metaestables y se convierten lentamente a sus formas más cristalinas.
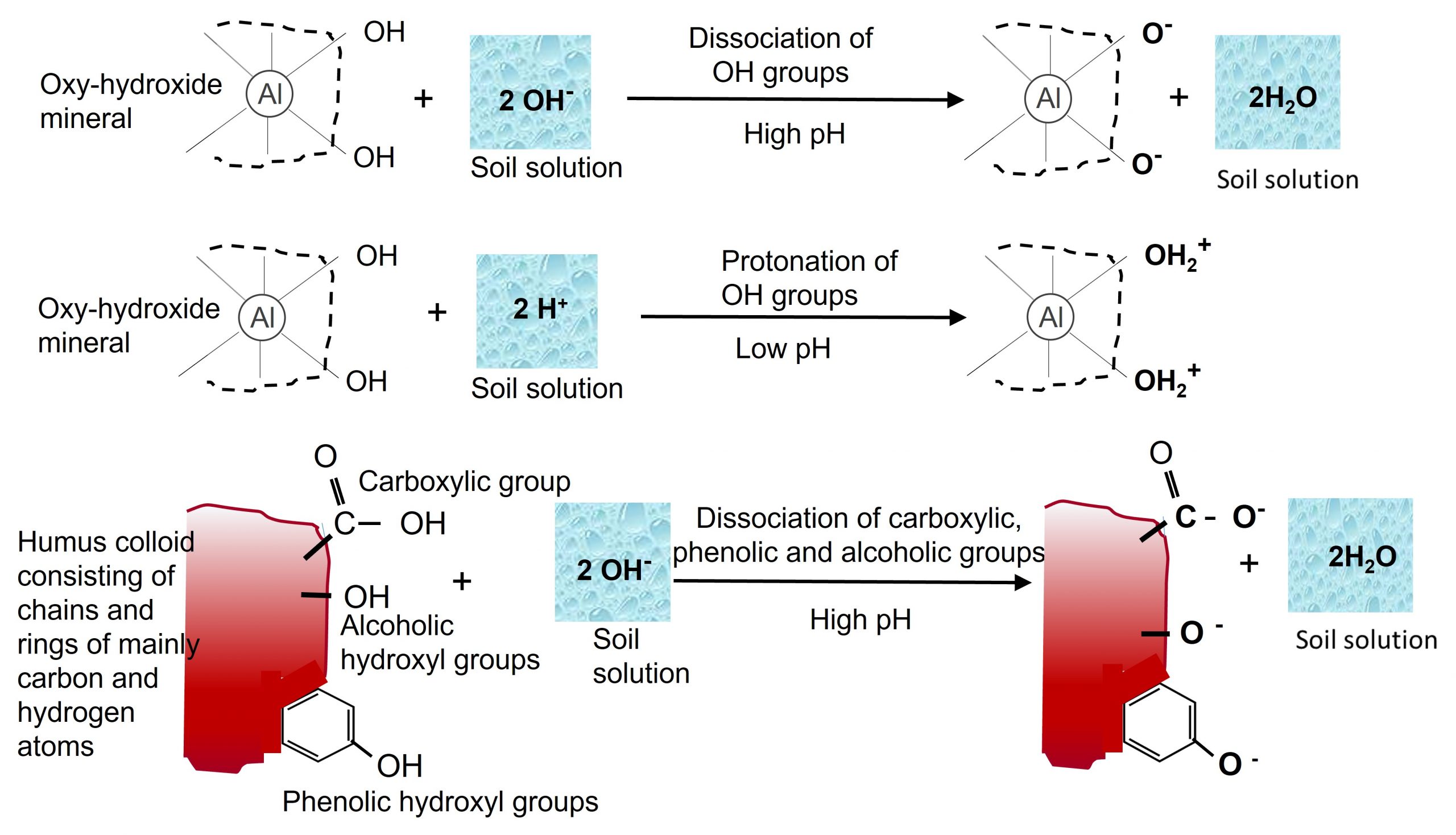
Tanto los minerales de oxihidróxido cristalino como amorfo no llevan cargas negativas permanentes pero tienen una alta carga superficial asociada con grupos hidroxilo superficiales. Como tal, la capacidad de intercambio de oxihidróxidos es muy dependiente del pH con la variación debida a la protonación de grupos hidroxilo a pH bajo produciendo cargas positivas, y la disociación de grupos hidroxilo a pH alto produciendo cargas negativas. Los minerales oxi-hidróxido son anfóteros debido a su capacidad variable de intercambio catiónico; lo que significa que típicamente tienen una capacidad neta de intercambio catiónico a pH alto y una capacidad neta de intercambio aniónico a pH bajo.
Los oxihidróxidos generalmente se encuentran en pequeñas cantidades en suelos jóvenes canadienses, pero son más comunes en suelos altamente erosionados que se encuentran en regiones cálidas y húmedas de otras partes del mundo. Son altamente reactivas y tienen una superficie específica muy alta. La presencia de estos minerales influye significativamente en las propiedades del suelo, como la adsorción e intercambio de iones.
Coloides Orgánicos (Humus)
Los coloides orgánicos, generalmente conocidos como humus, consisten en materia orgánica altamente descompuesta. Estos coloides tienen una estructura compleja, y están compuestos químicamente principalmente de carbono, hidrógeno y oxígeno. A escala molecular, el humus puede describirse como una mezcla polimérica compleja de componentes orgánicos aleatorios y es probablemente uno de los aspectos menos entendidos de la química del suelo. Los coloides orgánicos pueden ser altamente reactivos químicamente, con altas capacidades de retención de agua que permiten la absorción de agua. En comparación con los coloides inorgánicos, los coloides orgánicos tienen mayor área superficial específica y mayor carga superficial. Las cargas superficiales son predominantemente negativas y dependientes del pH derivadas de la disociación parcial de grupos hidroxilo (-OH), carboxilo (-COOH) y fenólicos, los cuales se asocian con estructuras centrales de carbono de tamaño y complejidad variables. Por unidad de masa, los coloides orgánicos imparten una mayor influencia en las propiedades del suelo que los coloides inorgánicos, aunque su abundancia en el suelo es generalmente mucho menor que la de la fracción coloidal inorgánica.
Cargas en Coloides de Suelo
Las cargas sobre los coloides del suelo surgen de los siguientes dos mecanismos:
- Sustitución isomórfica dentro de la estructura cristalina de filosilicatos, lo que lleva a la formación de cargas permanentes en su mayoría negativas. Como se describió anteriormente en este capítulo, la sustitución isomorfa es la sustitución de un átomo por otro de tamaño similar en una red cristalina sin alterar o cambiar la estructura cristalina del mineral. La sustitución de un catión de valencia superior por un catión de valencia inferior (por ejemplo, la sustitución de Mg 2+ por Al 3+ en la lámina octaédrica) da como resultado una carga negativa desequilibrada en las superficies minerales. Estas cargas negativas son permanentes y por lo tanto no se ven afectadas por el pH.
- Protonación/Desprotonación de grupos funcionales en las superficies de arcillas oxi-hidróxido, los bordes de minerales arcillosos de filosilicato y compuestos orgánicos, dan lugar a cargas positivas y negativas, denominadas carga (variable) dependiente del pH. La protonación de los grupos funcionales ocurre bajo condiciones ácidas (pH bajo) mientras que la disociación de protones hidroxilo predomina en condiciones básicas (pH alto) (Figura 5.6). Así, las cantidades relativas de carga superficial positiva y negativa varían dependiendo del pH del suelo, predominando las cargas negativas en condiciones de pH alto y las cargas positivas predominando en condiciones de pH bajo. El pH al que el número de cargas positivas es igual al número de cargas negativas se conoce como el punto de carga neta cero de protones o punto de carga cero. Las superficies de las partículas de humus son similares a los coloides inorgánicos, conteniendo grupos funcionales (e.g., carboxilo [-COOH], fenólico [R-OH]) que pueden disociarse (desprotonar) dependiendo del pH, dando lugar a una carga negativa en coloides orgánicos. A medida que aumenta el pH, la disociación es mayor y las cargas negativas aumentan. En suelos ácidos, las condiciones favorecen al grupo funcional no disociado, por lo que las cargas negativas son bajas.
Influencia de Coloides del Suelo en las Propiedades del Suelo
La cantidad y tipo de coloides inorgánicos y orgánicos presentes en el suelo tiene una profunda influencia en las propiedades del suelo. Por ejemplo, los suelos que contienen una alta proporción de humus tienen altas capacidades de retención de agua. Los suelos que tienen una alta proporción de minerales arcillosos de libre expansión, como la esmectita, se contraen cuando están secos y se hinchan cuando están húmedos Los vertisoles, suelos de textura fina que contienen > 60% de arcilla de los cuales al menos la mitad es esmectita, suelen ser muy pegajosos cuando están mojados y forman grietas anchas cuando están secos.
Los filosilicatos, oxihidróxidos y partículas de humus tienen cargas eléctricas en sus superficies, lo que contribuye a la carga total en los suelos y, por lo tanto, a la capacidad de intercambio catiónico. Los rangos de CEC asociados a los diferentes coloides del suelo se presentan en el Cuadro 5.3. Por ejemplo, un suelo que contenga 40% de arcilla esmectita con CEC de 100 cmol (+) kg -1 puede aportar hasta 40 cmol (+) kg -1 al CEC total del suelo. Dada su alta densidad de carga, el humus puede ser un contribuyente significativo al CEC total incluso en suelos minerales, particularmente en condiciones de pH neutro a alto donde dominan las cargas negativas dependientes del pH. Dependiendo de las características del humus, el pH y las interacciones del humus con otras partículas del suelo, un contenido de humus de 3% (asumiendo una CEC de 400 cmol (+) kg -1), puede aportar hasta 12 cmol (+) kg -1 a la CEC del suelo. La contribución de las arcillas oxi-hidróxido de hierro a la CEC también depende del pH. Sin embargo, en comparación con humus y filosilicatos con CEC alta, el aporte de oxihidróxidos de hierro hacia la CEC del suelo es insignificante. Por el contrario, los oxihidróxidos junto con los silicatos de capa de tipo 1:1 pueden presentar cargas positivas en condiciones ácidas y, por lo tanto, son una fuente principal de capacidad de intercambio de aniones.
Cuadro 5.3. Rangos de CEC en diferentes coloides de suelo. Adaptado de Brady y Weil (2010) y Personal de Encuesta de Suelos (2014)
| Coloide | Rango CEC [cmol (+) kg -1] |
|---|---|
| Caolinita | 2 a 16 |
| Clorita | 10 a 40 |
| Mica/ilita hidratada | 20 a 40 |
| Montmorillonita | 60 a 100 |
| Vermiculita | 100 a 150 |
| Materia orgánica (humus) | 150 a 400 |
| Aluminosilicatos amorfos | 5 a 350 |
| Oxihidróxidos de Fe/Al | ~0 a 3 |
INTERCAMBIO CATIÓNICO EN SUELOS
Las superficies cargadas negativamente en los coloides del suelo atraen cationes por fuerzas electrostáticas. Los cationes retenidos por los coloides del suelo pueden ser eventualmente liberados a la solución del suelo a través del intercambio con otros cationes en la solución del suelo. Los cationes que más comúnmente contienen las partículas coloidales del suelo son Ca 2+, Mg 2+, K +, Na +, H + y Al 3+. De estos, Ca 2+, Mg 2+, K + y Na + son los llamados cationes formadores de bases, mientras que H + y Al 3+ son cationes formadores de ácido. H + y Al 3+ intercambiables se encuentran en abundancia creciente en suelos ácidos.
El intercambio catiónico es un proceso por el cual los cationes en la solución del suelo se intercambian con cationes adheridos a las superficies de minerales arcillosos y humus. El intercambio catiónico ocurre sobre una base de carga por carga como se ilustra en la Figura 5.7.
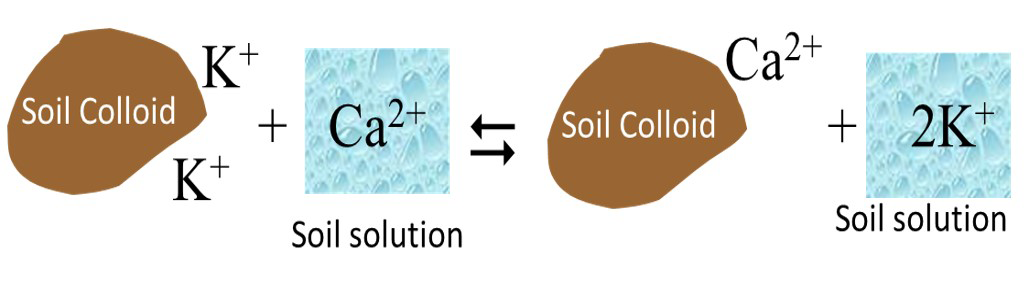
Las reacciones de intercambio catiónico son estequiométricas. Así, para los intercambios divalentes-monovalentes (e.g., intercambio entre Ca 2+ y K +) se intercambian cationes divalentes con dos cationes monovalentes. La reacción es rápida (casi instantánea) y alcanza el equilibrio rápidamente. La reacción de intercambio catiónico suele ser reversible, a menos que el catión intercambiado se fije en el espacio intercapa de un filosilicato (por ejemplo, K + en mica/illita hidratada).
La capacidad de intercambio catiónico (CEC) se define como la suma de cationes intercambiables totales que un suelo puede adsorber (Brady & Weil, 2010). El CEC generalmente se expresa en centimoles de carga positiva por kilogramo de intercambiador (cmol (+) kg -1) o milimoles de carga positiva por kilogramo de intercambiador (mmol (+) kg -1). Así, un suelo con una CEC de 10 cmol (+) kg -1 puede adsorber 10 cmol de un catión monovalente (e.g., Na +) o 5 cmol de un catión divalente (e.g., Ca 2+). En este ejemplo, si Na + se intercambia con otro catión monovalente (e.g., K +), 10 cmol de K + se intercambiarían con 10 cmol de Na +. Sin embargo, si el intercambio es con un catión divalente (e.g., Ca 2+) solo 5 cmol de Ca 2+ se intercambiarán con 10 cmol de Na +.
Dado que son las cargas negativas (incluidas las cargas negativas dependientes del pH) en los coloides del suelo las responsables de la CEC de un suelo, las cantidades de coloides inorgánicos y orgánicos, el tipo de minerales arcillosos presentes y el pH del suelo son los principales factores determinantes que controlan el CEC de un suelo.
¡Puedes Cavar!
El intercambio iónico en los suelos es importante para sostener la vida en la Tierra. Debido al intercambio iónico, los nutrientes de las plantas se retienen en el suelo y se liberan cuando las plantas lo necesitan. Por lo tanto, el intercambio iónico ocupa una posición central única para los suelos en su capacidad para suministrar nutrientes a las plantas y actuar como un filtro para retener los contaminantes que llegan al agua subterránea. El intercambio iónico retiene compuestos tóxicos, reduciendo su movilidad, protegiendo así los recursos hídricos de la contaminación.
Determinación de la capacidad de intercambio catiónico
La CEC del suelo generalmente se estima saturando todos los sitios de intercambio catiónico con un catión índice y luego reemplazando y midiendo la cantidad del catión índice liberado a la solución. El primer paso es saturar una masa conocida de suelo secado al horno con un catión índice (por ejemplo, Na + o NH 4 +). Esto se logra equilibrando la muestra con una solución que contiene el catión índice tamponado a pH 7.0 (generalmente acetato de sodio o acetato de amonio). Después de asegurar que todos los cationes son desplazados por el catión índice, el exceso de catión índice se elimina de la muestra de suelo mediante lixiviación con una solución no polar como etanol al 95%. La cantidad de catión índice que contienen los sitios de intercambio en la muestra debe determinarse entonces lixiviando el suelo con una solución que contenga un catión diferente (por ejemplo, K +) para reemplazar el catión índice en los sitios de intercambio. Luego se mide la concentración de catión índice en el lixiviado y se utiliza para calcular la CEC del suelo (Hendershot et al., 1993).
Saturación Base
La proporción de CEC saturados por cationes formadores de bases (típicamente Ca 2+, Mg 2+, K + y Na +) se conoce como saturación de bases. El porcentaje de saturación base se calcula usando la ecuación:
(1)
Tanto la CEC como la suma de cationes formadores de bases intercambiables deben expresarse en las mismas unidades (e.g., cmol (+) kg -1). Dado que los cationes formadores de bases intercambiables dominantes en los suelos son Ca 2+, Mg 2+, K + y Na +, la ecuación generalmente se escribe como:
(2)
Obsérvese que para los cationes divalentes como Ca 2+ y Mg 2+, se deben calcular cationes intercambiables en cmol (+) considerando la carga; es decir, 1 cmol Ca 2+ = 2 cmol de carga (+). La saturación de la base está relacionada positivamente con el pH del suelo. Si el pH es bajo (<7) entonces la saturación base también es baja. Y, a medida que aumenta el pH del suelo, la saturación de la base también aumenta aproximadamente linealmente entre pH 4 y 7.
ADSORCIÓN E INTERCAMBIO DE ANIONES
Los suelos son capaces de retener aniones de manera similar a los cationes de retención, particularmente en el rango de pH más bajo cuando las superficies de algunos coloides (por ejemplo, oxihidróxidos) tienen cargas positivas. La retención de aniones a través de la adsorción varía de un anión a otro. Algunos aniones se retienen a través de mecanismos de adsorción no específicos, mientras que otros se retienen a través de mecanismos de adsorción específicos
La adsorción no específica se refiere a un anión que es retenido por sitios cargados positivamente y los aniones se mantienen débilmente a través de fuerzas electrostáticas. Este tipo de adsorción es común para aniones como cloruro (Cl —) y NO 3 —. Estos aniones se sujetan débilmente sobre superficies con carga positiva y pueden intercambiarse libremente con otros aniones en solución del suelo; en consecuencia, pueden perderse fácilmente por lixiviación. Para que se produzca una adsorción no específica, las superficies coloidales deben estar cargadas positivamente; así, el suelo que contiene minerales con cargas dependientes del pH tienen una alta capacidad de intercambio de aniones, particularmente a pH bajo. Los suelos del trópico contienen altas proporciones de oxihidróxidos y caolinita, los cuales presentan cargas positivas en condiciones de pH bajo, por lo que en estos suelos, la adsorción de aniones a través de mecanismos no específicos puede ser alta.
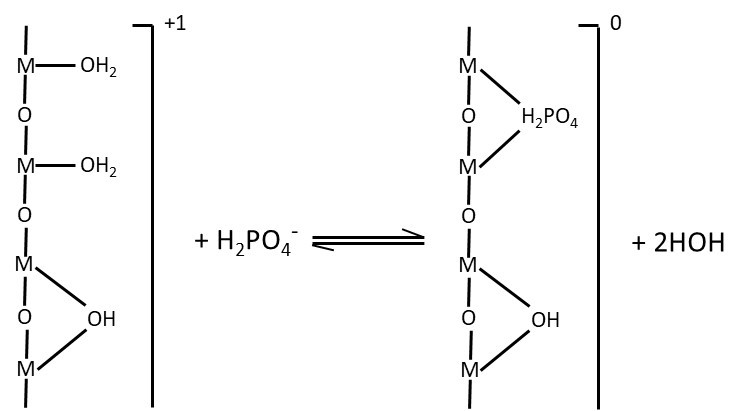
La adsorción específica ocurre cuando el ion se une químicamente a la superficie del coloide. Los mecanismos son específicos del anión que se adsorbe. Por ejemplo, los aniones fosfato (p. ej., H 2 PO 4 —) pueden adsorberse específicamente a ciertas superficies coloidales a través del intercambio de un hidroxilo superficial en el coloide por un átomo de oxígeno que es parte del anión (Figura 5.8). El anión fuertemente unido no es móvil en los suelos y está menos disponible para las plantas. La adsorción específica solo es mínimamente reversible, lo que resulta en una pérdida permanente del ion de la solución del suelo y de la absorción por las plantas. En casos extremos, la superficie mineral original puede quedar completamente recubierta con el ion adsorbido. Los aniones comunes que se retienen en el suelo mediante adsorción específica son fosfato, sulfato, silicato y carbonato.
pH DEL SUELO
El pH del suelo es una medida de la actividad (cf. concentración) de los iones de hidrógeno en la solución del suelo y describe la acidez o alcalinidad en el suelo. “Para nuestra discusión aquí definimos la actividad como concentración “" efectiva "”, por lo que la actividad es aproximadamente igual a la concentración en soluciones diluidas pero generalmente se desvía de la concentración (típicamente llegando a ser menor que la concentración) a medida que aumenta la concentración total de sales disueltas en la solución del suelo . Para los propósitos actuales, asumimos que la actividad y la concentración son iguales.
La escala de pH estándar abarca de 0 a 14, siendo neutro un valor de pH de 7. El agua pura tiene un valor de pH de 7.0. Los valores de pH menores a 7 son ácidos y se vuelven cada vez más ácidos cuando los valores se acercan a cero Los valores de pH mayores a 7 son alcalinos o básicos, y se vuelven cada vez más alcalinos a medida que los valores se acercan a 14. La escala de pH es logarítmica, lo que significa que por cada cambio de una unidad en el pH hay un cambio de 10 veces en la actividad de los iones de hidrógeno en la solución del suelo. Por ejemplo, un suelo con pH 6 tiene diez veces más iones hidrógeno en solución que un suelo a pH 7, y un suelo con pH 8 tiene diez veces menos iones hidrógeno que un suelo a pH 7. En la Figura 5.9 se muestra una comparación de los valores de pH del suelo para algunos suelos con algunos ácidos y bases comunes.
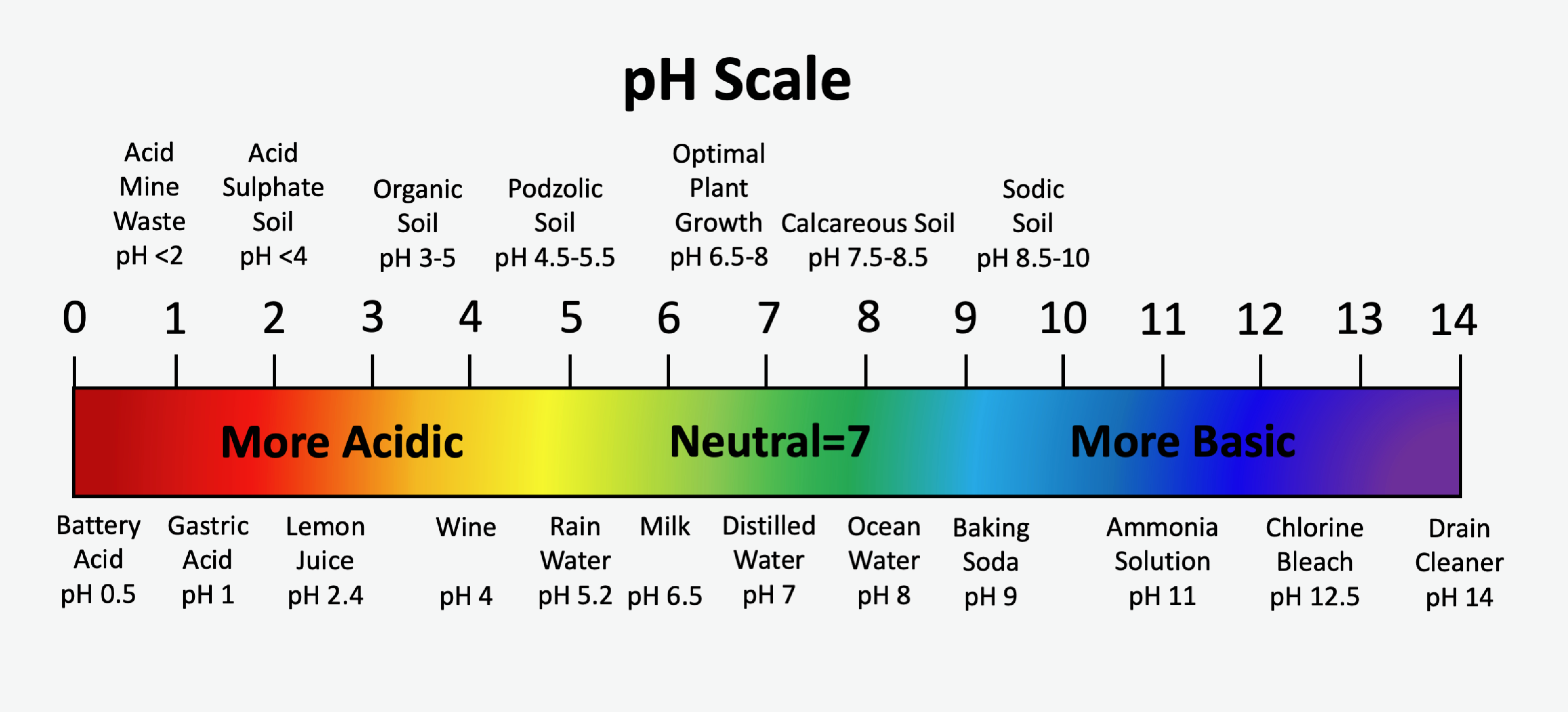
Los principales factores que influyen en el pH natural del suelo son los materiales geológicos parentales del suelo y la reacción con dióxido de carbono (CO 2) disuelto en agua meteórica. Los ácidos orgánicos derivados de la descomposición de la vegetación también influyen en el pH del suelo. Generalmente, los suelos minerales en Canadá se forman sobre uno de dos materiales parentales definidos muy ampliamente: los desarrollados en materiales parentales a base de granito, comúnmente conocidos como materiales parentales ácidos, y los desarrollados en materiales parentales a base de carbonato, comúnmente conocidos como materiales primarios alcalinos. Los materiales parentales de base granítica se derivan principalmente de rocas del Escudo Precámbrico, mientras que los materiales parentales a base de carbonato, típicamente piedra caliza y dolomita (dolomita), se derivan de rocas envejecidas paleozoicas o más jóvenes. Los suelos formados a partir de materiales parentales de base granítica están generalmente en el rango de pH ácido. Por el contrario, los suelos formados sobre materiales parentales a base de carbonato suelen tener valores de pH del suelo en el rango neutro a alcalino.
El agua de lluvia se equilibre con los gases atmosféricos, particularmente el CO 2, y tiene un pH de aproximadamente 5.6. Otros factores como los contaminantes atmosféricos (por ejemplo, dióxido de azufre que se hidroliza a ácido sulfúrico) típicamente hacen que el pH sea más bajo. La tendencia general para todos los suelos es ser conducidos al extremo ácido de la escala de pH con una duración creciente de exposición a la precipitación, lo que puede provocar la lixiviación de cationes básicos. Los materiales parentales graníticos generalmente contienen muy poco material mineral básico y, por lo tanto, el pH del suelo de base granítica se conduce fácilmente al extremo ácido de la escala de pH. Los suelos podzólicos, típicamente desarrollados sobre materiales parentales graníticos, tienen valores de pH en el rango de 4.5 a 6.0. Aunque puede parecer algo contrario a la intuición, el pH de los suelos que contienen minerales carbonatados se amortiguan contra los efectos acidificantes del CO 2 disuelto en la solución del suelo. Los materiales del suelo calcáreo suelen tener valores de pH en el rango de 7.5 a 8.5.
El pH del suelo puede estar amortiguado en algunos suelos. Es decir, aunque el pH refleja la concentración de H+ en solución al momento de la medición, existen fuentes adicionales de H + en sitios de intercambio denominados “acidez intercambiable” que amortiguan y mantienen el pH en solución. A través del intercambio de H + entre la solución del suelo y los sitios de intercambio, los suelos con CEC altos pueden amortiguar el pH del suelo, lo que significa que resistirán un cambio en el pH cuando se agrega un compuesto ácido o básico (por ejemplo, un fertilizante). La acidez, medida inmediatamente en la solución del suelo, se denomina “acidez activa”, mientras que la acidez en los sitios de intercambio se denomina “acidez de reserva”. Algunos suelos tienen un alto pH tamponado con una gran cantidad de acidez de reserva (por ejemplo, suelos con alto contenido de arcilla y/o materia orgánica), mientras que otros no lo son (por ejemplo, suelos arenosos con bajo contenido de materia orgánica).
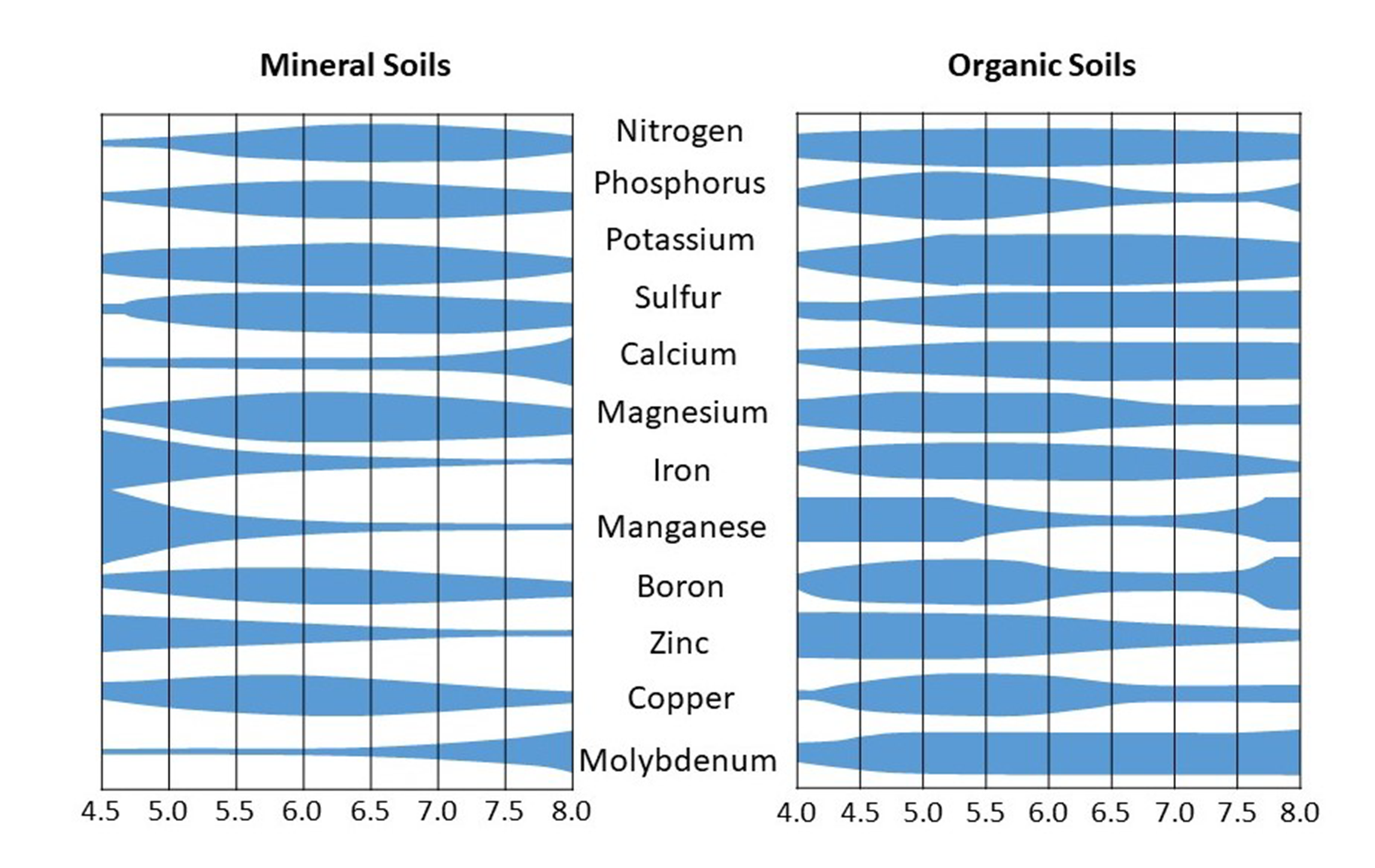
El pH del suelo afecta la disponibilidad de nutrientes vegetales. Sin embargo, no todos los nutrientes están disponibles a un nivel de pH específico. Los valores de pH del suelo en el rango de 6.5-8.0 se consideran óptimos para la disponibilidad de la mayoría de los nutrientes para las plantas. Generalmente, los valores extremos de pH son perjudiciales para la absorción de nutrientes y el crecimiento de las plantas Por ejemplo, los valores de pH ácidos incrementan la solubilidad del aluminio, manganeso y hierro, los cuales son potencialmente tóxicos para las raíces de las plantas cuando se encuentran en altas concentraciones en la solución del suelo. Estos elementos también pueden reaccionar con los nutrientes de las plantas para hacerlos inaccesibles para las plantas. De igual manera, los valores de pH alcalino resultan en cantidades excesivas de calcio en el suelo que también reaccionan con los nutrientes (p. ej., fosfato) por lo que no están disponibles para el uso de las plantas Los rangos generales de nutrimentos disponibles con pH en suelos minerales y orgánicos se muestran en la Figura 5.10.
Ácidos y Bases
Los valores de pH del suelo reflejan las diversas reacciones que involucran pares ácido-base en el agua, que a su vez disocia:
H 2 O ↔ H + + OH —
Se dice que una solución acuosa es neutra (pH = 7) cuando la concentración de protones [H +] equivale exactamente a la concentración de iones hidroxilo ([OH —]), con ambos iguales a 10 -7 moles por litro.
Un ácido es cualquier sustancia química que puede donar un protón cuando se disuelve en agua, mientras que una base es cualquier sustancia que pueda aceptar un protón. Cuando un ácido pierde un protón forma la base conjugada:
HL ↔ H + + L —
En la expresión anterior HL es un ácido capaz de donar un protón (H +) a solución y L — es la base conjugada, capaz de aceptar un protón. En esta expresión, la base (L —) o la base conjugada también se denomina ligando. La fuerza de un ácido es la medida de su capacidad para disociarse en agua y liberar protones a la solución. Un ácido fuerte (por ejemplo, ácido sulfúrico) es una sustancia que se disocia completamente en protones y ligandos.
Una base es cualquier sustancia química que pueda generar iones hidróxido (OH —) o que absorba iones H + en solución formando su ácido conjugado.
B + H 2 O ↔ OH — + BH +
La materia orgánica del suelo humidificado, aunque tal vez todavía poco entendida en términos de composición estructural/química específica, es la fuente de grupos funcionales superficiales que influyen en la química del suelo. Algunos de los grupos funcionales orgánicos más importantes incluyen grupos carboxílico (—COOH), fenólico OH, alcoholico-OH, carbonilo (C=O) y quinona, así como grupos amina (-NH 2) y tiol (-SH). Los grupos funcionales ácido carboxílico, OH fenólico-OH y alcoholico-OH contribuyen a la acidez y al intercambio iónico. Estos grupos se comportan como ácidos débiles en el suelo actuando como fuente de acidez de reserva y sirven como sitios de intercambio catiónico. Otros grupos funcionales, como los ácidos aromáticos, se disocian y funcionan de manera similar.
El pH del suelo controla muchos de los procesos químicos que tienen lugar en el suelo, especialmente la disponibilidad de nutrientes de las plantas. La mayoría de los suelos tienen pH en el rango de 5 a 8 con el rango de pH óptimo para la mayoría de las plantas agronómicamente importantes entre 5.5 y 7.5, aunque muchas especies de plantas se han adaptado a valores de pH fuera de este rango. Por ejemplo, los arándanos prefieren suelos con pH en el rango de 4.3 a 5.5, creciendo muy mal en suelos con pH en el rango alcalino (pH>7).
Si el suelo contiene significativamente más Na + en la solución del suelo en comparación con Ca 2+ o Mg 2+, puede haber un riesgo de acumulación de sodio. Esta acumulación de iones es de mayor preocupación en regiones áridas o semiáridas (por ejemplo, praderas canadienses) que en regiones más húmedas (por ejemplo, el este de Canadá). Los suelos con niveles de sodio naturalmente altos, o aquellos que han recibido grandes cantidades de bicarbonato de sodio (Na 2 CO 3) a través del riego, pueden tener niveles de pH de 8.5 o superiores. Este alto valor de pH se debe a la presencia de precipitados de Na 2 CO 3 en el suelo que producen el pH elevado. Este proceso es una característica de los suelos solonetzicos discutidos más adelante en este capítulo.
Medición del pH del suelo
El pH de un suelo es probablemente la propiedad química del suelo medida con mayor frecuencia. Las mediciones de pH del suelo se realizan típicamente usando un medidor de pH comercial equipado con un electrodo de pH de vidrio combinado. Los electrodos de combinación son electrodos individuales que incluyen tanto un electrodo de vidrio como un electrodo de referencia. Existen numerosos métodos para la medición del pH del suelo, los cuales dependen de la aplicación. Los métodos varían según las proporciones suelo a solución utilizadas; adición de electrolito y tiempo de reposo de la muestra antes de la medición. Los métodos incluyen, pero no se limitan a, mediciones en: pasta saturada; suspensiones 1:1, 1:2, 1:2 .5, 1:5 y 1:10 de suelo:agua; 1:2 y 1:5 de suelo:0.01m CaCl 2 suspensiones; 1M KCl; y 1.0M NaF (Soil Survey Staff, 2014; Hendershot et al., 2008). La medición del pH del suelo es la de la solución en contacto con los sólidos del suelo y no de los propios sólidos del suelo (Hendershot et al., 2008). Los valores de pH del suelo medidos en suspensiones de electrolitos (por ejemplo, 1:2 suelo a 0.01 M CaCl 2) suelen ser más estables y reproducibles que los tomados en agua debido a que la concentración del electrolito es constante. Sin embargo, la adición de un electrolito generalmente produce una disminución en el pH del suelo en comparación con el agua; por ejemplo, los valores medidos en suspensiones suelo:agua son típicamente 0.5—0.6 unidades más altos que aquellos en 0.01M CaCl 2, y 0.7 unidades más altos que aquellos en 1M KCl. Esto se debe a la inclusión de acidez intercambiable (reserva) introducida en la solución a través de reacciones de intercambio iónico que involucran Ca 2+ u otro ion introducido con iones Al 3+ y/o H + en los sitios de intercambio.
Aunque el pH de un suelo que contiene un mineral carbonato debería ser idealmente de 8.2, las mediciones del pH del suelo para estos suelos se encuentran comúnmente en el rango de 7.6 a 8.5. Este pH medido es el resultado de varios factores. Primero, además de iones intercambiables como Ca 2+, Mg 2+, Na + y K +, los sitios de intercambio iónico en el suelo también contienen pequeñas cantidades de aluminio y hierro intercambiables, que al entrar en la solución del suelo hidrolizan y reaccionan para reducir el pH medido del suelo. Segundo, aunque los suelos pueden contener carbonatos, la dolomita mineral [Ca, Mg (CO 3) 2] reacciona (se disuelve) mucho más lentamente en comparación con la calcita (CaCo 3), y el pH puede no estabilizarse dentro del lapso de tiempo (por ejemplo, dentro de una hora) de la medición. En tercer lugar, los procedimientos típicos para las mediciones de pH (por ejemplo, Hendershot et al., 2008) recomiendan permitir que la suspensión de muestras preparada permanezca durante una hora antes de la medición del pH. Este procedimiento proporciona un tiempo de reacción estándar que permite una fácil adaptación para operaciones rutinarias de alto rendimiento de muestras en laboratorios comerciales de suelos que siguen métodos analíticos estándar acreditados por ISO17025. Aunque este marco de tiempo es suficiente para permitir el equilibrio de intercambio iónico, puede o no ser suficiente para permitir el equilibrio completo para la disolución del carbonato y el equilibrio con CO 2 en la atmósfera. Otras reacciones químicas también pueden influir en el pH medido.
Ajuste del pH del suelo
La tendencia natural es que el suelo se vuelva más ácido a través de la acidez natural del agua de lluvia, la descomposición de la materia orgánica y mediante la aplicación de fertilizantes como la urea y el amoníaco anhidro. Sin embargo, el pH del suelo también puede incrementarse mediante adiciones de piedra caliza agrícola. El momento y la cantidad de “cal” agrícola aplicada depende del cultivo a cultivar, siendo comúnmente aconsejable la aplicación de cal cuando los valores de pH del suelo disminuyen por debajo de 6.0 (Munro, 2018). La piedra caliza finamente molida (compuesta principalmente por la calcita mineral; CaCo 3) o dolostone (compuesta principalmente por el mineral dolomita; Ca, Mg (CO 3) 2) son los productos de encalado más utilizados, aunque se pueden usar muchos otros productos con capacidad de neutralización ácida.
¡Puedes Cavar!

El programa de lamentaciones de Sudbury
Un siglo de fumigación de dióxido de azufre y deposición de partículas de níquel por fundiciones de metales básicos, junto con el fuego, la erosión del suelo y la acción mejorada de las heladas dejaron miles de hectáreas de tierras áridas con suelos erosionados y bosques de álamo abiertos y atrofiados en el área de Sudbury.
Los suelos relictos de la zona son de textura gruesa, Podzols erosionados que son ácidos, ricos en metales, pobres en nutrientes y propensos a la sequía, todos los cuales han contribuido a limitar la recolonización de las plantas. La vulnerabilidad a la sequía de las plántulas que germinan en los suelos se incrementó aún más por la toxicidad del aluminio limitando el crecimiento de las raíces, y exacerbada por una mayor acción de las heladas en el suelo de textura media que carecía de la protección de formas de humus superficiales previamente perdidas como resultado del viento y erosión hídrica.
Se desarrolló un programa de revegetación que desintoxicó los suelos lo suficiente como para permitir una colonización exitosa, basado en investigaciones de campo en la década de 1970, demostrando que la aplicación superficial de piedra caliza dolomítica molida [principalmente CaMg (CO 3) 2] a 10 toneladas por hectárea ajustó el pH del suelo de menos de 3.0 a entre 5.2 y 5.6. La aplicación del tratamiento de encalado, con o sin un fertilizante acompañante y/o una aplicación de semilla de pasto-leguminosa, condujo a la colonización natural por especies leñosas incluyendo abedul, álamo temblón y sauces. Esta colonización se ha visto favorecida por la plantación de una mezcla de especies nativas de coníferas y caducifolias juntas en grupos para formar un “banco de semillas” para una futura colonización, con casi 10 millones de árboles plantados en la región de Sudbury entre 1976 y 2020.
El ajuste del pH del suelo hacia el extremo ácido de la escala puede ser requerido al cultivar ciertos cultivos como papa, arándanos, azaleas o algunos otros cultivos hortícolas. El ajuste de pH a la baja generalmente se logra con la adición de azufre elemental, compuestos que contienen azufre o fertilizantes que contienen amoníaco; sin embargo, la aplicación de enmiendas para disminuir intencionalmente el pH del suelo es muy poco común.
SALINIDAD Y SODICIDAD DEL SUELO
Los niveles de salinidad del suelo son controlados por la concentración de sales minerales disueltas totales presentes en la solución del suelo. Las sales ocurren naturalmente tanto en el suelo como en el agua y pueden, bajo ciertas condiciones, acumularse en el suelo. La acumulación de sales solubles en el suelo se conoce como salinización. Las sales disueltas que contribuyen a la salinidad del suelo incluyen los cationes Na +, Ca 2+, Mg 2+ y K +, y los aniones Cl −, SO 4 2−, HCO 3 −, CO 3 2− y NO 3 −.
La sodicidad está relacionada con la salinidad, pero se refiere específicamente a la concentración de Na + en la solución del suelo en relación con las concentraciones de Ca 2+ y Mg 2+. El grado de sodicidad, estimado por cálculo de la relación de adsorción de sodio (SAR), es una medida de la concentración de Na + en extracto de suelo saturado en relación con las concentraciones de Ca 2+ y Mg 2+. El SAR se calcula como la relación de la concentración de Na + dividida por la raíz cuadrada de las concentraciones promedio de [Ca 2+ + Mg 2+]. Se utiliza la raíz cuadrada de concentraciones de [Ca 2+ + Mg 2+] ya que estos son iones divalentes mientras que el Na es monovalente. La sodicidad se puede cuantificar como porcentaje de sodio intercambiable (ESP); es decir, el Na + intercambiable expresado como porcentaje de capacidad de intercambio catiónico. Si el SAR del suelo es igual o superior a 13, o si el ESP del suelo es igual o superior al 15%, el suelo se llama sódico.
(3)
(4)
Desarrollo de Salinidad en Suelos
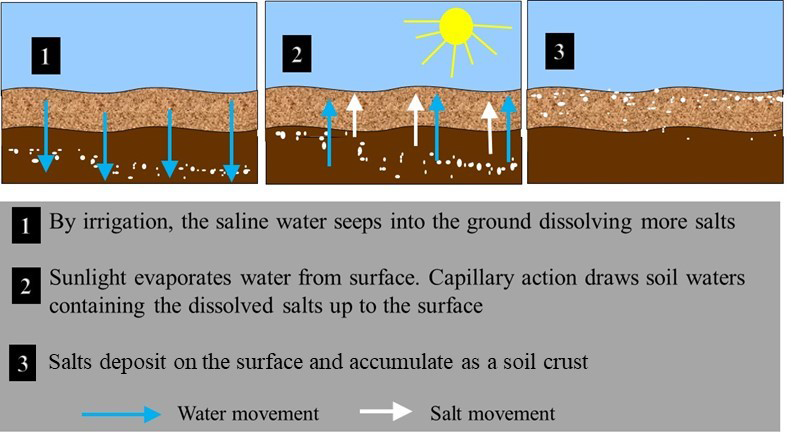
Las sales en los suelos provienen de fuentes naturales y antropogénicas. Las fuentes naturales incluyen meteorización de minerales primarios, deposición atmosférica, intrusiones de agua de mar, descarga de agua subterránea salina y salmueras de depósitos de sal natural. Las principales fuentes antropogénicas de sales incluyen el riego con aguas que contienen altas concentraciones de sal (ver Figura 5.11), la fertilización con fertilizantes sintéticos y orgánicos con alto contenido de sal incluyendo estiércol, biosólidos y compost. Las sales viales aplicadas durante el invierno en Canadá para derretir el hielo y mejorar las condiciones de la carretera, también son una fuente localizada de salinidad a los suelos.
Las sales solubles se acumulan en los suelos por diversas razones:
- Condiciones climáticas secas — Las sales solubles se acumulan en áreas áridas y semiáridas donde la lluvia no es suficiente para lixiviar las sales a través del perfil del suelo. Las altas pérdidas por evaporación de estos suelos resultan en el movimiento ascendente del agua, lo que puede traer sales de las capas más profundas del suelo que luego permanecen en la superficie del suelo como costras visibles cuando el agua se evapora. Las pérdidas evaporativas pueden oscilar entre 50 y 90% en regiones áridas, lo que resulta en un aumento de 2 a 20 veces en los niveles de sales solubles.
- Drenaje — El drenaje deficiente (debido a la alta capa freática o baja permeabilidad del subsuelo) puede aumentar el contenido de sal.
- Calidad del agua de riego — Los problemas de salinidad son comunes en los regadíos ya que la mayoría de las aguas de riego contienen concentraciones variables de sales solubles. El agua añadida al suelo es utilizada por el cultivo o se evapora directamente del suelo húmedo, dejando atrás los iones disueltos para formar costras salinas.
- Regiones costeras — Los suelos en las zonas costeras pueden tener una alta acumulación de sal a través de intrusiones de agua de mar y agua subterránea salina.
- Otras prácticas de manejo — La acumulación de sal puede ocurrir debido a otras prácticas de manejo como el uso excesivo de fertilizantes sintéticos, la aplicación continua de estiércol o la aplicación anual de sales viales que son lavadas en acequias laterales de carretera y/o sopladas sobre campos cercanos y vegetación por el viento.
Medición de la Salinidad del Suelo
La concentración total de sal disuelta de un suelo se puede medir extrayendo una muestra de suelo con agua y midiendo las concentraciones de sales individuales en el extracto. Sin embargo, en la práctica la medición de sales individuales es lenta, engorrosa y costosa; por lo tanto, la conductividad eléctrica (EC) de una solución, que aumenta en proporción directa a la abundancia general de sales disueltas, se emplea como un índice alternativo para evaluar y describir la salinidad del suelo. El extracto de suelo EC es la medida preferida para evaluar el estado general de salinidad del suelo. La medición de EC, realizada con un medidor de conductividad en los laboratorio de pruebas de suelo, es confiable, rápida y rentable. La EC de un suelo se determina en un extracto saturado (es decir, en la solución del suelo extraída de una pasta saturada de suelo) y se expresa en unidades de decisiemens por metro (dS m -1) o milisiemens por centímetro (mS cm -1). Los suelos con un valor EC de extracto de suelo saturado >4 dS m -1 se clasifican como salinos.
Propiedades de los Suelos Afectados por la Sal
Los suelos afectados por la sal pueden clasificarse como salinos , salino-sódicos o sódicos, dependiendo de la concentración total de sales de Na + en el suelo. Los suelos salinos tienen alto contenido de sal pero bajas concentraciones de Na +. Los suelos sódicos tienen un contenido relativamente bajo de sal pero altas concentraciones de Na +. Los suelos salino-sódicos tienen alta concentración tanto de sales como de Na +. La Figura 5.12 ilustra la clasificación de los suelos afectados por sales con base en la CE, SAR y ESP.
Los suelos salinos presentan altas concentraciones de sales disueltas totales, con valores de EC mayores a 4 dS m -1 (Figura 5.12). Estos suelos tienen cantidades relativamente bajas de Na + en la solución del suelo o en el complejo intercambiable, por lo que los valores de SAR son menores a 13 y los valores de ESP son menores a 15%. El pH del suelo de los suelos salinos suele ser inferior a 8.5. Las altas concentraciones de sal en estos suelos promueven la floculación de coloides del suelo (es decir, los coloides individuales son atraídos juntos formando flóculos o racimos).
Los suelos sódicos tienen bajas concentraciones totales de sales disueltas, con valores de EC menores a 4 dS m -1. Estos suelos, sin embargo, tienen concentraciones relativamente altas de Na + en la solución del suelo y en el complejo de intercambio en relación con Ca 2+ y Mg 2+. Por lo tanto, los valores de SAR son mayores a 13 y los valores de ESP son mayores al 15% (Figura 5.12). Los suelos sódicos suelen tener valores de pH mayores a 8.5 debido a la hidrólisis de Na 2 CO 3. Los coloides en estos suelos se dispersan debido a la hinchazón en respuesta a la alta proporción de sodio intercambiable. La hinchazón y dispersión es mayor cuando el complejo de intercambio tiene una mayor proporción de iones hidratados monovalentes particularmente Na +. Cuando los iones Na + hidratados se encuentran entre las partículas de arcilla, las fuerzas electrostáticas que unen las partículas de arcilla se neutralizan y capas adicionales de moléculas de agua obligan a las partículas a separarse, dispersando así los materiales de la matriz del suelo. El alto pH también dispersa la materia orgánica del suelo. Los suelos sódicos alcalinos clasificados como Black Solonetz tienen material húmico disperso de color oscuro que recubre los piedales del suelo.
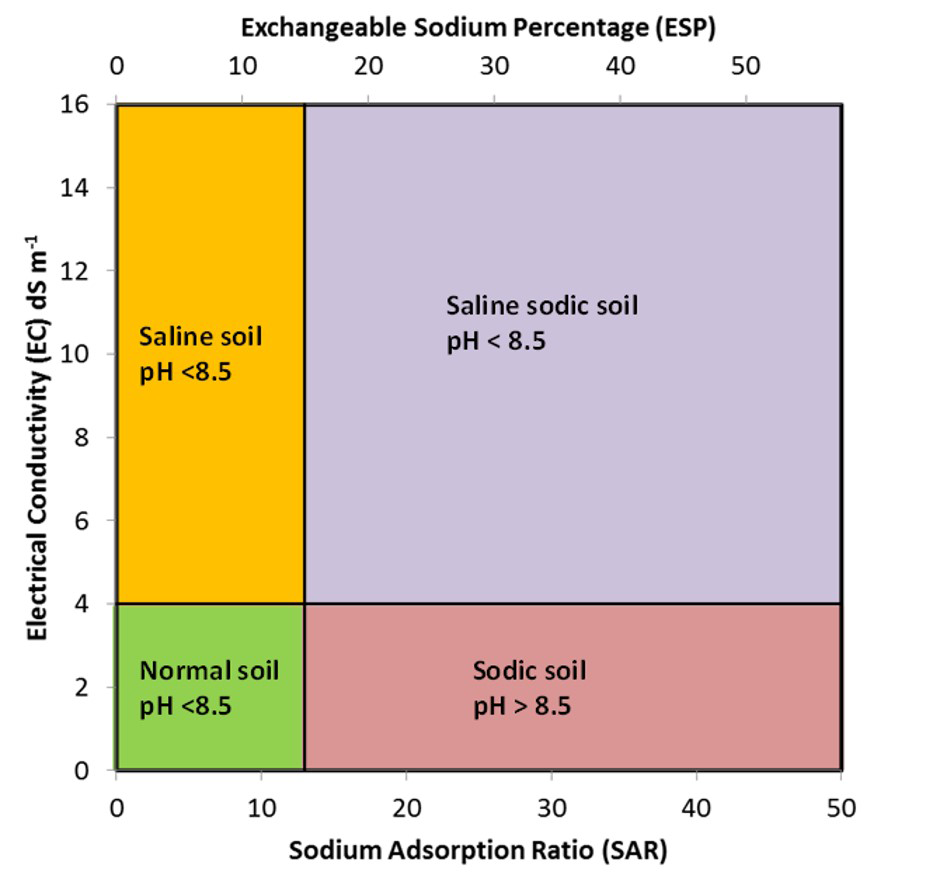
Los suelos con altas concentraciones de sales disueltas así como altas concentraciones de Na + se denominan suelos salino-sódicos. Dichos suelos tienen valores de EC mayores a 4 dS m -1, valores de SAR mayores a 13 y ESP mayores a 15%. Los suelos salino-sódicos suelen tener valores de pH menores a 8.5. Estos suelos se floculan debido a la alta concentración de sales disueltas (Sparks, 2003).
Efectos de la Salinidad y Sodicidad del Suelo en la Eealth del Ecosistema
La salinización del suelo, una de las preocupaciones ambientales mundiales más devastadoras, es una de las principales causas de degradación de la tierra y contribuye a la desertificación de los ecosistemas secos. A nivel mundial, la salinización de los suelos que conduce a la salinidad y la sodicidad han provocado importantes reducciones en las áreas cultivadas y la productividad de los cultivos
Tanto la salinidad como la sodicidad afectan las propiedades del suelo, el crecimiento de las plantas y la actividad microbiana. Las altas concentraciones de sal afectarán adversamente el crecimiento de las plantas ya que las sales disueltas disminuyen el potencial osmótico de la solución del suelo. Dado que las raíces de las plantas absorben agua principalmente por mecanismos osmóticos, son incapaces de absorber agua de suelos altamente salinos, siendo algunas plantas más sensibles a las condiciones salinas que otras. Esta condición resultante se conoce como “sequía fisiológica” ya que las raíces de las plantas son incapaces de absorber agua incluso cuando el contenido de agua en el suelo puede ser adecuado para el crecimiento normal. De igual manera, los microbios en el suelo pueden verse afectados por la incapacidad de obtener agua debido al efecto osmótico.
Cuadro 5.4. Sensibilidad de algunas plantas a condiciones salinas
| Sensible | Moderadamente sensible | Moderadamente tolerante | Tolerante |
|---|---|---|---|
| (EC < 4 dS m -1) | (EC 4-7 dS m -1) | (EC 7-9 dS m -1) | (EC 9-12 dS m -1) |
| Verduras | Alfalfa | Festuca | Cebada |
| Maple | Maíz | Aspen | Trigo |
| Tomates | Gramíneas | Avena | Sauce |
| Papas | Trébol | Soja | |
| Nota: las plantas capaces de sobrevivir a EC en el rango de 12—15 dS m -1 se consideran halófitas; sin embargo, muy pocas, si las hay, pueden sobrevivir valores de EC >15 dS m -1 | |||
La alta concentración de sodio en suelos sódicos favorece el hinchamiento de minerales arcillosos expandibles y la dispersión de partículas arcillosas, lo que resulta en una mala estructura del suelo, una menor permeabilidad e infiltración debido al bloqueo de los poros del suelo y la formación de costras superficiales. La baja infiltración y permeabilidad también puede aumentar la erosión del suelo y puede conducir a la saturación de la superficie del suelo durante el riego y eventos de lluvia/deshielo, restringiendo a su vez la entrada de aire a los suelos. Esto conduce a condiciones anaeróbicas en los suelos que también afectan negativamente el crecimiento de las plantas.
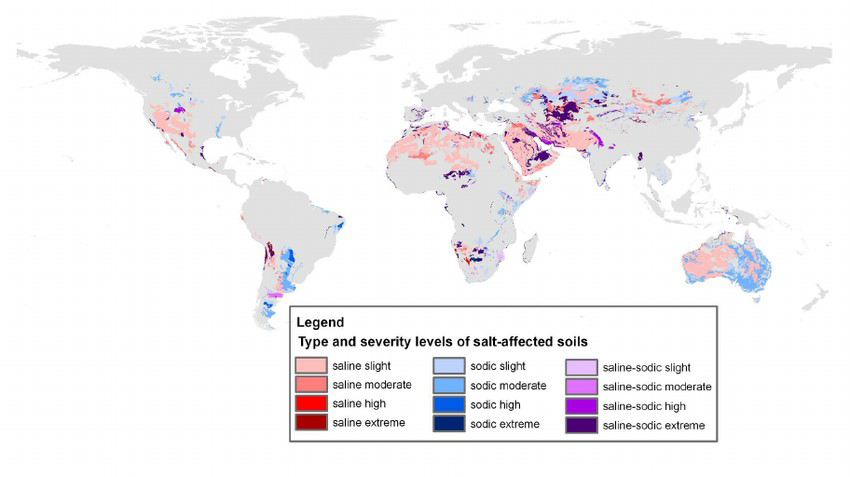
Suelos afectados por la sal: distribución global y en Canadá
La salinización del suelo es un problema global. Los suelos afectados por la sal ocurren en todos los continentes, principalmente en áreas áridas y semiáridas. La salinización es de menor preocupación en áreas húmedas ya que la lluvia es suficiente para lixiviar el exceso de sales del perfil del suelo. Las áreas salinizadas en el mundo aumentan a una tasa de alrededor del 10% anual por causas naturales y antropogénicas. Con base en el mapa mundial de suelos 1970-1980, la superficie total de suelos afectados por la sal a nivel mundial se estima en 397 millones de ha de suelos salinos y 434 millones de ha de suelos sódicos (FAO, 2020). La Figura 5.13 ilustra la distribución de suelos salinos y sódicos a nivel mundial (Zheng, 2014). A nivel mundial se ha reportado degradación de la tierra debido a la salinización en la cuenca del mar de Aral (cuencas de los ríos Amu‐Darya y Syr‐Darya), la cuenca del Indo en la India, la cuenca del Indo en Pakistán, la cuenca del río Amarillo en China, la cuenca del Éufrates en Siria e Irak, la cuenca Murray-Darling en Australia y la cuenca San Valle de Joaquín en Estados Unidos (Qadir et al., 2014).
Se estima que existen entre 6 y 8 millones de hectáreas de suelos afectados por la sal en Canadá, ubicados principalmente en las praderas canadienses (Miller y Brierley, 2011). En 1995, el riesgo de salinización se calificó como moderado a muy alto afectando a un 34% estimado del área de tierras agrícolas en las provincias de las praderas (Acton y Gregorich, 1995), con una estimación que disminuyó a 12% de la superficie de tierras agrícolas para 2001 (Eilers et al., 2010). Esta disminución en el riesgo de potencial de salinización en las tierras agrícolas de las Provincias Praderas se debe en gran parte a la reducción del barbecho estival y a prácticas de conservación como la conversión a cobertura permanente.
¡Puedes Cavar!
Salinidad superficial y subsuperficial en las praderas canadienses: una amenaza para la calidad del suelo y la productividad sustentable del ecosistema
La salinización del suelo es un proceso típico de las praderas canadienses y áreas adyacentes de las llanuras boreales. Se estima que al menos 1,431,00 ha en la región se ven afectadas por la salinidad. Las dos imágenes siguientes muestran la corteza salina blanca, que a menudo ocurre adyacente a humedales poco profundos (pantanos) en las praderas. Las sales son predominantemente sulfatos de calcio y magnesio (sales de yeso y epsom) derivados de la evaporación de la descarga salina de agua subterránea del lecho rocoso debajo de la capa de labranza glacial regional. La expresión superficial es el resultado de una topografía suavemente rodante combinada con un nivel freático alto en el humedal.


La imagen de la derecha muestra los efectos de la salinidad subsuperficial. La expresión más común de suelos afectados por la sal es el crecimiento irregular de plantas de cultivo en un campo. La superficie del suelo puede parecer normal, pero la salinidad suele ser mayor a la profundidad en la zona radicular. Las plantas suelen germinar y crecer después de la siembra debido a la humedad disponible en la superficie. A medida que el suelo se seca y aumenta el consumo de agua de las plantas, las raíces penetran más profundamente buscando agua. A cierta profundidad pueden encontrar mayores niveles de sal en el subsuelo, lo que actúa como barrera para acceder a la humedad. El resultado es retraso en el crecimiento o crecimiento irregular de las plantas, y posiblemente muerte por falta de humedad.
Reclamación de Suelos Afectados por Sal
Los métodos para eliminar sales de suelos superficiales incluyen raspado, lavado superficial y lixiviación. Dado que las sales son altamente solubles, la lixiviación con agua de buena calidad es el método más efectivo y comúnmente utilizado para recuperar suelos salinos. Mientras que los suelos salinos se agregan y tienen altas tasas de infiltración, los suelos sódicos y salino-sódicos suelen estar dispersos y tienen bajas tasas de infiltración. Por lo tanto, es difícil lixiviar las sales y el sodio con agua de suelos sódicos y salino-sódicos ya que normalmente se dispersan. Así, para recuperar suelos sódicos y salino-sódicos, aplicación de enmiendas de suelo como yeso (CaSO 4 . Normalmente se necesita 2H 2 O). El Ca 2+ agregado promueve la agregación del suelo y mejora la infiltración de agua cuando el Na + monovalente es reemplazado por Ca 2+ divalente. El Na + desplazado y el exceso de sales pueden ser entonces lixiviados por riego con agua de buena calidad. Sin embargo, debido a que las sales lixiviadas pueden acumularse en el agua subterránea, el agua de drenaje salino puede desviarse a través de los desagües Otras formas de eliminar sales de suelos afectados por la sal incluyen cultivar cultivos tolerantes a la sal (por ejemplo, cebada, girasol) y plantar árboles que absorban los cationes y aniones disueltos de la solución del suelo. Prevenir la salinización mediante el uso de las mejores prácticas de manejo (por ejemplo, el uso de agua de riego de buena calidad en tierras agrícolas, el manejo del agua por debajo de la zona radicular a través del drenaje subsuperficial) es un mejor enfoque que permitir que la salinidad aumente en los suelos y luego intentar recuperar los suelos afectados por la sal.
REACCIONES DE OXIDACIÓN-REDUCCIÓN (REDOX)
Las reacciones de oxidación-reducción, o reacciones redox, implican la transferencia de electrones y la conversión de un elemento de un estado de valencia a otro. Comprender el comportamiento de los elementos sensibles a la redox en el suelo es fundamental para comprender el comportamiento de los suelos Gleysólicos y Orgánicos, y los subgrupos de suelos redox que ocurren dentro de todos los órdenes de suelo mineral en Canadá (SCWG, 1998). A nivel internacional, alrededor de 130 millones de hectáreas de tierra, que representan alrededor del 10% o la totalidad de la tierra cultivable del planeta, se inundan temporalmente para la producción de arroz generando condiciones de suelo reducidas y enfatizando la importancia de comprender las reacciones redox (IRRI, 1997).
Las reacciones redox se escriben típicamente como medias reacciones (es decir, el electrón y el cambio en el estado de oxidación se establecen explícitamente en la ecuación). La reacción reversible siempre debe escribirse como una reacción de reducción con el electrón (e —) en el lado izquierdo de la ecuación:
oxidantes + e — ↔ reductores
donde los oxidantes son especies químicas capaces de aceptar electrones y los reductores son especies químicas capaces de donar electrones. Por ejemplo:
Fe 3+ + e — ↔ Fe 2+
Las mediciones redox son útiles para proporcionar una comprensión del comportamiento químico en suelos húmedos y mal drenados (por ejemplo, suelos Gleysolic u Orgánicos y subgrupos Gleyed; ver Figura 5.14) ya que un alto potencial redox (>300 mV) indica una buena disponibilidad de O 2 (condiciones aeróbicas), mientras que un bajo potencial (<300 mv) indica disponibilidad limitada de O 2 (condiciones anóxicas).

Los elementos clave sensibles al redox en el suelo incluyen oxígeno (O 2), nitrógeno (NO 3 —, NO 2 —, NO x, N 2 O, N 2), manganeso (Mn 4+, Mn 2+), hierro (Fe 3+, Fe 2+), azufre (SO 4 —, S 2-) y carbono (CO 2, CH 4). Estas son las principales especies comúnmente involucradas en reacciones redox en suelos y constituyen una secuencia de reacción que indica la tendencia de cada elemento a reducirse:
Oxigeno > Nitrógeno > Manganeso > Hierro > Azufre
Típicamente, los elementos de la izquierda de esta secuencia dominan el estado de oxidación predominante de los otros elementos a la derecha de la misma. Por ejemplo, la presencia de oxígeno domina la aceptación de electrones sobre todos los demás elementos de la secuencia y así dicta que cada una de las otras especies debe donar sus electrones y convertirse a su forma oxidada. Así, en presencia de oxígeno (es decir, ambientes oxidantes) las valencias estables de los otros elementos son NO 3 —, Mn 4+, Fe 3+, SO 4 2- y CO 2.
Cuadro 5.5. Semireacciones, potenciales de electrodo estándar (E°), rango típico de Eh en suelos y grupo de microorganismos mediadores para especies redox dominantes en suelo
| Media reacción | E° (milivoltios) | Rango Eh (milivoltios) | Microorganismo |
|---|---|---|---|
| O 2 (aq) + 4 H + + 4 e- ↔ 2 H 2 O | 1230 | 600 a 350 | Aerobes |
| 2 NO 3 - + 12 H + + 10 e- ↔ N 2 (g) + 6 H 2 O | 1240 | 400 a 200 | Desnitrificadores |
| Mn (VI) O 2 (s) + 4 H + + 10 e- ↔ Mn2+ + 2 H 2 O | 1220 | 300 a -50 | Reductores de Mn |
| Fe (III) (OH) 3 (s) + 3 H + + e- ↔ Fe 2+ + 3 H 2 O | 930 | 50 a -50 | Reductores de Fe |
| SO 4 + 9 H + + 8 e- ↔ S2- + 4 H 2 O | 250 | -150 a -200 | Reductores de sulfato |
| CO 2 (aq) + 8 H + + 8 e- ↔ CH 4 (aq) + 2 H 2 O | 170 | -150 a -250 | Fermentadores de metano |
La notación utilizada para identificar especies redox en la fase acuosa (es decir, solución del suelo) es diferente a la utilizada para identificar elementos que ocurren en la fase sólida. Por ejemplo, las especies de hierro en la fase acuosa suelen señalarse como Fe 2+ y Fe 3+, mientras que las especies de hierro presentes en los minerales del suelo y otros sólidos se expresan como Fe (II) y Fe (III).
Generalmente, la descomposición oxidativa (decaimiento) de la materia orgánica es mediada por diversos microorganismos para derivar energía (ver Cuadro 5.5). En consecuencia, la materia orgánica es la fuente primaria de electrones en el suelo. La conversión/descomposición de la materia orgánica varía considerablemente desde la conversión completa a CO 2 (gas) hasta la oxidación parcial e incompleta y la conversión a productos intermedios (es decir, la conversión a humus), pero todas implican la reducción de especies redox a su forma reducida. Debido a que la composición de la materia orgánica del suelo es altamente compleja (ver Capítulo 3) no se le atribuye una fórmula química general (van der Park, 2006).
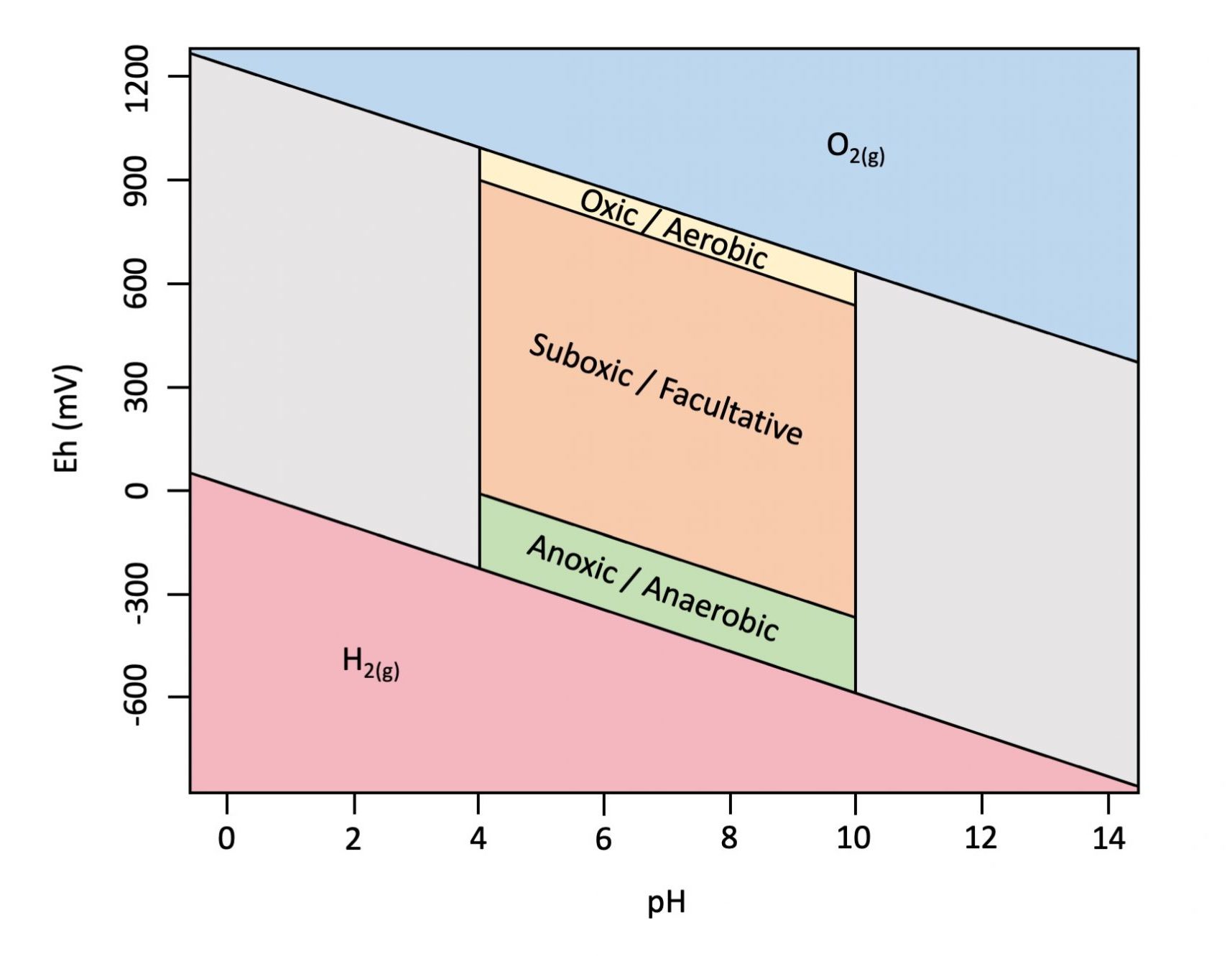
La Figura 5.15 es un ejemplo de un diagrama EH-pH, o diagrama de Pourbaix, una representación gráfica que muestra los rangos aproximados para Eh y pH en suelo. Los valores de pH del suelo generalmente varían de aproximadamente 4 a 10, con Eh limitado en la parte superior e inferior por la estabilidad redox del agua. El Eh varía con el pH según la ecuación de Nernst en -59.16 mV por unidad de pH a 25 ℃ (298.15K). La Figura 5.15 también indica los intervalos aproximados para las condiciones óxicas (la reacción de reducción de O2 es dominante y mediada por organismos aeróbicos); las condiciones subóxicas (las reacciones de reducción de nitrógeno, hierro y manganeso son dominantes y están mediadas principalmente por organismos facultativos); y condiciones anóxicas ( las reacciones de reducción de azufre y carbono son dominantes y mediadas por organismos anaerobios) en el suelo.
Oxígeno
En suelos no saturados (aeróbicos), el oxígeno se presenta tanto en la fase gaseosa del suelo (O 2 g) como en la fase de solución del suelo (acuosa) (O 2 aq). Aunque similar en composición a la de la atmósfera (aproximadamente 20% O 2 en volumen), la concentración de oxígeno en el aire del suelo suele ser algo menor ya que el oxígeno en la fase gaseosa del suelo es consumido constantemente por las raíces de las plantas y la respiración microbiana. Bajo condiciones oxigenadas (no saturadas), el oxígeno se encuentra efectivamente en suministro infinito capaz de aceptar electrones y oxidar completamente el carbono orgánico del suelo a CO 2 (g). La introducción continua de oxígeno a la capa superior del suelo debido a las prácticas de cultivo es la razón principal de la reducción de los niveles de materia orgánica del suelo como resultado de las reacciones de oxidación.
Aunque la concentración de oxígeno en la fase gaseosa del suelo suele ser alta, la concentración de oxígeno disuelto en el agua es mucho menor, siendo generalmente del orden de 10 mg L -1 (a 15 ℃) pero variando con la temperatura. A medida que el oxígeno disuelto se consume, es reabastecido por el charco normalmente abundante de oxígeno en la fase gaseosa del suelo. Aparte de la gran diferencia en la abundancia de oxígeno, la movilidad del oxígeno es aproximadamente 10,000 veces más lenta en el agua en comparación con el oxígeno en la fase gaseosa. En consecuencia, a medida que los suelos se saturan cada vez más de agua, el suministro de oxígeno del aire se vuelve cada vez más limitado hasta que todo, o casi todo, el espacio poroso del suelo se llena de agua, y el transporte de oxígeno solo es posible a través de la fase acuosa El potencial redox disminuye a medida que el suelo se vuelve efectivamente subóxico o incluso anóxico/anaeróbico (ver Figura 5.15).
¡Puedes Cavar!
Suelos estacionalmente anóxicos durante inundaciones de deshielo primaverales

La mayoría de las tierras agrícolas en las praderas canadienses se inundan durante el período de deshielo de primavera. Las inundaciones estacionales pueden hacer que el suelo sea subóxico o anóxico a medida que disminuye el potencial redox. Esto tendrá muchos impactos ambientales. Por ejemplo, la concentración de fósforo en el agua de inundación puede aumentar cuando el Fe (III) y el Mn (IV) se reducen a formas divalentes liberando el fosfato asociado con ellos. El fósforo liberado puede terminar en lagos causando floraciones de algas. Las condiciones anóxicas también pueden mejorar las emisiones de gases de efecto invernadero como el óxido nitroso (N 2 O) y el metano (CH 4).
Nitrógeno
La razón principal del agotamiento del oxígeno disponible del suelo es la saturación con agua. Como se discutió anteriormente, la cantidad de oxígeno disuelto en el agua del suelo es muy limitante y la difusión del oxígeno a través del agua es muy lenta. A medida que el oxígeno se vuelve limitante/agotado, típicamente bajo condiciones saturadas temporales, los microbios reductores de nitratos se vuelven activos iniciando el proceso de desnitrificación. El proceso de desnitrificación es una vía importante para la pérdida de nitrógeno fertilizante aplicado como fuente nutritiva para los cultivos. El nitrato (NO 3 —) se reduce a gas nitrógeno (N 2) con nitrito (NO 2 —), óxido nítrico (NO) y óxido nitroso (N 2 O) como especies intermedias. El nitrito soluble es un intermedio acuoso de corta duración, mientras que los intermedios de óxido nítrico (NO) y óxido nitroso (N 2 O) están involucrados en la destrucción de la capa de ozono estratosférico (O 3). El óxido nitroso también es un importante gas de efecto invernadero con un potencial de calentamiento global (GWP) 265-298 veces mayor que el del dióxido de carbono.
Manganeso
A medida que el nitrato se agota, las bacterias reductoras de manganeso toman el control Aunque el contenido total de manganeso en el suelo es típicamente de solo 750 a 1000 mg kg -1 (Ure y Berrow, 1982; Bowen, 1979), sigue siendo una especie redox importante en el suelo. El manganeso existe en el suelo principalmente como Mn 2+, o como Mn (VI). La forma soluble prevalente en el suelo anóxico es Mn 2+ (aq), que cuando se introduce oxígeno oxida y precipita manganeso como Mn (IV), generalmente como oxihidróxidos no cristalinos (amorfos). Los óxidos de manganeso aparecen como recubrimientos negros en partículas del suelo, o como nódulos negros, algunos de tan grandes como 2 cm de diámetro. Cuando están presentes, los sólidos de manganeso actúan como depuradores de aniones nutritivos (p. ej., fosfato).
Hierro
El hierro es el cuarto elemento más abundante en el suelo y es responsable de diversos moteados caracterizados por las drásticas diferencias de coloración entre valencias reducidas (Fe 2+) y oxidadas (Fe 3+) en suelos húmedos y anegados. Los suelos fuertemente reducidos con valores de Eh en el rango de -200 mV suelen tener color brilloso (gris opaco o prácticamente blanco) debido a la presencia de hierro reducido. Esta condición reducida del suelo significa que el oxígeno disuelto, así como el nitrato y el manganeso están esencialmente ausentes y que la mayor parte del hierro disuelto está presente como la especie Fe 2+, y la mayoría de los compuestos de hierro (responsables del color gris) aparecen como óxidos e hidróxidos de Fe (II) (por ejemplo, hidróxido ferroso [ Fe (OH) 2]. Cuando el nivel freático baja o el agua oxigenada se infiltra en un suelo reducido (quizás a través de un canal radicular, poro abierto o fractura), el hierro ferroso transfiere electrones al oxígeno dando como resultado la formación de compuestos oxidados [Fe (III)]. Estos se observan como moteas que ocurren como manchas rojizas sobre un fondo gris opaco. Los moteados son una característica morfológica muy común en los subgrupos Gleyed o suelos Gleysólicos que se encuentran periódicamente húmedos o tienen un nivel freático fluctuante. Los moteados son características diagnósticas en la identificación de suelos moderadamente bien, imperfectamente y mal drenados.
Azufre
Aunque existen varios estados de oxidación para el azufre, solo dos estados de oxidación son prevalentes en el suelo. En condiciones aerobias el sulfato (SO 4 2-) es la forma estable con un estado de oxidación de +6, mientras que el sulfuro (S 2-) con un estado de oxidación de -2 es la forma estable en condiciones fuertemente reductoras (McBride, 1994). El sulfato es la forma primaria de azufre absorbida por las plantas, precipitándose principalmente como el yeso mineral (CaSO 4 •2H 2 O) cuando hay suficiente calcio disuelto (Ca 2+) presente en la solución del suelo. El sulfato se puede reducir a sulfuro que tiene muy baja solubilidad en agua bajo condiciones anóxicas formando gas sulfuro de hidrógeno odoroso (H 2 S con aroma a huevos podridos), o sulfuros metálicos insolubles como FeS 2 si hay metales solubles presentes.
La introducción de oxígeno en suelos que contienen sulfuro da como resultado la re-oxidación de sulfuros metálicos:
FeS + 15/4 O 2 + 7/2 H 2 O ↔ Fe (OH) 2 + 4H + + 2 SO 4 2-
Esta reacción es común en suelos costeros recuperados con alto contenido de sulfuros, en suelos de las praderas septentrionales derivados de lutitas que contienen sulfuro (denominados suelos de sulfato ácido) y en desechos de minas (relaves y roca de desecho) que contienen pirita y otros sulfuros metálicos.
Carbono
Finalmente, si el sulfato es limitado, entonces las bacterias productoras de metano continúan el proceso de descomposición de la materia orgánica en condiciones anaeróbicas de la siguiente manera
2CH 2 O ↔ CO 2 + CH 4
La producción de metano generalmente ocurre en condiciones estancadas y saturadas de agua en los humedales. En estas condiciones el proceso de descomposición orgánica es lento e incompleto, resultando en la acumulación de materia orgánica del suelo y la formación de turberas y suelos orgánicos.
Medición de Redox
La medición directa del potencial redox (oxidación-reducción) en el suelo es un dilema. Fundamentalmente, la medición redox es extremadamente simple, siendo similar a la medición del pH en mecánica, pero muy diferente del pH con respecto a la química fundamental y la interpretación. Las mediciones redox o medir la “concentración de electrones” no son análogas al pH porque los electrones libres no existen en las soluciones del suelo de la misma manera que los iones de hidrógeno (H +). El redox se mide típicamente como un voltaje (generalmente reportado como voltios o milivoltios), lo que representa una medida del potencial para que los electrones se transfieran de un elemento a otro. Esta medida de potencial proporciona una indicación de qué especies redox son las más receptivas a la ganancia de electrones en el momento de la medición. Los tiempos reales para la transferencia de electrones suelen ser mucho más lentos que el tiempo requerido para completar una medición redox, con reacciones mediadas por organismos biológicos específicos como se discutió anteriormente. Por lo tanto, la medición redox indica la tendencia o probabilidad de que ocurra una reacción redox, mientras que la reacción en sí misma puede no ocurrir realmente en ningún grado significativo ya que la condición redox medida puede ser solo temporal.
Independientemente de las dificultades con la medición, las mediciones redox proporcionan datos críticos para la descripción y análisis de suelos húmedos o estacionalmente saturados. Las mediciones son en realidad registros de voltaje (Eh) entre un electrodo de referencia y un electrodo sensor insertado en un suelo. Los electrodos sensores más comunes suelen estar construidos de alambre de platino (electrodo Pt). El voltaje resulta de un intercambio de electrones entre un par redox como hierro ferroso (Fe 2+) y férrico (Fe 3+) durante el proceso de reducción y oxidación. En suelos que tienen condiciones húmedas y secas fluctuantes, se producen amplias fluctuaciones estacionales en los valores de Eh (Fiedler et al., 2007).
Aunque los electrones libres no existen en el suelo, el concepto de electrones libres, análogo a describir la actividad de protones libres y los valores de pH, es útil como primer paso para describir y comprender el estado redox del suelo. Similar al pH, la “actividad electrónica” puede expresarse como pe (análogo al pH) que es el logaritmo común negativo de la actividad electrónica:
(5)
Los valores para pe no se miden directamente, sino que se derivan de Eh a través de la ecuación de Nernst:
(6)
donde E o es el potencial electrónico estándar para la semirreacción, R es la constante molar de gas (8.31 julios/mole/K), T es la temperatura absoluta (298.15 K); F es la constante de Faraday (96.490 culombes/mol) y n es el número de electrones transferidos en la media reacción.
Aunque la medición de Eh usando un electrodo de platino es un procedimiento sencillo, también está sujeta a incertidumbre de medición. Los temas principales (Sposito, 1989) incluyen:
- la medición de voltaje en el suelo generalmente se debe a más de la mitad de la reacción;
- las concentraciones de especies redox en solución pueden ser demasiado pequeñas para proporcionar transferencia de electrones detectable por el electrodo de Pt;
- varias especies redox no son fácilmente reactivas;
- Los electrodos de Pt son fácilmente contaminados o “envenenados” por óxidos u otros recubrimientos; y
- el contenido de sal de la solución del suelo (y su capacidad para conducir electrones) puede diferir mucho del tampón de calibración.
Estas incertidumbres significan que las mediciones de Eh se consideran medidas cualitativas que proporcionan una indicación general del estado redox del suelo suficiente para diferenciar ambientes óxicos, suboxicos y anóxicos (Figura 5.14). Los datos de Eh no deben usarse para cuantificar numéricamente las concentraciones de especies redox, sino que pueden usarse para determinar qué parejas redox son más activas en el momento de la medición. Las mediciones cuantitativas para especies redox deben implicar la medición directa de las especies de interés; por ejemplo, la medición de oxígeno disuelto o electrodo específico de iones, o técnicas de múltiples especies como la cromatografía iónica.
RESUMEN
- La química del suelo implica el estudio de la composición química, las propiedades químicas y las reacciones químicas que involucran sólidos del suelo (materia orgánica y minerales inorgánicos), líquidos (agua del suelo), gases (aire del suelo), incluyendo interacciones con plantas y organismos del suelo. Las propiedades químicas del suelo tienen enormes implicaciones para la salud humana y ambiental global. A través de la influencia en el destino de los nutrientes y contaminantes, las propiedades químicas del suelo juegan un papel en la producción de cultivos y la seguridad alimentaria, la biodiversidad, la contaminación del agua y el aire, el cambio climático global a través de las emisiones de gases de efecto invernadero, etc. El conocimiento de la química del suelo es fundamental nutrientes y contaminantes en el sistema del suelo, prediciendo su impacto ambiental y encontrando soluciones para mitigar impactos.
- Las propiedades químicas del suelo están influenciadas en gran medida por el tipo y cantidad de minerales inorgánicos presentes en el suelo y el contenido de materia orgánica (humus). Los coloides inorgánicos incluyen principalmente filosilicatos (minerales de silicato de capa), aluminosilicatos amorfos y minerales oxihidróxido.
- La presencia de cargas superficiales tanto en minerales inorgánicos como en partículas de humus es responsable de la adsorción e intercambio de iones en los suelos. La mayoría de las cargas son permanentes (no dependientes del pH del suelo) y negativas, mientras que otras varían con el pH y pueden ser negativas o positivas.
- Las cargas negativas en las partículas del suelo pueden atraer y adsorber cationes, que pueden ser liberados de nuevo a la solución del suelo a través del intercambio iónico. La capacidad de intercambio catiónico, definida como la suma de cationes intercambiables totales que un suelo puede adsorber, es una propiedad química importante del suelo que influye en la retención de nutrientes catiónicos de las plantas que apoyan el crecimiento de las plantas y la retención de contaminantes catiónicos minimizando la contaminación del agua subterránea.
- El pH del suelo es una medida de acidez y alcalinidad, que controla muchos de los procesos químicos que tienen lugar en el suelo, incluida la disponibilidad de nutrientes de las plantas. El factor principal que influye en el pH natural del suelo es el material geológico progenitor del que se derivan los suelos. El encalado es una práctica comúnmente utilizada para elevar el pH de los suelos ácidos.
- La salinidad del suelo da una indicación del contenido de sal del suelo y se determina midiendo la conductividad eléctrica de un extracto de pasta de suelo saturado. Dependiendo de la conductividad eléctrica y la concentración relativa de sodio en solución de suelo o complejo intercambiable, los suelos afectados por la sal se clasifican como suelos salinos, salino-sódicos y sódicos. El riego con aguas salinas, particularmente en climas áridos, es una de las principales causas antropogénicas de salinidad. El exceso de salinidad en el suelo puede disminuir el agua disponible de las plantas y afectar el crecimiento de la
- Las reacciones de oxidación-reducción (redox) en el suelo implican la conversión de un elemento de un estado de valencia a otro. Los elementos clave sensibles al redox en el suelo incluyen oxígeno (O 2), nitrógeno (NO 3 —, NO 2 —, NO x, N 2 O, N 2), manganeso (Mn 4+, Mn 2+), hierro (Fe 3+, Fe 2+), azufre (SO 4 2-, S 2-) y carbono (CO 2, CH 4). Las reacciones redox influyen en la dinámica de ciertos nutrientes vegetales (p. ej., nitrógeno, azufre, hierro, manganeso) y las pérdidas gaseosas de los suelos, incluidas las emisiones de gases de efecto invernadero (óxido nitroso y metano).
PREGUNTAS DE ESTUDIO
- Explica por qué la montmorillonita tiene una mayor capacidad de encogimiento-hinchamiento que la caolinita.
- Definir la sustitución isomorfa. Explique brevemente cómo la sustitución isomorfa provoca el desarrollo de carga negativa en las superficies minerales arcillosas.
- Explica por qué los Vertisoles en Canadá suelen ser muy pegajosos cuando están mojados y forman grietas anchas cuando están secos.
- Definir la capacidad de intercambio catiónico. ¿Por qué es importante la capacidad de intercambio catiónico del suelo para proteger y mejorar la biodiversidad y la salud del ecosistema
- Considere la estructura y propiedades de los filosilicatos resumidos en la Figura 5.5 y responda las siguientes preguntas Verdadero/Falso.
- La presencia de enlaces de hidrógeno entre capas hace que la caolinita sea un mineral de arcilla relativamente no expandible. Verdadero o Falso
- Los minerales arcillosos tipo 2:1 están compuestos por una lámina tetraédrica intercalada entre dos láminas octaédricas.Verdadero o Falso
- No hay enlaces de hidrógeno entre capas en minerales arcillosos tipo 2:1 ya que los grupos hidroxilo no están expuestos.Verdadero o Falso
- La montmorillonita y la ilita (mica hidratada) son filosilicatos de tipo 2:1. La montmorillonita se expande libremente mientras que la illita tiene una capacidad de expansión limitada.Verdadero o Falso
- La ilita (mica hidratada) tiene una carga de capa alta debido a la sustitución isomorfa pero su capacidad de intercambio catiónico es relativamente baja.Verdadero o Falso
- Un suelo con una capacidad de intercambio catiónico de 42 cmol (+) kg -1 tiene los siguientes cationes en el complejo de intercambio: Na + = 7 cmol (+) kg -1 suelo, Ca 2+ = 12 cmol (+) kg -1 suelo, K + = 6 cmol (+) kg -1 suelo, y Mg 2 + = 8 cmol (+) kg -1 suelo). Calcular la saturación base de este suelo.
- Explicar cómo un cambio en el pH del suelo influye en las capacidades de intercambio catiónico y aniónico de los suelos.
- Diferenciar entre acidez activa y de reserva.
- “El pH del suelo está muy influenciado por el material parental a partir del cual se forma el suelo”. Explique la declaración dando ejemplos de materiales para padres en Canadá para respaldar su respuesta.
- Explique brevemente cómo los coloides del suelo amortiguan los cambios de pH del suelo causados por insumos ácidos o básicos, como fertilizantes que contienen nitrógeno y enmiendas de encalado.
- Explicar brevemente cómo el pH del suelo influye en la disponibilidad de nutrientes para las plantas
- Definir suelos salinos, sódicos y salino-sódicos. Describir sus principales características y efectos sobre la salud de los ecosistemas.
- Explicar brevemente cómo el riego bajo climas áridos puede influir en el desarrollo de la salinidad del suelo.
- Un suelo con una capacidad de intercambio catiónico de 20 cmol (+) kg -1 tiene un contenido de Na intercambiable de 8 cmol (+) kg -1.
- Calcular el porcentaje de sodio intercambiable (ESP) del suelo.
- Si la conductividad eléctrica del extracto saturado de este suelo es 5.6 dS m -1 (decisiemens por metro), ¿cómo clasificaría el suelo? (Pista: Ver Figura 5.11)
- ¿Cómo se puede recuperar tal suelo?
- Identificar los elementos clave sensibles al redox en el suelo. Dar una forma oxidada y una forma reducida para cada uno de estos elementos.
- Describir cómo el estado redox del suelo influye en la disponibilidad de nutrientes y las emisiones de gases de efecto invernadero (óxido nitroso y metano).
Ejemplos trabajados
Describir los diferentes mecanismos por los cuales se desarrollan cargas negativas en las superficies de los coloides del suelo.
Dos mecanismos principales son los encargados del desarrollo de cargas negativas a las superficies de los coloides del suelo. Una es la sustitución isomorfa en minerales filosilicatos donde el catión central en la lámina octaédrica o tetraédrica en el mineral es sustituido por otros cationes. La sustitución ocurre con iones de tamaños similares y se desarrolla una carga negativa cuando se reemplaza un catión de valencia superior por un catión de valencia inferior. Por ejemplo, si el Si 4+ en la lámina tetraédrica es reemplazado por Al 3+ (como en illita o mica hidratada), dará lugar a una carga negativa superficial. De igual manera, en la lámina octaédrica, el Al 3+ puede ser sustituido por Mg 2+ lo que crea una carga negativa sobre el mineral. Las cargas negativas por sustitución isomorfa son permanentes y no dependen del pH.
El segundo mecanismo de desarrollo de cargas negativas sobre los coloides del suelo son las reacciones de desprotonación (disociación) dependiendo del pH. Las arcillas oxihidróxido y los bordes de las arcillas filosilicatos y silicatos amorfos tienen grupos hidroxilo que pueden disociarse a pH alto desarrollando una carga negativa en la superficie. Los coloides orgánicos (humus) también pueden portar cargas negativas dependientes del pH debido a la disociación de grupos funcionales como los grupos carboxilo y fenólico. Estas cargas aumentan al aumentar el pH.
Explicar por qué el mineral arcilloso montmorillonita tiene una CEC mayor que la caolinita (pista: ver Figura 5.2)
La montmorillonita es un mineral de arcilla filosilicato 2:1 con 2 láminas tetraédricas de silicio que encierran una lámina octaédrica de aluminio. La sustitución isomórfica, por ejemplo de magnesio (Mg 2+) por parte del aluminio (Al 3+) en la lámina octaédrica da como resultado una carga negativa permanente. Además, las arcillas montmorillonitas se expanden cuando se humedecen, ya que el agua ingresa al espacio entre capas entre láminas tetraédricas adyacentes. Esto aumenta la superficie disponible para la adsorción de cationes, ya que en la montmorillonita tiene superficies externas e internas disponibles para la adsorción de cationes. La combinación de carga negativa neta debida a la sustitución isomórfica y alta superficie específica le da a la montmorillonita una CEC alta.
La caolinita, por otro lado, es un mineral de arcilla de filosilicato 1:1, que consiste en láminas tetraédricas de silicio simples alternadas con láminas octaédricas de aluminio simples. Hay una sustitución isomórfica muy limitada, por lo que la caolinita tiene un número limitado de cargas negativas. Adicionalmente, al ser un mineral de arcilla filosilicato 1:1, que no se expande, la caolinita tiene menor área de superficie efectiva sobre la cual se pueden adsorber cationes. Así la caolinita tiene una CEC inferior.
Rellene las características de los filosilicatos en la siguiente tabla.
| Mineral | Tipo | Sustitución isomorfa | CCA | Superficie | Expansibilidad |
|---|---|---|---|---|---|
| (1:1, 2:1, 2:1:1) | (Bajo/Alto) | (Bajo/Alto) | (Bajo/Alto) | (Bajo/Alto) | |
| Caolinita | 1:1 | Bajo | Bajo | Bajo | Bajo |
| Montmorillonitee | 2:1 | Alto | Alto | Alto | Alto |
| Illita (hidruros mica) | 2:1 | Alto | Bajo | Bajo | Bajo |
| Clorita | 2:1:1 | Alto | Bajo | Bajo | Bajo |
Calcular la CEC del suelo
Un suelo tiene 3% de materia orgánica, 20% de montmorillonita y 17% de caolinita, siendo el 60% restante granos minerales primarios de arena y limo. Calcular la capacidad de intercambio catiónico del suelo en cmol (+) kg -1 (Nota: asumir la capacidad de intercambio catiónico de la materia orgánica = 200 cmol (+) kg -1, montmorillonita = 100 cmol (+) kg -1 y caolinitie = 10 cmol (+) kg -1).
CEC del suelo = [0.03 x 200 cmol (+) kg -1] + [0.20 x 100 cmol (+) kg -1] + [0.17 x 10 cmol (+) kg -1] = 27.7 cmol (+) kg -1
Identificar cuatro factores principales que contribuyen a la acidez del suelo y explicar brevemente su contribución.
Los principales factores que contribuyen a la acidez del suelo son el material parental ácido, las altas precipitaciones, la aplicación de fertilizantes amónicos y la descomposición de la materia orgánica. Los suelos derivados de materiales parentales a base de granito, comúnmente denominados materiales parentales ácidos, son generalmente ácidos en la reacción. La acidez natural de las precipitaciones, debido al dióxido de carbono disuelto, es una causa de acidez del suelo. En zonas de alta precipitación se lixivian cationes básicos en los suelos, aumentando la acidez. La aplicación de fertilizantes amónicos también puede contribuir a la acidez debido a la nitrificación de los protones de liberación de amonio. La descomposición de la materia orgánica libera ácidos orgánicos que contribuyen a la acidez del suelo.
Nombrar dos causas naturales y dos antropogénicas de salinidad del suelo y describir brevemente cómo contribuyen al desarrollo de la salinidad.
Dos causas naturales de salinidad del suelo son las condiciones climáticas secas y el mal drenaje. Las sales solubles se acumulan bajo condiciones climáticas secas donde la lluvia no es suficiente para lixiviar las sales a través del perfil del suelo. Las altas pérdidas por evaporación de los suelos pueden traer las sales de capas más profundas del suelo con el movimiento ascendente del agua, que permanecen en la superficie del suelo.
Bajo malas condiciones de drenaje (debido a la alta capa freática o baja permeabilidad del subsuelo), las sales no se eliminan por drenaje y lixiviación, lo que dará como resultado la acumulación de sales en la superficie cuando el agua se evapore del suelo.
Dos causas antropogénicas de salinidad son el riego con aguas salinas, particularmente en regiones secas, y el uso excesivo de fertilizantes. El agua de riego se moverá hacia abajo y disolverá más sales. Cuando la evaporación es alta bajo un clima seco el agua que se mueve hacia arriba traerá sales disueltas. El agua se evaporará dejando las sales en la superficie. Los fertilizantes (que son sales que contienen diferentes nutrientes) pueden aumentar el contenido de sal de los suelos si se usan de manera inapropiada.
Considere los siguientes datos para cuatro suelos minerales que tienen una textura franco arcillosa:
| Propiedad del Suelo | Suelo #1 | Suelo #2 | Suelo #3 | Suelo #4 |
|---|---|---|---|---|
| pH | 8.8 | 8.1 | 7.5 | 7.6 |
| conductividad eléctrica (ds/m) | 2.7 | 12.2 | 1 | 4.3 |
| saturación base (%) | 90 | 90 | 60 | 86 |
| capacidad de intercambio catiónico | 12 | 11 | 19 | 9 |
| (cmolc/kg) | ||||
| sodio intercambiable (%) o ESP | 17.3 | 16.8 | 2.1 | 2.5 |
| Clasificación de salinidad | Sódico | Salina-sódica | No salino | Salino |
A) Determinar la clasificación de salinidad (es decir, salina, sódica, salina-sódica o no salina) para cada uno de estos 4 suelos. [Pista: ver Figura 5.12]
B) ¿Cuál de los suelos anteriores probablemente estaría en estado disperso? Explique brevemente su respuesta con base en la información proporcionada.
El suelo #1 es muy probable que esté en estado disperso ya que tiene un alto ESP de 17.3% mientras que la concentración de sal es baja (con EC de 2.7 dS m -1).
C) ¿Cuáles son las implicaciones de un suelo disperso para el crecimiento de las plantas?
Dado que las partículas individuales del suelo están en estado disperso, no hay floculación y consecuentemente no hay formación de agregados. La consecuencia de esto es que el suelo tendrá unidades estructurales agregadas de suelo poco desarrolladas y estará dominado por microporos, que impiden el movimiento de aire y agua y también impiden el crecimiento de las raíces. Así, el crecimiento de las plantas se verá afectado.
Identificar las formas comunes oxidadas y reducidas de los siguientes elementos en suelos: manganeso, hierro, azufre y nitrógeno.
- manganeso: Mn 4+, Mn 2+ (reducido)
- hierro: Fe 3 +, Fe 2+
- azufre: SO 4 2-, S 2-
- nitrógeno: NO 3 —, NO 2 —, NO x, N 2 O, N 2
REFERENCIAS
Acton D.F., y Gregorich L.J. 1995. La salud de nuestros suelos: hacia la agricultura sustentable en Canadá. Agricultura Agroalimentaria Canadá, Unidad CDR, Ottawa.
Bowen H.J.M. 1979. Química ambiental de los elementos. Academic Press, Londres, Nueva York.
Brady N.C. y Weil, R.R. 2010. La naturaleza y las propiedades de los suelos 13a Ed. Educación Pearson.
Canadá Departamento de Agricultura; Rama de Investigación 1976. Glosario de Términos en Ciencia del Suelo, Publicación 1459.
Eilers W., MacKay R., Graham L. y Lefebvre A. (eds.). 2010. Sustentabilidad ambiental de la agricultura canadiense: serie de informes de indicadores agroambientales — Informe #3. Agricultura y Agroalimentación Canadá, Ottawa, Ontario.
FAO 2020. Organización de las Naciones Unidas para la Alimentación y la Agricultura. Portal de Suelos de la FAO. http://www.fao.org/soils-portal/en/
Fiedler S., Vepraskas M.J., y Richardson J.L. 2007. Potencial redox del suelo: Importancia, mediciones de campo y observaciones. Avances en Agronomía 94:1-54.
Havlin J.L., Tisdale S.L, Nelson W.L., y Beaton J.D. 2013. Fertilidad del Suelo y Fertilizantes: Una Introducción al Manejo Nutricional, 8a ed. Upper Saddle River, NJ: Prentice Hall.
Hendershot W.H., Lalande H., y Duquette M. 2008. Reacción del Suelo y Acidez Cambiable. Páginas 173-178 EN Carter, M.R. y Gregorich, E.G. (eds.) Muestreo de Suelos y Métodos de Análisis. 2ª Edición. Sociedad Canadiense de Ciencias del Suelo. Prensa CRC, Baton Rouge.
Hendershot W.H., Lalande H., y Duquette M. 1993. Reacción del Suelo y Acidez Cambiable. Pág. 167-176 en Carter M.R. (ed.) Muestreo de Suelos y Métodos de Análisis. 1a Edición. Sociedad Canadiense de Ciencias del Suelo. Prensa CRC, Baton Rouge.
Instituto Internacional de Investigaciones sobre el Arroz (IRRI). 1997. Almanaque de Arroz, 2ª Ed. Instituto Internacional de Investigación del Arroz, Manila.
McKenzie R.H. y Woods S.A. 2010. Manejo de suelos sódicos en Alberta, Agdex 518-20, Alberta Agriculture. https://www1.agric.gov.ab.ca/$depart...18-20.pdf? Elemento Abierto
McBride M.B. 1994. Química Ambiental de Suelos. Prensa de la Universidad de Oxford. Nueva York. 406pp.
Miller J.J. y Brierley J.A. 2011. Suelos solonetzicos de Canadá: Génesis, distribución y clasificación. Can. J. Suelo Sci. 91 (5) :889-902.
Munroe J. (ed.) 2018. Manual de Fertilidad del Suelo Publicación 611 3ª edición, Ontario Ministerio de Agricultura, Alimentación y Asuntos Rurales. 236pp.
Newman A.C. y Hayes M.H. 1990. Algunas propiedades de las arcillas y de otros coloides del suelo y sus influencias en los suelos. En: De Boodt M.F, M.H. Hayes, A. Herbillon (Eds). Coloides del suelo y sus asociaciones en agregados. Springer Science & Medios de comunicación de negocios; Bostón. MA, EUA. pp. 39-55.
Qadir M., Quillérou E., Nangia V., Murtaza G., Singh M., Thomas R.J., Drechsel P., y Noble A.D. 2014. Economía de la degradación y restauración del suelo inducida por la sal. En: Foro de Recursos Naturales 38 (4) :282-295.
Shreeja D. (n.d.) Fijación de Fosfato en Suelo: 3. Reacciones de Fijación de aniones Disponible en https://www.soilmanagementindia.com/... -fijación/2252
Chispas D.L. 2003. Química Ambiental de Suelos. Academic Press, Londres, Reino Unido.
Chispas D.L. 2019. Fundamentos de la Química del Suelo. Enciclopedia del Agua: Ciencia, Tecnología y Sociedad, pp 1-11.
Sposito G. 1989. La Química de los Suelos. Prensa de la Universidad de Oxford. Nueva York. 277pp.
Grupo de Trabajo de Clasificación de Suelos (SCWG), 1998. El Sistema Canadiense de Clasificación de Suelos. 3a Edición, Rama de Investigación Agricultura y Agroalimentación Canadá, Publicación 1646.
Personal de Encuesta de Suelos. 2014. Kellogg Manual de Métodos de Laboratorio de Levantamiento de Suelos. Informe de Investigaciones de Levantamiento de Suelos No. 42, Versión 5.0. R. Burt y Personal de Encuesta de Suelos (ed.). Departamento de Agricultura de Estados Unidos, Servicio de Conservación de Recursos Naturales. 1001pp.
Ure A.M., y Berrow M.L. 1982. Los Constituyentes Elementales en Suelos. Páginas 94-204 EN Bowen, H.J.M. (ed.). Química Ambiental. Volumen 2. Real Soc. Chem. Londres.
Van der Perk M. 2006. Contaminación de Suelo y Agua de Escala Molecular a Captación. Taylor y Francis, Londres 389pp.
Zheng T. 2014. Análisis Numérico de Conceptos de Modelado para la Precipitación Salina y Evolución de la Porosidad-Permeabilidad durante la Tesis doctoral, Universität Stuttgart, Alemania.
Acerca de los Autores
Darshani Kumaragamage, Profesor, Departamento de Estudios y Ciencias Ambientales, Universidad de Winnipeg, Manitoba, Canadá.

Obtuve una licenciatura y un MPhil en Agricultura de la Universidad de Peradeniya, Sri Lanka, y un doctorado en Ciencias del Suelo de la Universidad de Manitoba, Canadá, especializándome en química física del suelo. Tengo más de 30 años de experiencia docente a nivel universitario y he impartido una variedad de cursos en Ciencias del Suelo, incluyendo Introducción a la Ciencia del Suelo, Química del Suelo y Fertilidad del Suelo, así como cursos en Ciencias Ambientales. Mis intereses de investigación incluyen evaluar, monitorear y mitigar los impactos ambientales de fertilizantes y estiércol animal, con especial énfasis en las transformaciones de fósforo y la movilidad en suelos bajo diferentes escenarios climáticos y de manejo. He sido autor o coautor de 65 publicaciones de revistas revisadas por pares.
Mi recuerdo favorito de trabajar con suelo fue cuando realicé una investigación de campo en Manitoba sobre un suelo arcilloso, chernocémico y muy pegajoso en un día lluvioso. Tuve que tomar muestras de suelo de muchas parcelas, y al entrar al campo, alrededor de un kilo de tierra se me pegó en las botas. Con el siguiente paso, casi se duplicó, y con cada paso que daba, mis botas se volvieron cada vez más pesadas hasta que literalmente tuve que arrastrar los pies para ir de una parcela a otra.
C. James (Jim) Warren, Ph.D. P.Geo., Especialista en Recursos de Tierras, Ministerio de Agricultura de Ontario, Alimentación y Asuntos Rurales, Guelph, Ontario, Canadá.

Soy P.Geo. y científico ambiental del suelo con una formación diversa en investigación, consultoría y docencia. Soy egresado tanto de la Universidad de Guelph (B.Sc. (Agr), Ciencias del Suelo), y la Universidad de Alberta (M.Sc. Ciencias del Suelo; Ph.D. Química de Suelos). Realicé investigaciones en agronomía, geoquímica y mineralogía en la Universidad de Guelph y la Universidad de Waterloo antes de convertirme en consultora privada en drenaje de minas ácidas. Actualmente estoy empleado como Especialista en Recursos de Tierras realizando trabajos de levantamiento de suelos y pedología con el Ministerio de Agricultura de Ontario, Alimentación y Asuntos Rurales, y también soy Profesor Adjunto de la Universidad de Guelph. He impartido cursos de ciencias del suelo, mineralogía del suelo, química del suelo, geoquímica y pedología como profesor de sesión en cuatro universidades (Alberta, Guelph, Waterloo y Toronto). He sido autor o coautor de más de 100 publicaciones en revistas arbitradas; capítulos de libros, actas de conferencias e informes.
¿Cómo me interesaron los suelos? Bueno, crecí en una granja donde, cuando era adolescente, pasaba mucho tiempo en un tractor haciendo operaciones de labranza y tenía mucho tiempo para pensar. Una de las preguntas que me hice durante largos días en el campo fue: “¿Qué hace que las plantas crezcan?” Con eso pasé las siguientes décadas tratando de entender los suelos para responder a esa pregunta. La búsqueda continúa.
Graeme Spiers, Cátedra de Monitoreo Ambiental y Profesor, Escuela del Medio Ambiente, Departamento de Ciencias de la Tierra/Departamento de Biología, Laurentian University, Sudbury, Ontario, Canadá.

Enseño en la Escuela del Medio Ambiente, el Departamento de Ciencias de la Tierra y el Departamento de Biología, Universidad Laurentian. Obtuve una licenciatura en Ciencias de la Tierra y Botánica en la Universidad de Waikato en Nueva Zelanda, y M.Sc. y Ph.D. de la Universidad de Alberta, especializándome en Pedología, Mineralogía de Arcilla y Química. Con experiencia en laboratorio comercial y consultoría en Canadá, me he asociado con programas de investigación en las Universidades de Alberta, Guelph, Waterloo, Laurentian y New Brunswick. Mi investigación ha resultado en numerosas publicaciones técnicas y científicas y presentaciones en química analítica, química acuática, geología ambiental, ecología, biología vegetal y ciencia del suelo. Antes de asistir a la universidad a tiempo completo, fui agricultor lechero de Nueva Zelanda durante 10 años, obteniendo mi licenciatura como pasatiempo a largo plazo entre ordeños. En Sudbury, estoy involucrado en iniciativas de investigación que examinan los efectos de las emisiones antropogénicas históricas y actuales de metales en suelos, ríos y lagos, así como la vegetación dentro de la Huella de Fundición de Sudbury. Estoy activamente involucrado en una variedad de programas de investigación en todo Canadá, y colaboro activamente con investigadores en Rusia (Universidad Estatal de Moscú y la Academia Rusa de Ciencias), Australia, Nueva Zelanda, China, Perú y Sudáfrica.


