7.1: Introducción
- Page ID
- 89182
La química del suelo es la rama de la ciencia del suelo que se ocupa de la composición química, las propiedades químicas y las reacciones químicas en el suelo. El ambiente del suelo es dinámico y está compuesto por una mezcla heterogénea de aire, agua y sólidos inorgánicos y orgánicos. La química del suelo se refiere principalmente a las reacciones químicas asociadas con las muchas fases incorporadas dentro de la mezcla del suelo. La química del suelo es un campo en constante expansión que tradicionalmente se centró en las reacciones químicas que afectaron el crecimiento y la nutrición de las plantas, y desde entonces se ha expandido para incluir el agua y los contaminantes del suelo y sus efectos en plantas, animales y humanos.
El suelo está formado por ensamblajes inorgánicos y orgánicos, en forma de sólidos, líquidos y gases. El contenido elemental varía entre los tipos de suelo, sin embargo, los elementos encontrados en las mayores cantidades son típicamente O, Si, Al, Fe, C, Ca, K, Na y Mg (en orden de mayor a menor abundancia natural). Los componentes inorgánicos del suelo componen aproximadamente el 90% de todos los componentes sólidos, sin embargo, la materia orgánica del suelo (SOM) aún juega un papel crítico en las reacciones químicas dentro del suelo. Además, propiedades como el tamaño, la superficie y el comportamiento de carga afectan la mayoría de las reacciones y procesos cinéticos esenciales de equilibrio y los procesos que ocurren en los suelos (Figura 1).
En este laboratorio cubriremos importantes reacciones químicas en el suelo, las propiedades que afectan las reacciones químicas en el suelo y cómo medir propiedades químicas específicas en los suelos.
COLOIDES DEL SUELO
Las partículas coloidales extremadamente pequeñas (menores de 0.002 mm) de arcilla y humus controlan muchas propiedades químicas y físicas importantes del suelo. Esta porción del suelo a menudo se llama la “fracción activa”, compuesta por materiales altamente reactivos con superficies cargadas eléctricamente. El pequeño tamaño de los coloides da como resultado una gran superficie por unidad de peso, y su estructura iónica resulta en una carga eléctrica neta.
El tipo, la cantidad y la mineralogía de coloides influirán fuertemente en la mayoría de las decisiones de manejo de la tierra. Por ejemplo, un suelo que es 40% de arcilla que consiste principalmente en esmectita (una arcilla de contracción 2:1) podría tener limitaciones para construir caminos, o construir cimientos debido al desplazamiento del suelo a medida que el suelo se moja y se seca. Sin embargo, dicho suelo podría ser altamente productivo para la agricultura de cultivos en hileras, debido a la alta cantidad de carga que facilita la retención de nutrientes como Ca 2+, K +, Mg 2+, etc. Por el contrario, un suelo como un Oxisol que tiene 80% de arcilla tiene coloides que son principalmente óxidos de aluminio y hierro, que no se encogen ni se hinchan, y tienen una baja cantidad de carga. Así, el suelo sería muy adecuado para la construcción de cimientos.
Propiedades generales de los coloides del suelo
Tamaño: más pequeño de lo que se puede ver con un microscopio óptico normal
Superficie: Cuanto menor sea el tamaño de las partículas del suelo, mayor será la superficie. Una mayor superficie aumenta la disponibilidad de sitios de reacción para procesos como adsorción, catálisis, precipitación, colonización microbiana, etc. Algunos coloides también pueden poseer extensas superficies internas, dependiendo de las unidades cristalinas presentes.
Carga superficial: los coloides llevan cargas electrostáticas positivas y/o negativas, por lo que las cargas negativas suelen superar las cargas positivas. La carga a veces depende del pH. La carga coloidal ayuda a atraer o rechazar diversas sustancias en la solución del suelo o el ambiente.
Tipos de coloides de suelo
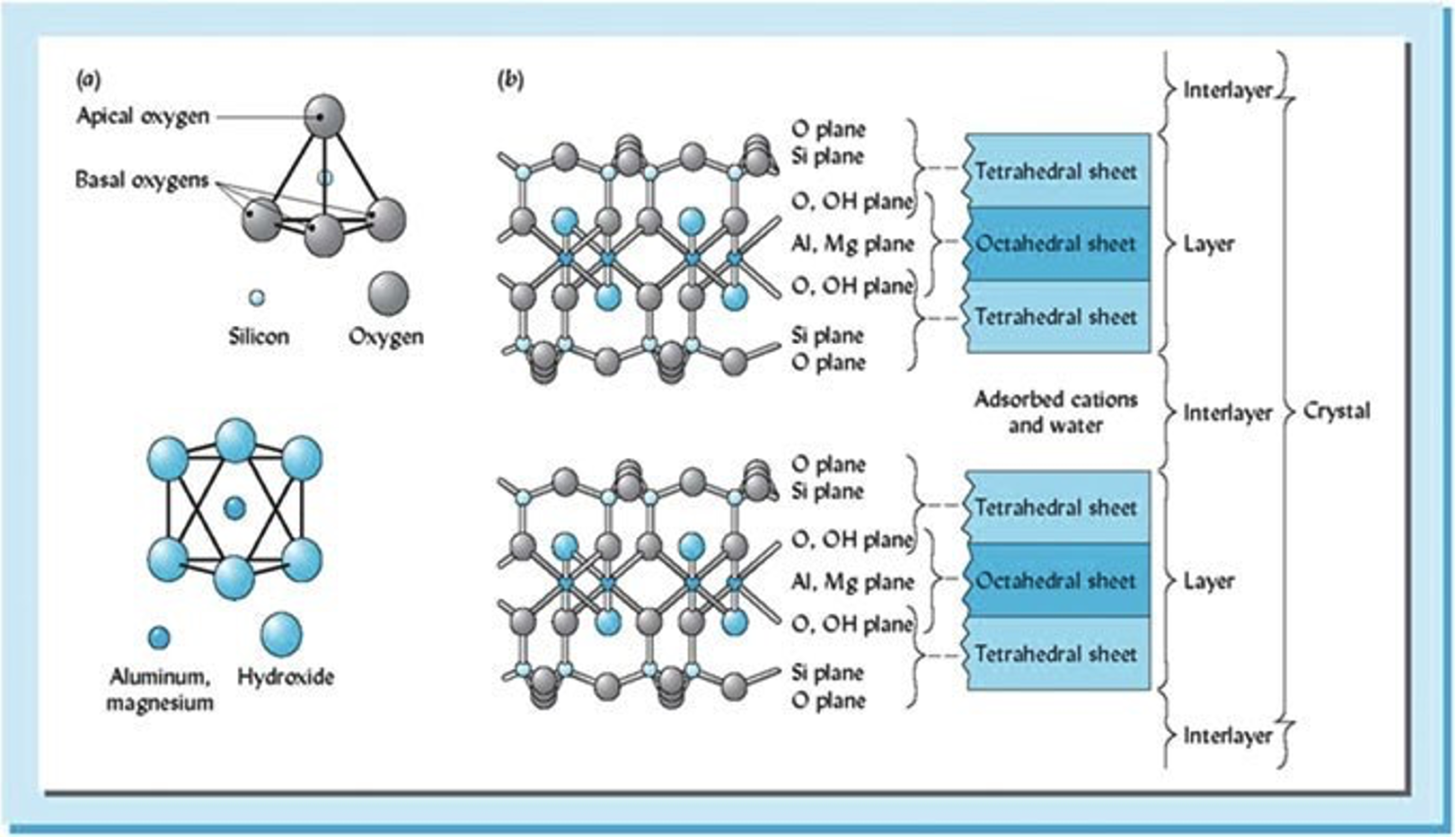
Arcillas de silicato cristalino: Los tipos de arcilla varían según el número y combinaciones de unidades estructurales. Las unidades estructurales se caracterizan por unidades tetraédricas (Si 4+) o unidades octaédricas (Al 3+, Mg 2+ y Fe 2+ /Fe 3+) (Figura 2). Las unidades individuales se unen para formar “láminas” de átomos de 0-Si-Al fuertemente unidos y apretados, que se combinan para formar las capas que le dan a la arcilla su estructura cristalina característica. El tamaño y ubicación de la carga de la capa varía debido al proceso de sustitución isomórfica, que ocurre en las láminas estratificadas (Figura 2). Las arcillas de silicato cristalino se categorizan típicamente en dos categorías: 1) arcillas 1:1; y, 2) arcillas 2:1.
1:1 Arcillas - (es decir, caolinita)
- Un tetraedro y una hoja de octaedro
- Acción no expandible, sin encogimiento-hinchamiento
- Poca sustitución isomórfica
- Se encuentra en suelos muy erosionados
2:1 Arcillas - (esmectita, vermiculita y mica)
- Una lámina octaédrica entre dos láminas tetraédricas
- Tienen una variedad de potenciales de encogimiento-hinchamiento, favoreciendo una mayor acción encogimiento-hinchamiento
- Carga dominada por sustitución isomórfica
- La sustitución isomórfica ocurre en la... octaédrica (esmectita), tetraédrica (mica) y tetraédrica (vermiculita)
Arcillas de silicato no cristalino: Estas arcillas también consisten en átomos de Si-Al-O fuertemente unidos, orientados en láminas no cristalinas desordenadas. Se caracterizan por una alta capacidad de retención de agua y capacidades extremadamente altas para absorber fuertemente el fosfato y otros aniones, particularmente en condiciones ácidas. Ejemplos de arcillas de silicato no cristalinas incluyen, alofano e imogolita, que se encuentran típicamente en Andisoles, o suelos derivados de cenizas volcánicas.
Óxidos de hierro y aluminio: estas propiedades están presentes en muchos suelos pero se expresan altamente en suelos altamente erosionados de regiones cálidas y húmedas. Consisten en átomos de Fe o Al combinados con átomos de O, con una carga neta que varía de ligeramente negativa a moderadamente positiva. Ejemplos de óxidos de hierro incluyen goetita cristalina y recubrimientos de suelo. Ejemplos de óxidos de aluminio incluyen gibbsita cristalina y recubrimientos de suelo.
Material orgánico/humus: Los coloides orgánicos o humus, son especialmente importantes en las porciones superiores de un perfil de suelo. Debido a que estos coloides no son material mineral, alternativamente, consisten en cadenas complejas y anillos de átomos de carbono unidos a H, O y N. Estos coloides suelen ser los más pequeños en tamaño, tienen una carga neta negativa que varía con el pH del suelo, y tienen una alta capacidad para absorber agua.
CARGA DE SUELO
Ahora que hemos precedido los fundamentos de los coloides del suelo, es importante destacar algunos de los procesos importantes que contribuyen a la carga potencial de un suelo. Para comenzar, hay dos tipos de carga dentro de un suelo: 1) Carga permanente y 2) Carga variable.
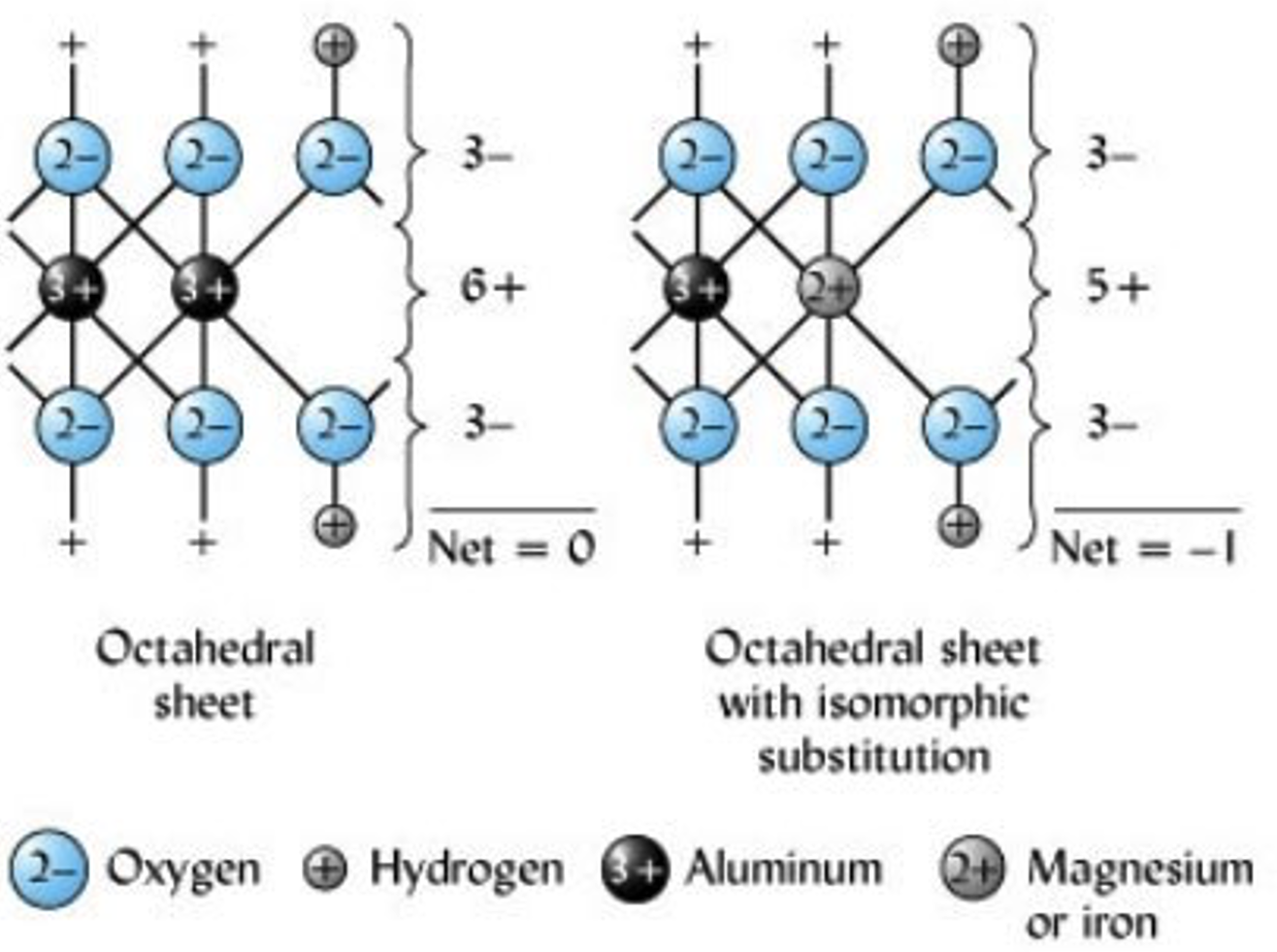
- Carga permanente: esta carga se determina a partir de la sustitución isomórfica que tiene lugar en la fracción arcillosa del suelo entre capas de filosilicato de arcillas de silicato cristalino.
- Carga variable: esta carga es predominantemente dependiente del pH y resulta de la reacción de OH - asociada con lo siguiente
- Bordes de minerales arcillosos
- Material orgánico
- Óxidos de aluminio y hierro
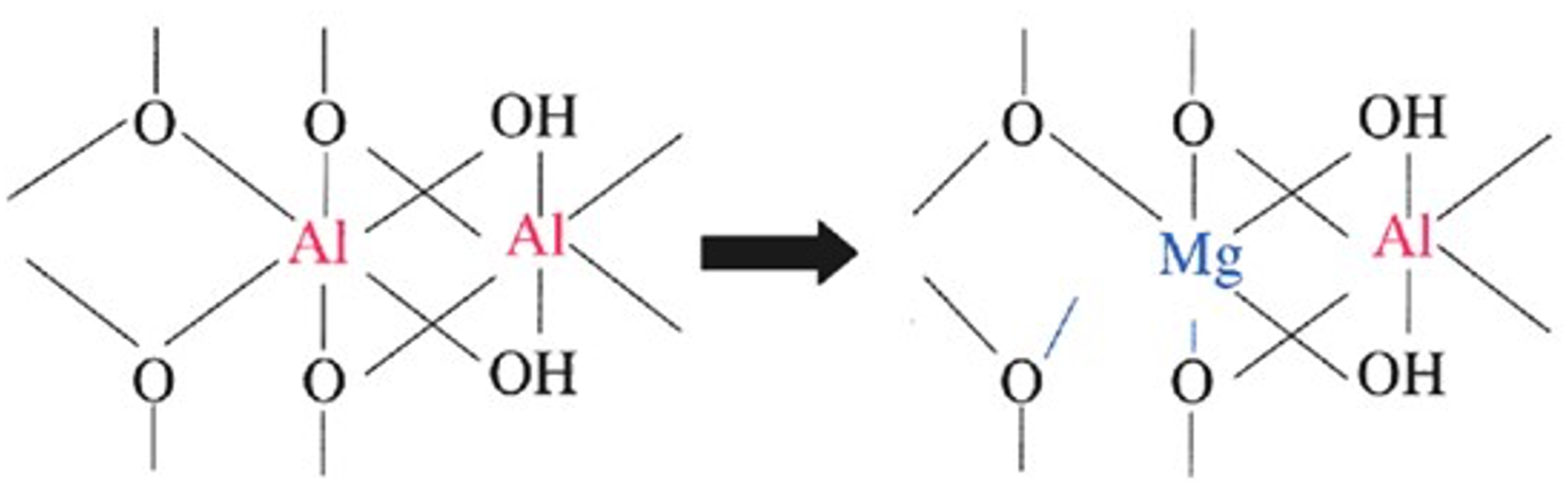
Sustitución isomórfica
Es el proceso por el cual un elemento llena una posición originalmente llena por otro elemento de tamaño similar (radios iónicos). Este proceso ocurre típicamente entre los iones Si, Al y Mg mantenidos dentro de estructuras octaédricas y tetraédricas, por lo que son reemplazados por un catión de tamaño similar (Figura 3). Este reemplazo altera la carga general y la naturaleza de las arcillas de silicato. Por ejemplo, si Mg 2+ sustituye Al 3+, la carga global se equilibra a favor de una carga negativa por la presencia de O, y la hoja resultante se deja con una carga negativa neta (Figura 4).
Capacidad de intercambio catiónico
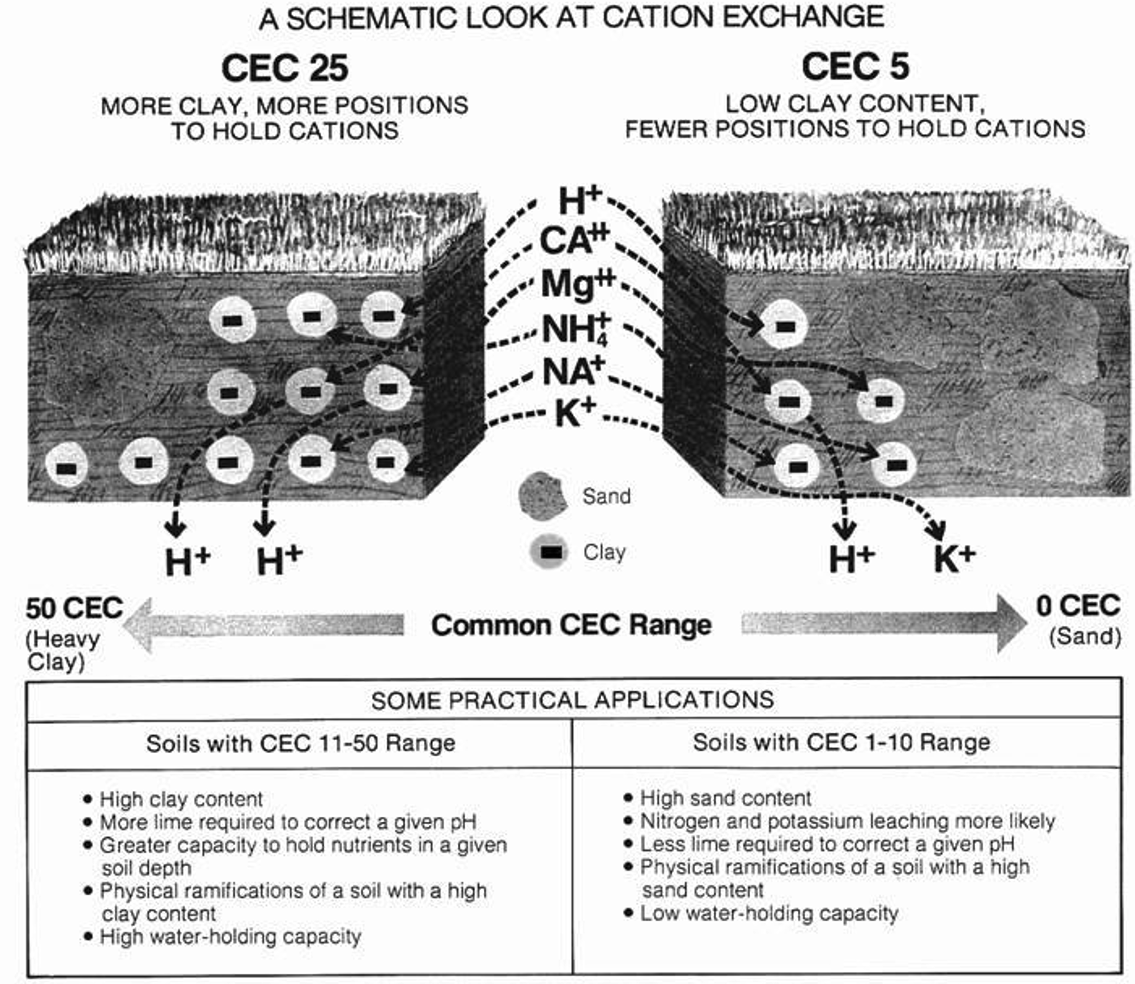
El intercambio iónico es una de las características más significativas de las fracciones de arcilla y humus. La capacidad de las partículas para atraer o adsorber cationes se denomina capacidad de intercambio catiónico (CEC). Esta propiedad del suelo es muy importante para la absorción de nutrientes de las plantas y el amortiguamiento contra la acidificación del suelo. Los minerales arcillosos y los componentes orgánicos del suelo tienen sitios cargados negativamente que pueden absorber cationes cargados positivamente y mantener esos cationes en sus superficies por fuerza electrostática. Esta capacidad permite que el suelo sirva como almacén de nutrientes vegetales como potasio (K +), calcio (Ca 2+) y magnesio (Mg 2+), también denominados cationes base. Medir cationes base en un suelo dará una buena idea de la CEC de ese suelo.
Debido a que muchos nutrientes de las plantas existen como cationes, CEC es fundamental para el crecimiento de las plantas. Un suelo con alto contenido arcilloso y materia orgánica tendrá sitios más cargados negativamente para cationes y por lo tanto tendrá una mayor CEC y son más fértiles para las plantas. Sin embargo, en un entorno agrícola, los cultivos pueden cultivarse en suelos con CEC bajo y seguir siendo productivos con enmiendas. La capacidad de intercambio reactivo del suelo también le permite servir como filtro o medio de tratamiento para la aplicación terrestre de materiales de desecho.
Determinación de la capacidad de intercambio catiónico
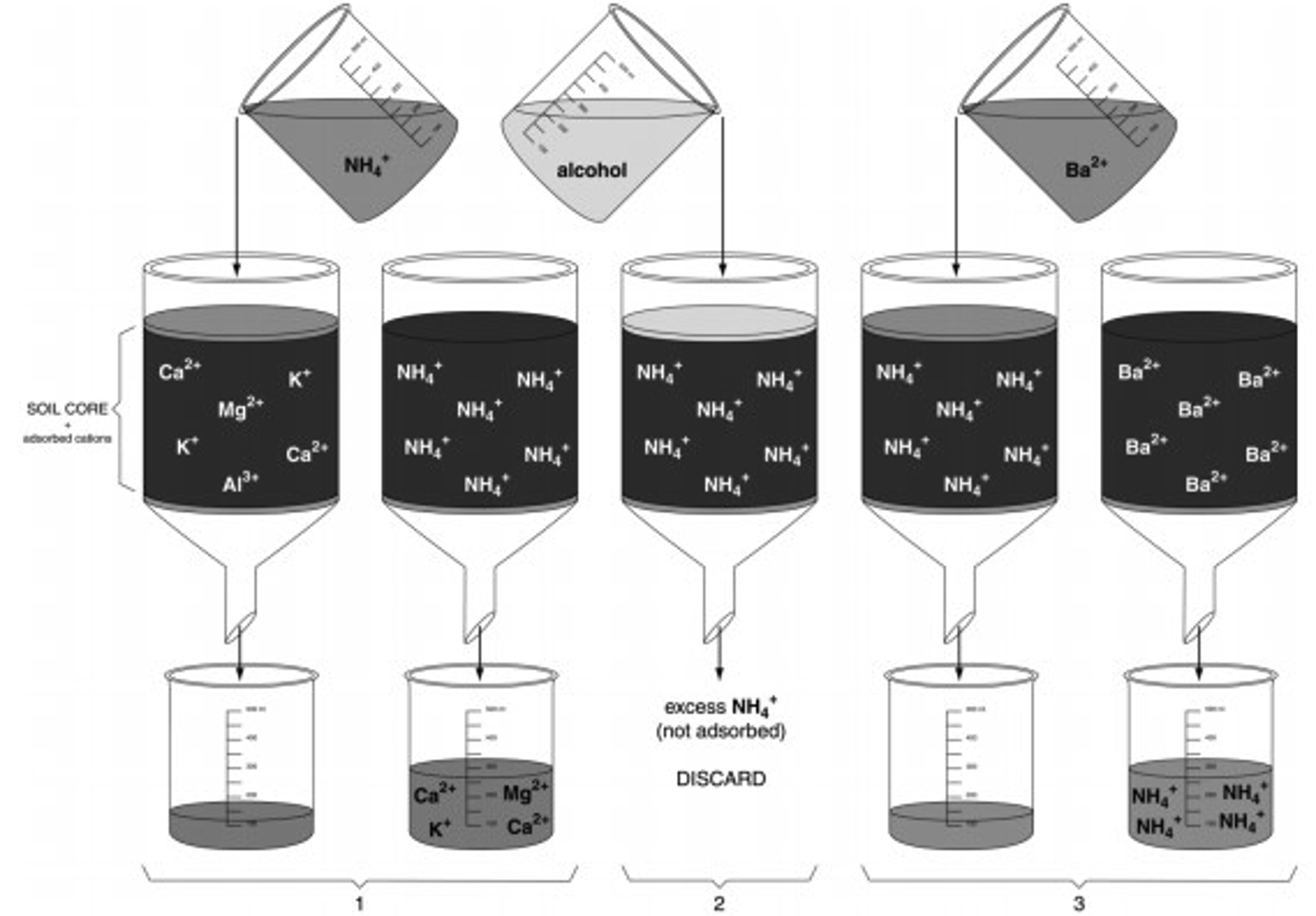
La capacidad de intercambio catiónico (cantidad de cationes que un suelo puede adsorber por unidad de peso, CEC) se puede determinar mediante un proceso de desplazamiento simple (Figura 5).
- La muestra de suelo se satura primero con un catión simple como NH 4 + por lo que todos los sitios de carga negativa están ocupados por NH 4 +.
- El exceso de NH 4 + (es decir, no en sitios de intercambio) se elimina mediante lixiviación con alcohol etílico.
- Otro catión como el Ba 2+ se utiliza para desplazar a todos los NH 4 +. El NH 4 + se recoge en el filtrado y se mide. La cantidad de NH 4 + recolectada de la muestra es la cantidad de cationes que el suelo puede contener, es decir, CEC.
Cálculo de la CEC
El Método de Suma-de-Cationes: Si tiene un análisis de suelo donde se listan las cantidades de todos los cationes en el suelo, simplemente sumando todas esas cantidades intercambiables producirá el CEC que encontró en los problemas anteriores.
El Método “Mineralogía”: Como sabes por tu lectura y discusión en clase, los minerales arcillosos tienen un rango de valores para la CEC. Si se conoce la mineralogía de la fracción arcillosa (es decir, el tipo y las cantidades de cada mineral arcilloso), entonces se puede aproximar la CEC.
Para facilitar estos cálculos, el Cuadro 1 contiene valores representativos para que CEC los use en todos los cálculos de esta clase a menos que se indique lo contrario. En la naturaleza, sin embargo, estos coloides del suelo tendrán un rango de valores.
| Tipo mineral o coloide | CEC de coloide puro (cmol c/kg) |
|---|---|
| caolinita | 10 |
| ilita | 30 |
| montmorillonita/esmectita | 100 |
| vermiculita | 150 |
| humus | 200 |
Ejemplo: Usando el enfoque de mineralogía para los cálculos de la CEC, considere un suelo que tenga 100% arcilla donde la arcilla sea 100% caolinita. La CCA sería entonces de 10 cmol c/kg. Si un suelo contiene solo 10% de caolinita (o 10 kg de arcilla en 100 kg de suelo), sin embargo, esta arcilla aportaría:
\[ \mathrm{Total\; CEC\; of\; the\; soil = \dfrac{10 \;cmol_c}{kg\;clay} \times \dfrac{10 \;kg \;clay}{100 \;kg\;soil} = \dfrac{1.0 \;cmol_c}{kg\;soil}} \nonumber \]
pH del suelo
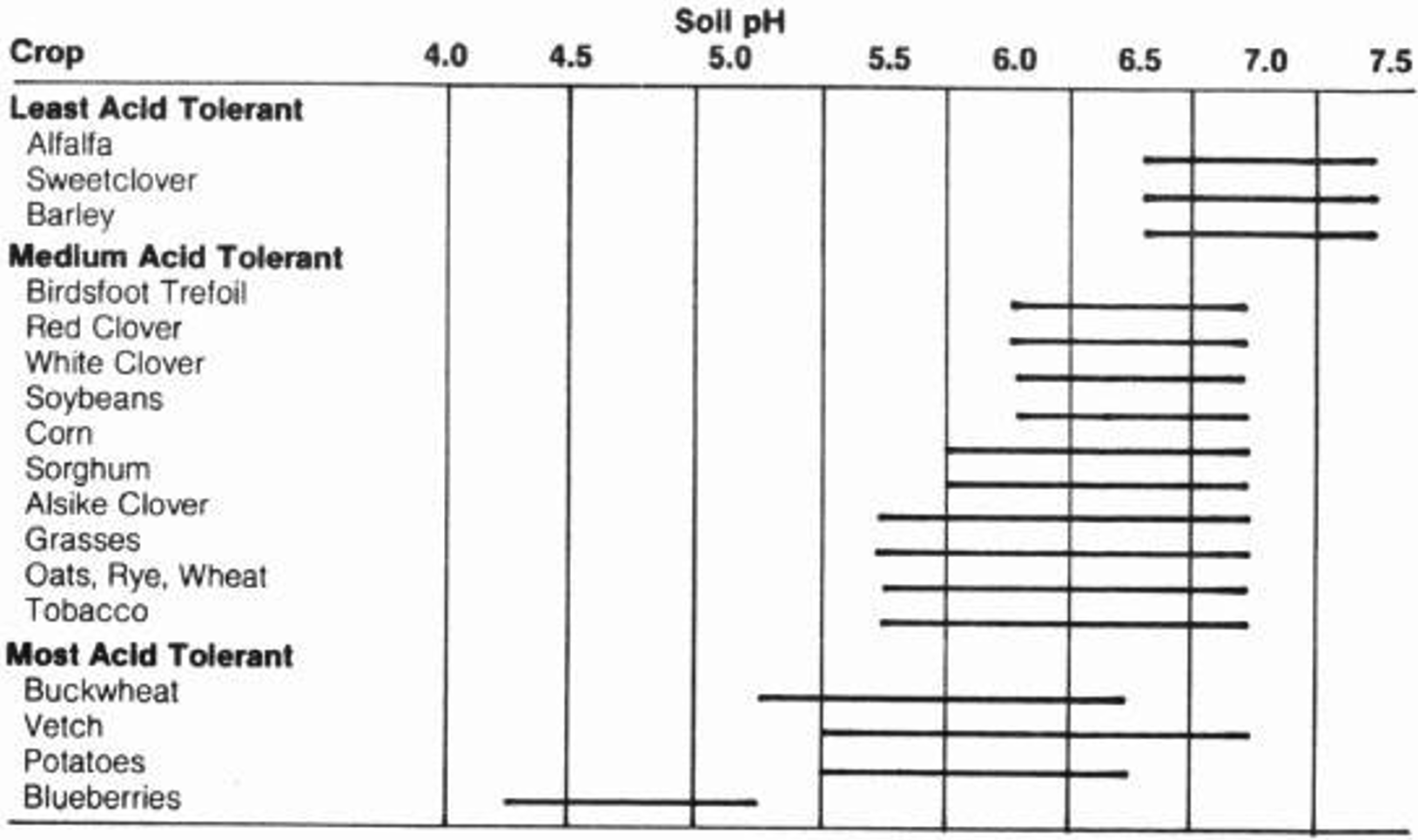
Por definición, pH = -log [H +]. El pH del suelo es un factor crítico para el destino de muchos procesos químicos y la carga variable del suelo. El pH del suelo también es increíblemente importante para el crecimiento de las plantas: ciertos nutrientes esenciales de las plantas solo están disponibles dentro de ciertos rangos de pH. Los rangos de pH óptimos de la planta varían mucho. Algunas plantas sobresalen en pH bajos (por ejemplo, arándanos) mientras que otras se adaptan a pH altos (por ejemplo, espárragos) (Figura 7). Para la agricultura, si el pH del suelo no es deseable para el cultivo dado, se puede ajustar. La adición de cal puede elevar el pH mientras que agregar materia orgánica o fertilizante amónico puede disminuir el pH.
Conductividad eléctrica del suelo
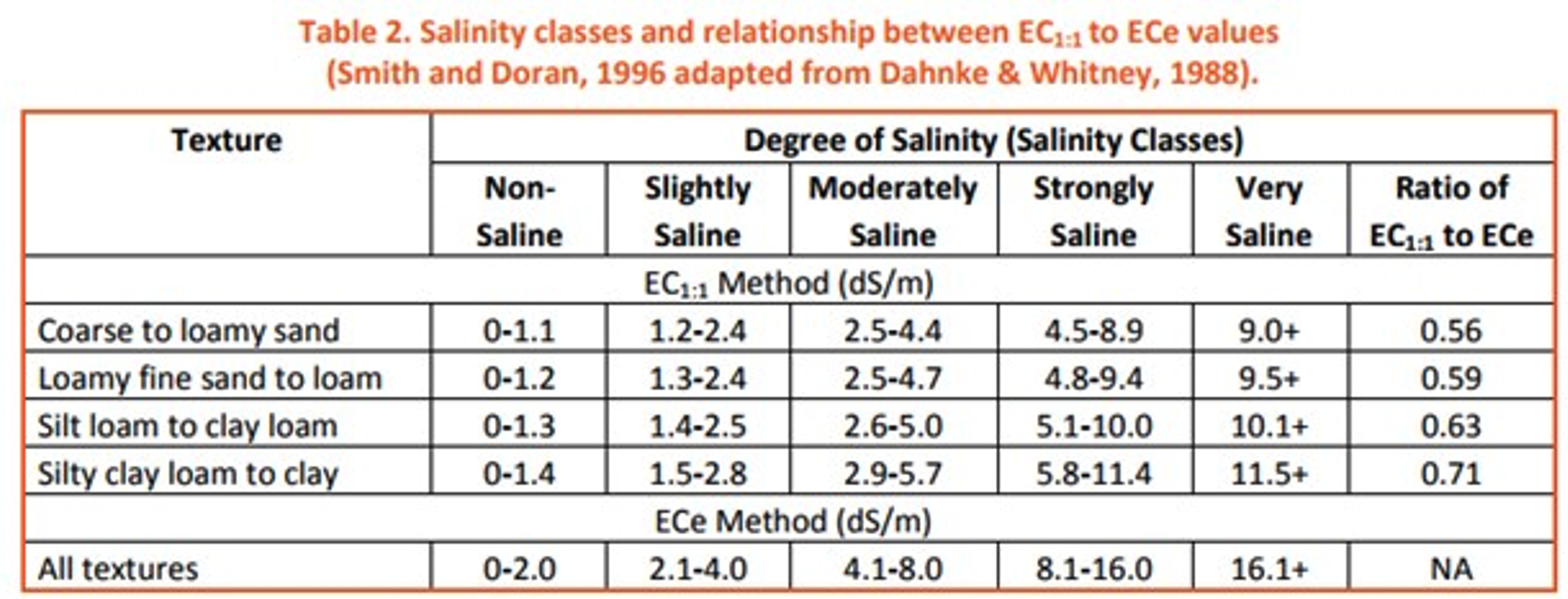
Conductividad Eléctrica (CE) es la medida de la cantidad de sales en el suelo, o salinidad. La EC varía según el tipo de suelo, la textura y la ubicación (Figura 8). La CE es muy relevante en el oeste de Estados Unidos así como en las zonas mareales en las zonas costeras. La CE afecta múltiples facetas de la salud del suelo, incluyendo el equilibrio suelo-agua y la actividad microbiana del suelo. Los efectos negativos sobre el equilibrio suelo-agua pueden ser devastadores para las plantas: los suelos salinos tienen un potencial hídrico menor que lo que hay dentro de las plantas, lo que hace que el agua se mueva de las plantas al suelo. Esta pérdida de agua provoca estrés por sequía a las plantas. Los altos niveles de salinidad son comunes en Occidente debido al clima más seco. Con la falta de movimiento del agua a través del perfil del suelo las sales no se expulsan del suelo y se acumulan cerca de la superficie. Hay muchas maneras de manejar adecuadamente un suelo que tiene una EC superior a la deseada, incluyendo limitar el fertilizante nitrogenado (que puede aumentar la salinidad) así como practicar la agricultura con labranza cero para retener la humedad del suelo.
REACCIONES DE REDUCción-OXIDACIÓN (redox)
La alternancia de condiciones oxidantes y reductoras en los suelos influye en una serie de reacciones químicas críticas, el potencial de crecimiento vegetal, la dinámica de la materia orgánica del suelo y la supervivencia de los organismos. La cuantificación de las condiciones reductoras del suelo es impulsada por condiciones de suelo saturado y es particularmente importante en la evaluación de la función de los humedales y la identificación de suelos hídricos.
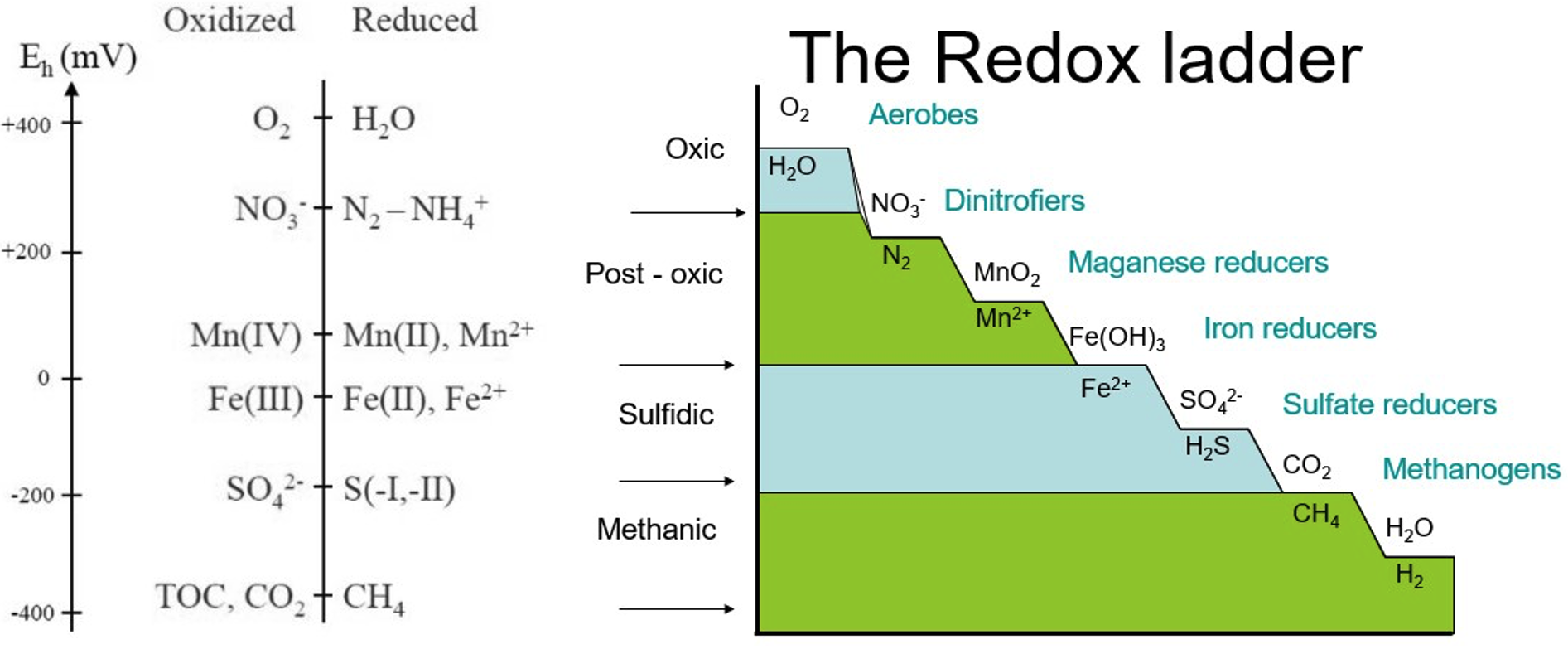
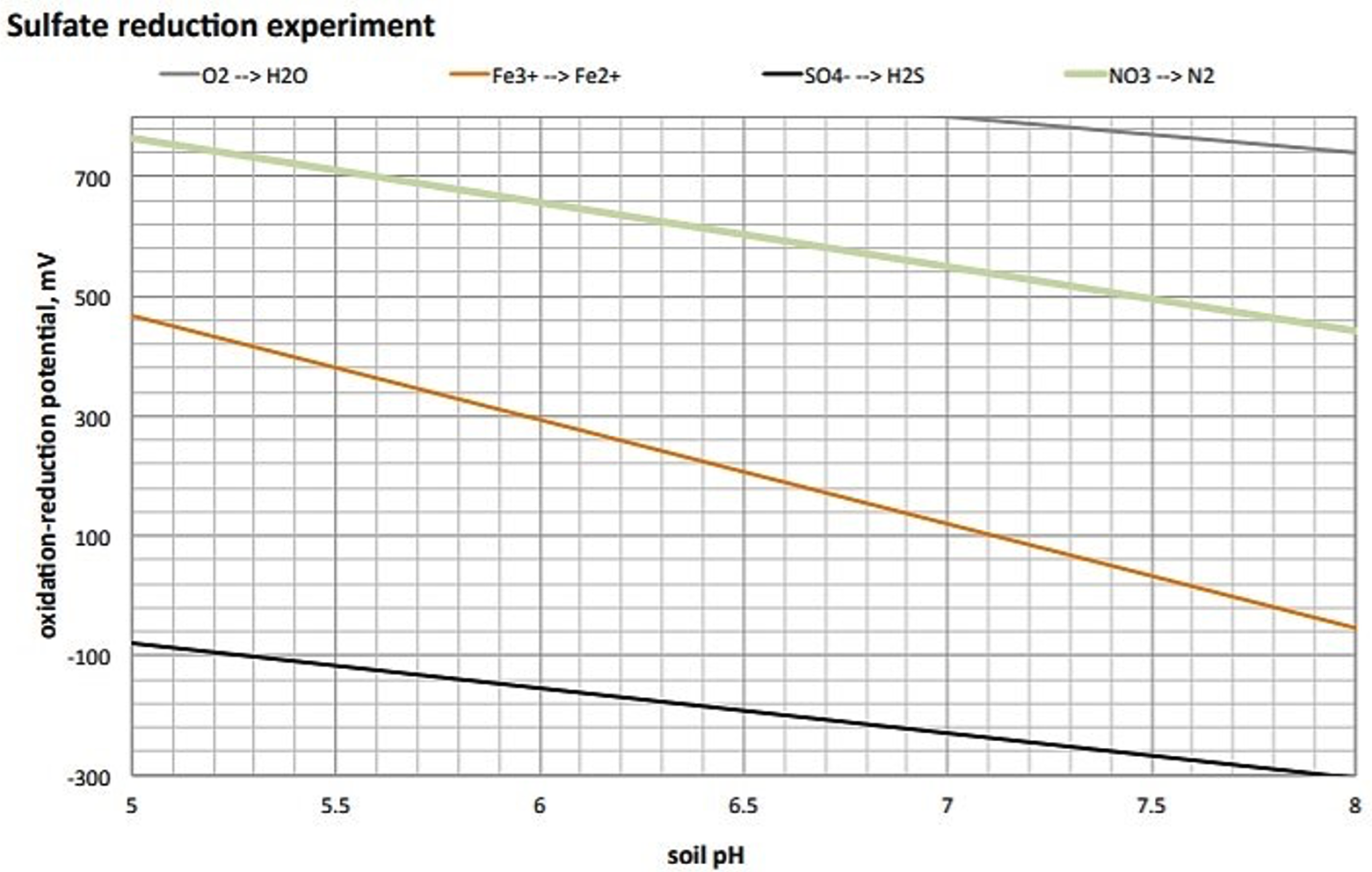
La escalera redox (figura 8) sirve como guía útil para indicar la jerarquía de compuestos químicos utilizados como aceptores de electrones terminales (TEA) durante reacciones de reducción mediadas microbialmente (Figura 9). Los diversos compuestos se utilizan como TEAs en rangos específicos de potencial redox (Eh) y también se ven afectados por el pH.
Diagramas Redox
Las condiciones redox en el suelo se representan en un diagrama Redox, el cual muestra Eh versus pH (Figura 10). Al determinar el pH y el Eh y encontrar el punto de intersección en el diagrama Redox se puede obtener una idea bastante buena sobre la naturaleza general del sistema de suelo.
Efectos de la reducción de las condiciones del suelo en el ambiente del suelo
Las condiciones anaeróbicas pueden generar gas metano. El gas puede ser visible como burbujas atrapadas en la suspensión. Además, las condiciones anaeróbicas se pueden apreciar detectando cuidadosamente la naturaleza del sistema usando tus sentidos olfativos (olfato). En condiciones anaerobias, los microorganismos son propensos a generar muchas aminas orgánicas (como la putrescina), las cuales son altamente odoríferas. El gas sulfuro de hidrógeno (huevo podrido) se puede generar cuando el sistema se vuelve fuertemente anaeróbico y la mayoría de los iones metálicos se han convertido en FeS o FeS 2.
La reducción de sulfato ocurre en condiciones anaeróbicas donde el ion sulfato sirve como aceptor de electrones alterno reemplazando a la molécula normal de gas oxígeno. Se debe proporcionar energía a los microorganismos en forma de material orgánico fácilmente disponible, que proporciona los electrones en los átomos de H que nunca se aíslan como tales en la reacción. La reacción puede resumirse como sigue:
\[ SO_4^2 + 8[H^+] \rightarrow S^{2-} + 4H_2O \nonumber \]
El sulfuro que se forma es muy reactivo. Forma sulfuros metálicos extremadamente insolubles (hierro-monosulfuros (FeS) y piritas (FeS 2)). Estos sulfuros metálicos le dan a la solución un aspecto negro o gris oscuro. A menudo se forma una estera orgánica en la superficie de estos suelos.
Por favor, lea y complete la siguiente actividad y preguntas. Todas las preguntas deben ser respondidas y los laboratorios concluidos vencen al final del periodo de laboratorio. No se aceptarán trabajos tardíos.


