5.2: Acidez del Suelo y Ajuste del pH del Suelo
- Page ID
- 89004
Objetivos de aprendizaje
- Comprender el origen de la acidez del suelo.
- Medir el pH del suelo con técnicas de campo y laboratorio.
- Determinar el papel del aluminio en la acidez del suelo.
- Indicar la relación entre la capacidad de intercambio catiónico, la capacidad de amortiguación y la acidez potencial.
- Escribir reacciones químicas relacionadas con el pH del suelo y encalado.
- Conocer los objetivos del encalado y los factores que afectan el requerimiento de cal.
- Medida requerimiento de piedra caliza.
- Determinar la calidad caliza.
El manejo del pH del suelo es esencial para crear condiciones de crecimiento ideales para la mayoría de las plantas Esto se debe a que el pH del suelo controla la solubilidad de los nutrientes así como de los metales tóxicos. Debido a esto, la mayoría de las plantas tienen un rango preferido en el pH del suelo. En la mayoría de los casos, los agentes de encalado se agregan al suelo para elevar el pH al rango deseado. Sin embargo, en algunos casos, se desea un pH más bajo del suelo, lo que se puede lograr usando enmiendas del suelo como azufre elemental (S) o sulfato de aluminio (más comúnmente conocido como “alumbre”). En cualquier caso, se debe considerar la tolerancia al pH de la especie vegetal objetivo, las propiedades del suelo y las propiedades de la enmienda del suelo para lograr el cambio deseado en el pH del suelo.
Materiales
- Suelos con pH bajo
- Medidor de pH con electrodo de pH
- Tiras reactivas de pH
- Vasos
- Varillas agitadoras de vidrio
- Carbonato de calcio de grado reactivo puro
- Óxido de calcio puro de grado reactivo
- Sulfato de calcio puro grado reactivo (yeso)
- Caliza dolomítica, gruesa (tamizada usando un tamiz de malla 20-40)
- Caliza dolomítica, fina (tamizada usando un tamiz de malla 100+)
Lectura y visualización recomendadas
- Resumen del pH del suelo (CropWatch — Youth, 2013c)
- Prueba de pH del suelo (CropWatch — Youth, 2013d)
- pH del suelo (USDA-NRCS, 2011)
- pH del suelo (USDA-NRCS, 2014a)
- Encalado de suelos ácidos (Whitney y Lamond, 1993)
Asignación Prelab
Usando la lectura recomendada y la introducción a este laboratorio, considere las preguntas que se enumeran a continuación. Estas definiciones/preguntas proporcionarán un resumen conciso de los principales conceptos abordados en el laboratorio. También son útiles como notas de estudio para exámenes.
- Definir pH y PoH. Mostrar las fórmulas utilizadas para calcular ambas.
- ¿Por qué el aluminio se considera un catión ácido? Mostrar las reacciones relevantes.
- Enumere cuatro consecuencias negativas de las condiciones de pH bajo (ácido) en el suelo. Enumerar dos consecuencias negativas de las condiciones de pH alto (básico) en el suelo.
- Definir capacidad de almacenamiento en búfer. ¿Cómo se relaciona la capacidad de amortiguación con la capacidad de intercambio catiónico?
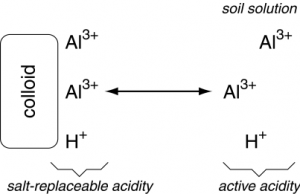
- Definir acidez activa, acidez reemplazable por sal (intercambiable) y acidez residual.
- ¿Enumerar diversas enmiendas de suelo que se utilizan para aumentar el pH de un suelo ácido?
- Escribir una reacción química que represente cómo un material típico de encalado (piedra caliza calcítica, cal quemada, etc.) actúa para neutralizar la acidez.
- Enumerar diversas enmiendas de suelo utilizadas para acidificar un suelo y reducir el pH.
- ¿Qué influye en la cantidad de material que se necesita para aumentar el pH de un suelo ácido?
Introducción
La acidez del suelo está controlada en gran medida por la composición de iones en los sitios de intercambio en la fracción coloidal. Los cationes H + son ácidos por definición, y los cationes Al 3+ se consideran ácidos porque reaccionan con H 2 O para producir Al (OH) 3 y 3H +. Los cationes Ca 2+, Mg 2+, K +, Na +, entre otros, se consideran básicos porque forman bases fuertemente disociadas al reaccionar con OH —. Estos cationes intercambiables en el complejo de intercambio están en equilibrio con los cationes en solución de suelo. Por lo tanto, la naturaleza de los cationes intercambiables influye en la composición de la solución del suelo.
Los cationes ácidos adsorbidos en los sitios de intercambio negativo se denominan la reserva (también residual o potencial) y acidez reemplazable por sal (también intercambiable). La acidez de reserva y sal reemplazable controla el nivel de acidez soluble o activa en la solución del suelo. Solo se mide la acidez activa en una determinación rutinaria del pH. La acidez de reserva y sal reemplazable es siempre muchas veces mayor que la acidez activa.
Un suelo es ácido cuando los iones hidrógeno predominan en el suelo. El grado de acidez se expresa en términos de pH, el cual se define como el logaritmo negativo de la actividad del ión hidrógeno. Por lo tanto, el pH de una solución de iones de hidrógeno 0.01-molar es
\[\text{pH}=-\text{log }\left(\dfrac{10^{-2}\text{ mol H}^+}{\text{L}}\right)=2\]
A pH 7, la concentración de iones H+ e iones OH- son iguales, y el suelo o solución es neutra. A valores de pH menores a 7, el suelo es ácido; a valores superiores a 7, el suelo es alcalino. La mayoría de los suelos varían en pH de aproximadamente 4 a 10. Los suelos en áreas con alta precipitación generalmente son ácidos con un pH menor a 7. Los suelos desarrollados en depósitos ricos en cal a menudo serán alcalinos. Los suelos altos en calcio rara vez tienen valores de pH superiores a 7.5, pero la presencia de grandes cantidades de carbonato de calcio puede hacer que el pH sea tan alto como 8.5. Donde el pH es superior a 8.5, un exceso de sodio es altamente probable.
El pH del suelo más deseable para la mayoría de los cultivos en Kansas es 6.8. Sin embargo, cultivos como los arándanos necesitan un pH más bajo, y otros cultivos, como la alfalfa, necesitan un pH más alto. A pH del suelo inferior a 5.8, pueden ocurrir varios problemas:
- Toxicidad de Al y Mn
- Crecimiento inhibido de bacterias fijadoras de N
- Posibles deficiencias en Mg y/o Ca.
- Deficiencia de P (P reacciona con Fe y Al)
- A más de pH 7.5, pueden ocurrir otros problemas:
- Deficiencia de Fe, Mn, Cu o Zn
- Deficiencia de P (P reacciona con Ca)
Capacidad de almacenamiento en búfer
La capacidad de amortiguación es una medida de la capacidad del suelo para resistir un cambio en el pH, directamente relacionado con la magnitud de la capacidad de intercambio. Pequeñas fluctuaciones en el contenido de ácido o base pueden ocurrir sin un cambio de pH notable ya que los cationes son adsorbidos o liberados del complejo de intercambio. Los suelos con mayor capacidad de intercambio catiónico tienen el mayor amortiguamiento de un cambio de pH. Es decir, dos suelos pueden tener el mismo pH (acidez activa en solución de suelo), pero el que tenga mayor capacidad de intercambio catiónico tendrá la mayor acidez almacenada en reserva y por lo tanto la mayor capacidad de amortiguación o capacidad de resistir un cambio en el pH. Por esta razón, se necesita menos cal para aumentar el pH de un suelo arenoso (CEC bajo) en una cantidad dada que para aumentar el pH de un suelo arcilloso (CEC superior) la misma cantidad.
Fuentes de Acidez del Suelo
Controlar el pH del suelo es vital para un uso óptimo y productividad de los suelos. Agregar cal es la forma más efectiva y práctica de elevar el pH de los suelos ácidos. El azufre elemental, el sulfato de hierro o el sulfato de aluminio se pueden usar para reducir el pH del suelo. Debido a que la acidez es una preocupación en Kansas, nos enfocaremos en elevar el pH del suelo. Comprender las siguientes ecuaciones debería ayudarle a comprender las fuentes de acidez del suelo y las reacciones del suelo a la cal.
Los cationes ácidos adsorbidos a coloides pueden liberarse a la solución a través del intercambio catiónico, en el que cationes como Ca 2+, Mg 2+, K +, etc. pueden desplazar H + y Al 3+, forzándolos a la solución del suelo, moviendo esos cationes ácidos de la sal- alberca de acidez reemplazable a la piscina de acidez activa. Observe que la reacción es reversible, por lo que tener altas cantidades de cationes ácidos en solución también podría provocar el desplazamiento de los cationes base de los sitios de intercambio coloidal.
Un producto de la respiración es el CO 2. En el suelo, la respiración de bacterias, hongos, protistas, raíces, etc. contribuye a una concentración muy alta de CO 2 en el aire del suelo. Cuando el CO 2 se disuelve en la solución del suelo, reacciona con el agua para formar ácido carbónico, un ácido débil que puede liberar H + en solución, disminuyendo así el pH del suelo. Tenga en cuenta que esta reacción es reversible.
\[\text{H}_2\text{O}+\text{CO}_2\leftrightarrow\text{H}_2\text{CO}_3\leftrightarrow\text{H}^++\text{HCO}_3^- \nonumber\]
La nitrificación ocurre bajo condiciones aeróbicas. La oxidación de NH 4 + a un producto final de NO 3 — es facilitada por las bacterias nitrosomonas y nitrobacter. La reacción neta se muestra a continuación. Obsérvese que esta reacción no es reversible, y que por cada dos moles de NH 4 +, hay cuatro moles de H + liberados.
\[2\text{NH}_4^++4\text{O}_2\rightarrow2\text{NO}_3^-+2\text{H}_2\text{O}+4\text{H}^+ \nonumber\]
El azufre se puede utilizar como enmienda del suelo para bajar el pH del suelo. Un ejemplo común es el cultivo de plantas que prefieren condiciones ácidas, como el arándano, en suelos que son neutros a alcalinos. En esta reacción, el azufre elemental se oxida para formar ácido sulfúrico, un ácido fuerte. Este es un proceso mediado por microbios.
\[2\text{S}+3\text{O}_2+2\text{H}_2\text{O}\rightarrow\text{H}_2\text{SO}_4^+\leftrightarrow\text{SO}_4^{2-}+2\text{H}^+ \nonumber\]
El aluminio se considera un catión ácido debido a la liberación de H + durante la hidrólisis del aluminio. Por cada mol de Al 3+, se liberan tres moles de H + en solución. Tenga en cuenta que esta reacción es reversible.
\[\text{Al}^{3+}+\text{H}_2\text{O}\leftrightarrow\text{Al(OH)}^{2+}+\text{H}^+ \nonumber\]
\[\text{Al(OH)}^{2+}+\text{H}_2\text{O}\leftrightarrow\text{Al(OH)}_2^{+}+\text{H}^+ \nonumber\]
\[\text{Al(OH)}_2^{+}+\text{H}_2\text{O}\leftrightarrow\text{Al(OH)}_3+\text{H}^+ \nonumber\]
Elevar el pH del suelo con cal
La cal agrícola estándar, que es principalmente carbonato de calcio (CaCo 3) se agrega a los suelos para aumentar el pH del suelo. El CaCo 3 reacciona con agua como se muestra a continuación.
\[\text{CaCO}_3+\text{H}_2\text{O}\rightarrow\text{Ca}^{2+}+\text{HCO}_3^-+\text{OH}^- \nonumber\]
El Ca 2+ puede desplazar otros cationes en el intercambio catiónico, incluyendo H+ y Al 3+ (acidez intercambiable por sal), liberándolo así en solución. Sin embargo, el Ca 2+ no reacciona (neutraliza) los cationes ácidos. Los cationes ácidos son neutralizados por HCO 3 — y OH —. A continuación se representa un ejemplo de la reacción química general tras la adición de cal a suelos ácidos.
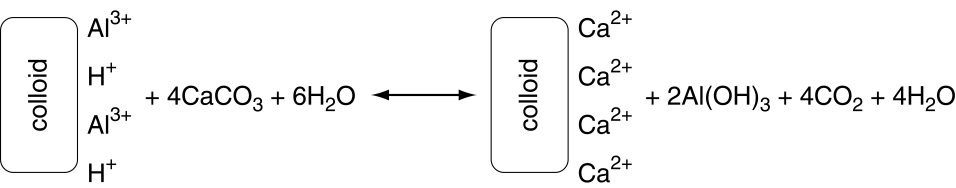
Hay agentes de encalado distintos a CaCo 3. Debido a que la mayoría de esos otros agentes de encalado tienen diferentes fórmulas químicas, las reacciones químicas son diferentes. Esto también significa que la efectividad de diferentes agentes de encalado varía de la de CaCo 3.
Factores que afectan las tasas de encalado
Los principales factores que impactan las tasas de cal (la cantidad de cal requerida para elevar el pH del suelo a un pH objetivo) incluyen el requerimiento de cultivo; el tipo, tamaño y pureza del agente de encalado; la capacidad de intercambio catiónico del suelo; y el pH del suelo.
La mayoría de las plantas tienen un rango en el pH del suelo en el que son más saludables, o producen el mayor rendimiento. Esto es porque el pH del suelo impacta la disponibilidad de nutrientes. Por ejemplo, algunas plantas, como la alfalfa y el trébol dulce, requieren más calcio que otras, y por lo tanto requieren mayores tasas de encalado. Otros, como azaleas, arándanos y arándanos, requieren más hierro; el cual es más soluble a un pH más bajo. Por lo tanto, se necesitaría una mayor tasa de aplicación de cal para elevar el suelo al pH deseado del suelo para la alfalfa que para los arándanos.
Se necesita tiempo para que la piedra caliza se disuelva y reemplace hidrógeno o aluminio en las posiciones de intercambio del suelo. Las partículas de cal más pequeñas tienen una mayor superficie que está expuesta y disponible para reaccionar, lo que reduce el tiempo requerido para que toda la cal reaccione. Por lo tanto, los agentes de encalado más finos son más efectivos para elevar el pH del suelo. Muchas calizas son predominantemente carbonato de calcio (CaCo 3), y algunas contienen tanto CaCo 3 como MgCO 3. Sin embargo, la mayoría de las calizas contienen cierta cantidad de impurezas y material inerte. Por lo tanto, un agente de encalado con muchas impurezas (y menos cal) es menos efectivo para elevar el pH del suelo. Obviamente, cuanto más puro es el CaCo 3, más efectiva es la cal.
Los suelos con el mismo pH pueden requerir diferentes cantidades de piedra caliza debido a las diferencias en la CEC, lo que implicaría diferencias en las capacidades de amortiguación. Por ejemplo, considere la cantidad de piedra caliza necesaria para elevar la saturación base de dos suelos de 70% a 90% cuando un suelo tiene un CEC de 15 cmol c/kg, y el otro tiene un CEC de 40 cmol c/kg
\[15\frac{\text{ cmol}_\text{c}}{\text{kg}}\times20\text{% increase}=3\frac{\text{ cmol}_\text{c}}{\text{kg}}\text{ basic cations required from lime} \nonumber\]
\[40\frac{\text{ cmol}_\text{c}}{\text{kg}}\times20\text{% increase}=8\frac{\text{ cmol}_\text{c}}{\text{kg}}\text{ basic cations required from lime} \nonumber\]
Por último, el pH del suelo se rige por la saturación de base. Si otros factores son constantes, cuanto menor sea el pH, más cal se requiere para lograr un pH deseado. Esto se debe a que a un pH bajo, un mayor porcentaje de la CEC está ocupado por cationes ácidos, lo que requiere mayores cantidades de cal para neutralizar.
Actividad 1: Determinación del pH con tiras indicadoras (método de campo)
De las diversas técnicas disponibles para determinar el pH, una que se puede utilizar fácilmente en campo es el método de tira indicadora. Esta técnica utiliza el principio de sensibilidad al pH de ciertos tintes, los cuales provocan diferencias de color en un rango de pH. Con los suelos proporcionados, complete la siguiente determinación de pH:
Pesar 10.0 g de tierra en un vaso pequeño de plástico. Agrega 20 ml de agua destilada y revuelve. Dejar reposar durante 5 minutos, revolviendo ocasionalmente.
Usando las tiras indicadoras de pH proporcionadas, sumerja la tira en la copa hasta que la punta se humedezca. Determine el pH comparando el cambio de color de la tira reactiva de pH con la tabla de colores.
![]() Registrar el pH del suelo en la Tabla 14.1.
Registrar el pH del suelo en la Tabla 14.1.
Actividad 2: Determinación del pH del Suelo con un Medidor de pH
Los medidores de pH de laboratorio son más precisos que los tintes y tiras de pH. El medidor de pH mide la actividad del ión hidrógeno [H +] midiendo el potencial eléctrico a través de una fina membrana de vidrio porosa en la base del electrodo. Este potencial cambia en respuesta a [H +], y al estandarizar el instrumento con tampones de pH conocido, podemos medir el pH de cualquier solución, incluyendo soluciones de suelo.
Usando las muestras preparadas en la Actividad 1, coloque cuidadosamente el electrodo en la suspensión. Agita suavemente el electrodo en la solución y anota la lectura del pH. Espere a que el medidor de pH alcance una lectura constante, indicada por la palabra “listo” en la pantalla.
![]() Registre el valor de esta suspensión de suelo-agua 1:2 en el Cuadro 14.1.
Registre el valor de esta suspensión de suelo-agua 1:2 en el Cuadro 14.1.
Actividad 3: Determinar la necesidad de agregar piedra caliza al suelo
Para decidir si un suelo necesita cal, es necesario conocer solo el pH, o la acidez activa, de la solución del suelo. Si el pH es menor o igual a 5.8, generalmente se recomienda cal (el pH por debajo del cual se requiere cal varía según la región y los cultivos previstos).
![]() Por cada suelo analizado en la Actividad 2, decida si se necesita piedra caliza y registre su decisión en la Tabla 14.1.
Por cada suelo analizado en la Actividad 2, decida si se necesita piedra caliza y registre su decisión en la Tabla 14.1.
Cuadro 14.1. Resultados para Actividades 1-4: Determinación del pH del Suelo y Necesidad de Caliza
| Suelo | pH del suelo (tira) | pH del suelo (medidor) | ¿Se necesita cal? | Requisito de cal |
|---|---|---|---|---|
| Sí/No | (lbs ECC/CA) | |||
| A | ||||
| B | ||||
| C | ||||
| D |
Actividad 4: Determinar Cuánta cal se necesita
Para decidir cuánta cal necesita un suelo, se debe determinar la cantidad de acidez de reserva en el suelo. Esta acidez de reserva a menudo se denomina acidez intercambiable porque puede disociarse del complejo de intercambio catiónico a través del cual ingresa a la solución del suelo. Para determinar la acidez intercambiable, se agrega al suelo una solución tampón de pH conocido. Esta solución tampón contiene cationes que reemplazarán a H + y Al 3+ en el complejo de intercambio. Los cationes ácidos retirados del complejo de intercambio reducen el pH del tampón agregado. La Figura 14.1 ilustra la disminución en el pH de una solución tampón a medida que se añade ácido. Una vez determinada una relación (mostrada por la pendiente de la línea), se puede agregar tierra a la solución tampón (o solución tampón al suelo) para determinar la acidez intercambiable.
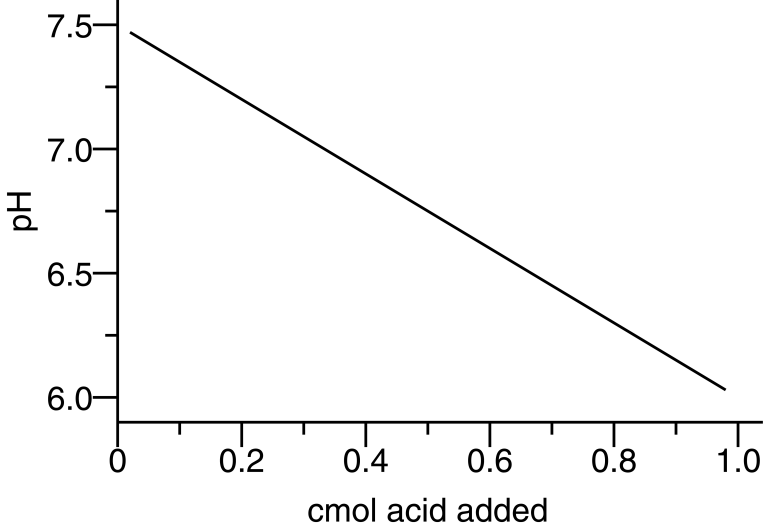
En este ejercicio, utilizaremos el buffer SMP, la solución tampón utilizada por el K-State Soil Testing Lab. Esta solución tampón fue diseñada para proporcionar la velocidad de encalado al usar las siguientes fórmulas, dependiendo de la región y el pH objetivo (ver balas).
\[\text{Target pH of }6.8= \nonumber\]
\[[25,620-(6,360\times\text{ buffer pH})+(391\times\text{buffer pH}\times\text{buffer pH})]\times\text{depth} \nonumber\]
- La profundidad está en pulgadas
- Se utiliza para todos los cultivos en el sureste de Kansas (al este de Flint Hills y al sur de la autopista 56)
- Usado para alfalfa y trébol en Northeast Kansas
- Se recomienda cal si pH < 6.4
\[\text{Target pH of }6.0= \nonumber\]
\[[12,810-(3,180\times\text{ buffer pH})+(196\times\text{buffer pH}\times\text{buffer pH})]\times\text{depth} \nonumber\]
- La profundidad está en pulgadas
- Se utiliza para todos los cultivos en el noreste de Kansas que no sean alfalfa y trébol
- Se utiliza para todos los cultivos en el centro y oeste de Kansas
- Se recomienda cal si pH < 5.8
\[\text{Target pH of }5.5= \nonumber\]
\[[6,405-(1,590\times\text{ buffer pH})+(98\times\text{buffer pH}\times\text{buffer pH})]\times\text{depth} \nonumber\]
- La profundidad está en pulgadas
- Se usa si el flujo de caja es limitado o en áreas problemáticas de disponibilidad de cal en el centro y oeste de Kansas
- Se recomienda cal si pH < 5.5
Este tampón contiene cromo (Cr), un metal pesado tóxico. Por lo tanto, su instructor de laboratorio realizará el análisis de búfer SMP. Como clase, determine qué mezclas suelo-agua de la Actividad 1 necesitan cal (pH ≤ 6.4). A esas soluciones, agregue 10 ml de la solución tampón SMP y revuelva con una varilla de vidrio. Dejar reposar las mezclas durante 30 minutos, lo que debería ser tiempo suficiente para que los cationes ácidos se desplacen de la CEC y se fuercen a la solución. Lea el pH en el medidor.
![]() Suponiendo que el pH deseado es 6.0, calcule el requerimiento de cal y registre sus resultados en la Tabla 14.1.
Suponiendo que el pH deseado es 6.0, calcule el requerimiento de cal y registre sus resultados en la Tabla 14.1.
Actividad 5: Evaluar materiales de encalado
El tipo de material de encalado y el tamaño o finura del material determinan la eficiencia con la que los materiales de encalado elevan el pH del suelo. Este experimento en realidad se inició a principios del semestre para dar tiempo a los agentes de encalado para reaccionar. La modificación del suelo con varios agentes de encalado diferentes nos permite evaluar los efectos del tamaño de partícula y el material de encalado en función de los cambios relativos en el suelo. Los tratamientos incluyeron los siguientes:
- Grado reactivo CaCo 3
- CaO de grado reactivo
- Grado reactivo CaSO 4
- Caliza dolomítica gruesa (malla 35)
- Caliza dolomítica fina (malla 120)
- Control (sin modificaciones)
Cuando se inició este experimento, cada sección de laboratorio se dividió en seis grupos, siendo cada grupo responsable de uno de los seis tratamientos. Su instructor de laboratorio asignó un tratamiento a su grupo, y usted completó los siguientes pasos:
- Etiquetar cuatro bolsas de plástico
- Pesar 20 g de tierra seca al aire en cada bolsa de plástico.
- Pesar 0.1 gramos de material de encalado designado sobre papel de pesaje.
- Agregue el material de encalado al suelo y mezcle bien para distribuirlo uniformemente en el suelo.
- Agrega unos mL de agua a cada bolsa y mezcla.
- Cierre las bolsas para iniciar la incubación.
Ahora que los agentes de encalado han tenido tiempo de reaccionar, recogerás los resultados.
- Agrega 40 ml de agua destilada a la bolsa de plástico y mezcla. Déjalo reposar durante cinco minutos, mezclando de vez en cuando.
- Coloca cuidadosamente el electrodo en la suspensión, gira el electrodo y determina el pH como lo hiciste anteriormente en la Actividad 2.
- Registre el pH para esta solución 2:1 agua-suelo en la Tabla 14.2 a continuación.
Cuadro 14.2. Resultados del experimento de material de encalado
| Tratamiento | Suelo 1 (Suelo Arenoso) pH | Suelo 2 (Suelo Arcilloso) pH |
|---|---|---|
| Grado reactivo puro CaCO3 | ||
| Grado reactivo puro CaO | ||
| Grado reactivo puro CaSO4 | ||
| Caliza dolomítica (malla 35) | ||
| Caliza dolomítica (malla 120) | ||
| Control (sin modificaciones) |
![]() Registre los datos de su grupo en la mesa en la pizarra. Después, registre todos los datos de clase en la tabla anterior.
Registre los datos de su grupo en la mesa en la pizarra. Después, registre todos los datos de clase en la tabla anterior.
Actividad 6: Cómo las características del suelo afectan la reacción de encalado
Para ilustrar los efectos de la textura del suelo y la materia orgánica en el ajuste del pH, su instructor de laboratorio agregó varias tasas de piedra caliza dolomítica a un suelo arenoso, un suelo arcilloso y un suelo orgánico. Las tasas de piedra caliza variaron de cero a 10 toneladas/acre. Después de varios meses, se midieron los siguientes valores de pH:
Cuadro 14.3. Valores de pH resultantes después de las adiciones de cal
| Toneladas de lima añadida | Valores de pH resultantes | ||
|---|---|---|---|
| Suelo arenoso | Suelo arcilloso | Suelo orgánico | |
| 0 | 4.5 | 4.5 | 3.5 |
| 1 | 5.5 | 4.9 | 3.6 |
| 2 | 6.5 | 5.2 | 3.7 |
| 3 | 7.0 | 5.5 | 3.8 |
| 4 | 7.2 | 5.7 | 3.9 |
| 5 | 7.3 | 5.9 | 4.0 |
| 6 | 7.4 | 6.1 | 4.2 |
| 7 | 7.5 | 6.3 | 4.5 |
| 8 | 7.6 | 6.5 | 5.0 |
| 9 | 7.7 | 6.7 | 5.5 |
| 10 | 7.7 | 7.0 | 6.0 |
![]() Trazar los resultados en la Tabla 14.3 en la Figura 14.2 para los tres suelos y conectar los puntos de datos para formar una línea para cada uno de los tres suelos. Utilizando la siguiente gráfica para trazar los resultados del pH contra las toneladas de cal agregadas para cada uno de los suelos, responda las preguntas sobre esta gráfica.
Trazar los resultados en la Tabla 14.3 en la Figura 14.2 para los tres suelos y conectar los puntos de datos para formar una línea para cada uno de los tres suelos. Utilizando la siguiente gráfica para trazar los resultados del pH contra las toneladas de cal agregadas para cada uno de los suelos, responda las preguntas sobre esta gráfica.
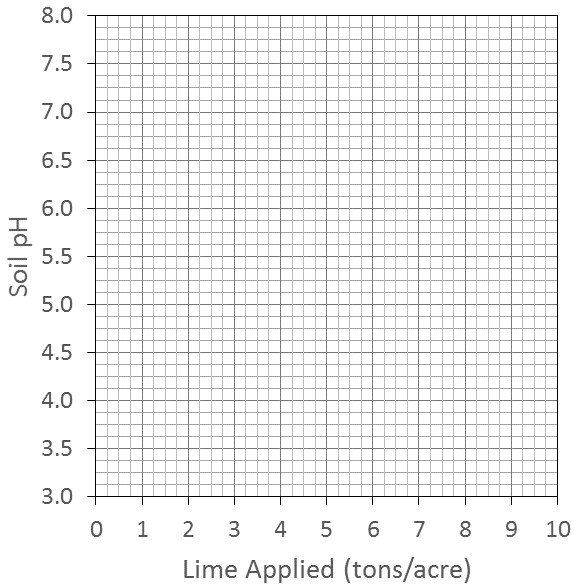
![]() ¿Cuál es la relación entre la cantidad de cal necesaria para elevar el pH del suelo y la capacidad de intercambio catiónico del suelo?
¿Cuál es la relación entre la cantidad de cal necesaria para elevar el pH del suelo y la capacidad de intercambio catiónico del suelo?
![]() ¿Deben ser siempre los mismos los objetivos de pH para un suelo arcilloso y un suelo orgánico? Explica tu respuesta. SUGERENCIA: Los suelos orgánicos contienen muy poco Al.
¿Deben ser siempre los mismos los objetivos de pH para un suelo arcilloso y un suelo orgánico? Explica tu respuesta. SUGERENCIA: Los suelos orgánicos contienen muy poco Al.
![]() Si el suelo arenoso y arcilloso fueran encalados para lograr el mismo pH, ¿qué suelo probablemente necesitará cal antes? ¿Por qué?
Si el suelo arenoso y arcilloso fueran encalados para lograr el mismo pH, ¿qué suelo probablemente necesitará cal antes? ¿Por qué?
Asignación: Cuestionario en línea
Un cuestionario para este laboratorio estará disponible en línea. Por favor acceda a él según lo indique su instructor.


