2.2: Adhesión y celosías
- Page ID
- 87984
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Como acabamos de ver, un átomo busca tener una capa exterior completa (es decir, ocho electrones para la mayoría de los elementos, o dos electrones para hidrógeno y helio) para que sea atómicamente estable. Esto se logra transfiriendo o compartiendo electrones con otros átomos. Home

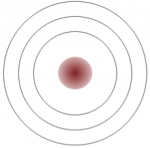
El sodio tiene 11 electrones: dos en el primer caparazón, ocho en el segundo y uno en el tercero (Figura\(\PageIndex{1}\)). El sodio renuncia fácilmente a ese único electrón de tercera capa, y cuando pierde esta carga negativa, se carga positivamente (porque ahora tiene 11 protones y solo 10 electrones). Al renunciar a su solitario electrón de tercera capa, el sodio termina con una capa externa completa. El cloro, por otro lado, tiene 17 electrones: dos en el primer caparazón, ocho en el segundo y siete en el tercero. El cloro acepta fácilmente un octavo electrón para llenar su tercera capa, y por lo tanto se carga negativamente porque tiene 17 protones y 18 electrones. Al cambiar su número de electrones, estos átomos se convierten en iones: el sodio pierde un electrón para convertirse en un ion o catión positivo, y el cloro gana un electrón para convertirse en un ion o anión negativo (Figura\(\PageIndex{1}\)).
Dado que las cargas negativas y positivas se atraen, los iones de sodio y cloro pueden pegarse, creando un enlace iónico. Se puede pensar que los electrones se transfieren de un átomo a otro en un enlace iónico. La sal de mesa común (NaCl) es un mineral compuesto por cloro y sodio unidos entre sí por enlaces iónicos (Figura\(\PageIndex{1}\)). El nombre mineral para el NaCl es halita.
Un elemento como el cloro también puede formar enlaces sin formar iones. Por ejemplo, dos átomos de cloro, que buscan cada uno un octavo electrón en su capa externa, pueden compartir un electrón en lo que se conoce como enlace covalente para formar gas cloro (Cl 2) (Figura\(\PageIndex{2}\)). Los electrones se comparten en un enlace covalente.

A continuación se enumeran varios elementos junto con sus números atómicos. Suponiendo que la primera capa de electrones puede contener dos electrones y las posteriores conchas de electrones pueden contener ocho electrones, esbozar en las configuraciones de electrones para estos elementos. Predecir si es probable que el elemento forme un catión (+) o un anión (−) cuando tiene lugar la transferencia de electrones, y qué carga tendría (por ejemplo, +1, +2, −1).
El primero está hecho por ti. El flúor necesitaba un electrón extra para tener 8 en su caparazón más externo, y al ganar ese electrón se cargó negativamente.
Consulte el Apéndice 3 para las respuestas del Ejercicio 2.1.
| Flúor (9)
anión (−1) | Litio (3) ________ |
| Magnesio (12) ________ | Argón (18) ________ |
| Cloro (17) ________ | Berilio (3) ________ |
| Oxígeno (8) ________ | Sodio (11) ________ |
Un átomo de carbono tiene seis protones y seis electrones; dos de los electrones están en la capa interna y cuatro en la capa externa (Figura\(\PageIndex{3}\)). Carbon would need to gain or lose four electrons to have a filled outer shell, and this would create too great a charge imbalance for the ion to be stable. On the other hand, carbon can share electrons to create covalent bonds. In the mineral diamond, the carbon atoms are linked together in a three-dimensional framework, where each carbon atom is bonded to four other carbon atoms and every bond is a very strong covalent bond. In the mineral graphite, the carbon atoms are linked together in sheets or layers (Figure \(\PageIndex{3}\)), and each carbon atom is covalently bonded to three others. Graphite-based compounds, which are strong because of the strong intra-layer covalent bonding, are used in high-end sports equipment such as ultralight racing bicycles. Graphite itself is soft because the bonding between these layers is relatively weak, and it is used in a variety of applications, including lubricants and pencils.

El silicio y el oxígeno se unen para crear un tetraedro de sílice, que es una forma piramidal de cuatro lados con O en cada esquina y Si en el medio (Figura\(\PageIndex{4}\)). Esta estructura es el bloque de construcción de los minerales de silicato (los cuales se describen en la Sección 2.4). Los enlaces en un tetraedro de sílice tienen algunas de las propiedades de los enlaces covalentes y algunas de las propiedades de los enlaces iónicos. Como resultado del carácter iónico, el silicio se convierte en catión (con una carga de +4) y el oxígeno se convierte en anión (con una carga de —2). La carga neta de un tetraedro de sílice (SiO 4) es: 4 + 4 (−2) = 4 − 8 = −4. Como veremos más adelante, los tetraedros de sílice (plural de tetraedro) se unen de diversas maneras para formar la mayoría de los minerales comunes de la corteza.

La mayoría de los minerales se caracterizan por enlaces iónicos, enlaces covalentes o una combinación de los dos, pero hay otros tipos de enlaces que son importantes en los minerales, incluyendo enlaces metálicos y fuerzas electrostáticas más débiles (enlaces de hidrógeno o Van der Waals). Los elementos metálicos tienen electrones externos que se mantienen relativamente flojos. (Los metales se destacan en la tabla periódica en el Apéndice 1.) Cuando se forman enlaces entre tales átomos, estos electrones pueden moverse libremente de un átomo a otro. Por lo tanto, un metal puede ser considerado como una matriz de núcleos atómicos cargados positivamente sumergidos en un mar de electrones móviles. Esta característica explica dos propiedades muy importantes de los metales: su conductividad eléctrica y su maleabilidad (pueden deformarse y conformarse).
Las moléculas que están unidas iónica o covalentemente también pueden tener otras fuerzas electrostáticas más débiles que las mantienen unidas. Ejemplos de esto son la fuerza que mantiene juntas las láminas de grafito y la atracción entre las moléculas de agua.
¿Qué pasa con todos estos nombres “sili”?
El elemento silicio es uno de los elementos geológicos más importantes y es el segundo elemento más abundante en la corteza terrestre (después del oxígeno). El silicio se une fácilmente con el oxígeno para formar un tetraedro de sílice (Figura\(\PageIndex{4}\)). Los cristales de silicio puro (creados en un laboratorio) se utilizan para fabricar medios semiconductores para dispositivos electrónicos. Un mineral de silicato es aquel en el que el silicio y el oxígeno están presentes como tetraedros de sílice. La sílice también se refiere a un componente químico de una roca y se expresa como% SiO 2. El cuarzo mineral está compuesto enteramente por tetraedros de sílice, y algunas formas de cuarzo también se conocen como “sílice”. La silicona es un producto sintético (por ejemplo, caucho de silicona, resina o calafateo) hecho de cadenas de silicio-oxígeno y varias moléculas orgánicas. Para ayudarle a mantener los nombres “sili” rectos, aquí hay una tabla de resumen:
| Nombre “Sili” | Definición |
|---|---|
| Silicio | El 14 º elemento |
| Oblea de silicio | Un cristal de silicio puro cortado muy fino y utilizado para electrónica |
| Tetraedro de sílice | Una combinación de un átomo de silicio y cuatro átomos de oxígeno que forman un tetraedro |
| % sílice | La proporción de una roca que está compuesta por el componente SiO 2 |
| Sílice | Un sólido hecho de SiO 2 (pero no necesariamente un mineral, por ejemplo, ópalo) |
| Silicato | Un mineral que contiene tetraedros de sílice (por ejemplo, cuarzo, feldespato, mica, olivino) |
| Silicona | Un material sintético flexible compuesto por cadenas Si-O con moléculas orgánicas unidas |
Los elementos que tienen una cubierta exterior completa se describen como inertes porque no tienden a reaccionar con otros elementos para formar compuestos. Eso es porque no necesitan perder ni ganar electrones para estabilizarse, y así no se convierten en iones. Todos ellos aparecen en la columna de extrema derecha de la tabla periódica. Ejemplos son: helio, neón, argón, etc.
Como se describe en el Capítulo 1, todos los minerales se caracterizan por un patrón tridimensional específico conocido como estructura reticular o cristalina. Estas estructuras van desde el patrón cúbico simple de halita (NaCl) (Figura\(\PageIndex{1}\)), hasta los patrones muy complejos de algunos minerales de silicato. Dos minerales pueden tener la misma composición, pero estructuras cristalinas y propiedades muy diferentes. El grafito y el diamante, por ejemplo, están compuestos solo de carbono, pero si bien el diamante es la sustancia más dura conocida, el grafito es más suave que el papel. Sus estructuras de celosía se comparan en la Figura\(\PageIndex{5}\).

Las redes minerales tienen importantes implicaciones para las propiedades minerales, como lo ejemplifica la dureza del diamante y la suavidad del grafito. Las celosías también determinan la forma en la que crecen los cristales minerales y cómo se rompen. Por ejemplo, los ángulos rectos en la celosía de la halita mineral (Figura\(\PageIndex{1}\)) influyen tanto en la forma de sus cristales (cúbicos), como en la forma en que esos cristales se rompen (Figura\(\PageIndex{6}\)).

Descripciones de las imágenes
Descripción de la\(\PageIndex{1}\) imagen de la figura: El sodio tiene un electrón en su capa externa y el cloro tiene 7 electrones en su capa externa. Un electrón externo del sodio va al cloro, lo que hace que el cloro sea ligeramente negativo y el sodio ligeramente positivo. Se atraen entre sí y juntos forman Cloruro de Sodio. [Volver a la figura\(\PageIndex{1}\)]
Descripción de la\(\PageIndex{3}\) imagen de la figura: (Izquierda) Un átomo de carbono tiene dos electrones en su capa interna y cuatro electrones en su capa externa. (Derecha) Un átomo de carbono comparte electrones con otros cuatro átomos de carbono para formar una capa externa completa. [Volver a la figura\(\PageIndex{3}\)]
Atribuciones de medios
- Figuras 2.2.1, 2.2.2, 2.2.3, 2.2.4, 2.2.5 y 2.2.6 (derecha): © Steven Earle. CC POR.
- Figura\(\PageIndex{6}\) (izquierda): Halite. © Rob Lavinsky, iRocks.com. CC BY-SA.