6.4: ¿Cómo se relaciona la energía con la longitud de onda de la radiación?
- Page ID
- 88822
Podemos pensar en la radiación ya sea como ondas o como partículas individuales llamadas fotones. La energía asociada con un solo fotón viene dada por
\[E = hν \]
donde\(E\) está la energía (unidades SI de J), h es la constante de Planck (h = 6.626 x 10 —34 J s), y\(\nu\) es la frecuencia de la radiación (unidades SI de s —1 o Hertz, Hz) (ver figura abajo). La frecuencia se relaciona con la longitud de onda por\(λ=c/ν\)\(c\), donde, la velocidad de la luz, es 2.998 x 10 8 m s —1. Otra cantidad que suele ver es el número de onda\(σ=1/λ\), que comúnmente se reporta en unidades de cm —1.
La energía de un solo fotón que tiene la longitud de onda\(λ\) viene dada por:
\[E=\frac{h c}{\lambda}=\frac{1.986 \times 10^{-16} \mathrm{J} \,\mathrm{nm} \text { photon }^{-1}}{\lambda}\]
Tenga en cuenta que a medida que la longitud de onda de la luz se acorta, la energía del fotón aumenta. La energía de un mol de fotones que tienen la longitud de onda\(λ\) se encuentra multiplicando la ecuación anterior por el número de Avogadro:
\[E_{m}=\frac{h c N_{A}}{\lambda}=\frac{1.196 \times 10^{8} \mathrm{J} \mathrm{nm} \mathrm{mol}^{-1}}{\lambda}\]
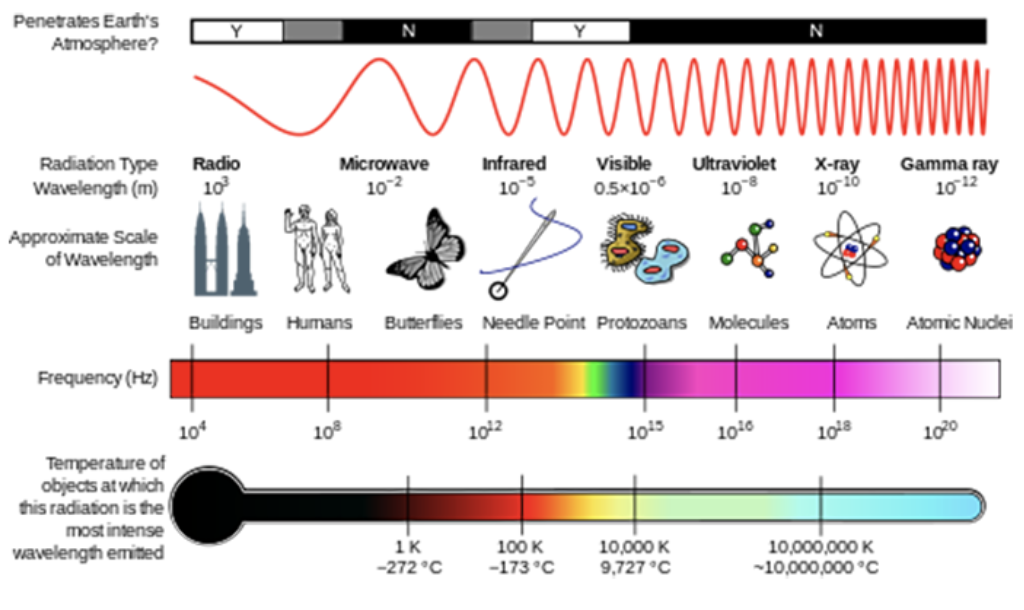
En la lección sobre composición atmosférica, viste cómo la radiación solar UV pudo romper moléculas para iniciar la química atmosférica. Estas moléculas están absorbiendo la energía de un fotón de radiación, y si esa energía fotónica es mayor que la fuerza del enlace químico, la molécula puede romperse.
Ejercicio
Considera la reacción
\[\ce{O3 + UV -> O2 + O*}. \nonumber\]
Si la fuerza de unión entre O 2 y O* (es decir, átomo de oxígeno en estado excitado) es 386 kJ mol —1, ¿cuál es la longitud de onda más larga que puede tener un fotón y aún así romper este enlace?
- Haga clic para obtener la respuesta.
-
RESPUESTA: Resuelve para longitud de onda en la ecuación [6.2b]
\(\lambda=\frac{1.196 \times 10^{8} \mathrm{J} \mathrm{nm} \mathrm{mol}^{-1}}{E_{m}}=\frac{1.196 \times 10^{8} \mathrm{J} \mathrm{nm} \mathrm{mol}^{-1}}{386 \times 10^{3} \mathrm{Jmol}^{-1}}=309 \mathrm{nm}\)


