5.5: Dióxido de Carbono, pH y Acidificación Oceánica
- Page ID
- 89472
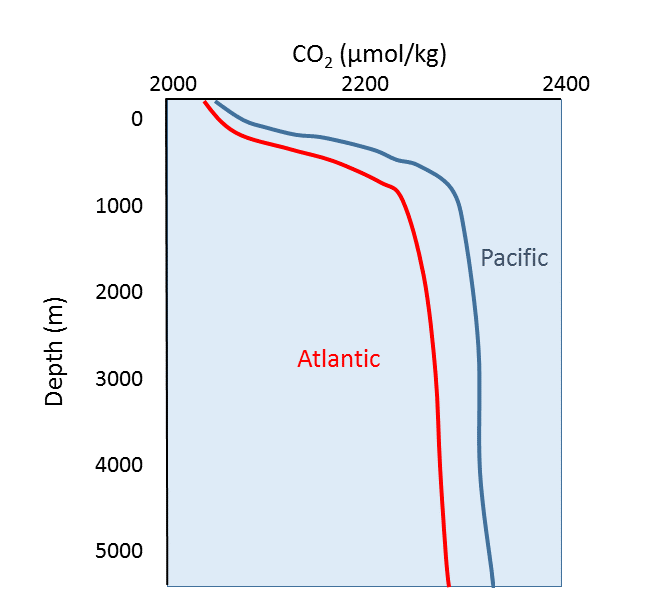
El oxígeno y el dióxido de carbono están involucrados en los mismos procesos biológicos en el océano, pero de manera opuesta; la fotosíntesis consume CO 2 y produce O 2, mientras que la respiración y descomposición consumen O 2 y producen CO 2. Por lo tanto, no debería sorprender que los perfiles oceánicos de CO 2 sean esencialmente lo opuesto a los perfiles de oxígeno disuelto (Figura\(\PageIndex{1}\)). En la superficie, la fotosíntesis consume CO 2 por lo que los niveles de CO 2 permanecen relativamente bajos. Además, los organismos que utilizan carbonato en sus conchas son comunes cerca de la superficie, reduciendo aún más la cantidad de CO 2 disuelto.
En aguas más profundas, la concentración de CO 2 aumenta a medida que la respiración excede la fotosíntesis, y la descomposición de la materia orgánica agrega CO 2 adicional al agua. Al igual que con el oxígeno, a menudo hay más CO 2 a profundidad porque el agua fría del fondo contiene más gases disueltos, y las altas presiones aumentan la solubilidad. Las aguas profundas en el Pacífico contienen más CO 2 que el Atlántico ya que el agua del Pacífico es más antigua y ha acumulado más CO 2 de la respiración de organismos bentónicos.
Pero el comportamiento del dióxido de carbono en el océano es más complejo de lo que sugeriría la cifra anterior. Cuando el gas CO 2 se disuelve en el océano, interactúa con el agua para producir una serie de compuestos diferentes de acuerdo con la siguiente reacción:
CO 2 + H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 — ↔ 2H + + CO 3 2-
El CO 2 reacciona con el agua para producir ácido carbónico (H 2 CO 3), que luego se disocia en bicarbonato (HCO 3 —) e iones hidrógeno (H +). Los iones bicarbonato pueden disociarse adicionalmente en carbonato (CO 3 2-) e iones hidrógeno adicionales (Figura\(\PageIndex{2}\)).
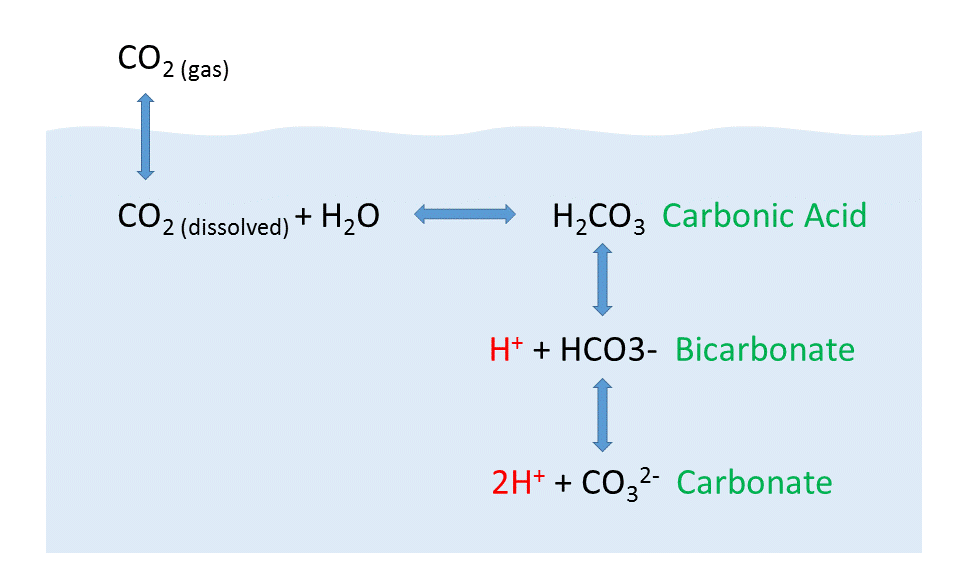
La mayor parte del CO 2 que se disuelve o se produce en el océano se convierte rápidamente en bicarbonato. El bicarbonato representa alrededor del 92% del CO 2 disuelto en el océano, y el carbonato representa alrededor del 7%, por lo que solo alrededor del 1% permanece como CO 2, y poco se vuelve a absorber en el aire. La rápida conversión del CO 2 en otras formas le impide alcanzar el equilibrio con la atmósfera, y de esta manera, el agua puede contener 50-60 veces más CO 2 y sus derivados que el aire.
CO 2 y pH
La ecuación anterior también ilustra el papel del dióxido de carbono como amortiguador, regulando el pH del océano. Recordemos que el pH refleja la acidez o basicidad de una solución. La escala de pH va de 0-14, con 0 indicando un ácido muy fuerte, y 14 representando condiciones altamente básicas. Una solución con un pH de 7 se considera neutra, como es el caso del agua pura. El valor de pH se calcula como el logaritmo negativo de la concentración de iones hidrógeno según la ecuación:
pH = -log 10 [H +]
Por lo tanto, una alta concentración de iones H + conduce a un pH bajo y condiciones ácidas, mientras que una concentración baja de H + indica un pH alto y condiciones básicas. También cabe señalar que el pH se describe en una escala logarítmica, por lo que cada cambio de punto en la escala de pH representa realmente un cambio de orden de magnitud (10 x) en la fuerza de la solución. Entonces un pH de 6 es 10 veces más ácido que un pH de 7, y un pH de 5 es 100 veces (10 x 10) más ácido que un pH de 7.
El dióxido de carbono y los otros compuestos de carbono enumerados anteriormente juegan un papel importante en el amortiguamiento del pH del océano. Actualmente, el pH promedio para el océano global es de aproximadamente 8.1, lo que significa que el agua de mar es ligeramente básica. Debido a que la mayor parte del carbono inorgánico disuelto en el océano existe en forma de bicarbonato, el bicarbonato puede responder a las perturbaciones en el pH liberando o incorporando iones de hidrógeno en los diversos compuestos de carbono. Si el pH sube (bajo [H +]), el bicarbonato puede disociarse en carbonato y liberar más iones H +, disminuyendo así el pH. Por el contrario, si el pH es demasiado bajo (alto [H +]), el bicarbonato y el carbonato pueden incorporar algunos de esos iones H + y producir bicarbonato, ácido carbónico o CO 2 para eliminar los iones H + y elevar el pH. Al transportar iones H + de un lado a otro entre los diversos compuestos de esta ecuación, se regula el pH del océano y las condiciones siguen siendo favorables para la vida.
CO 2 y Acidificación Oceánica
En los últimos años ha habido una creciente preocupación por el fenómeno de la acidificación de los océanos. Como se describe en los procesos anteriores, la adición de CO 2 al agua de mar disminuye el pH del agua. A medida que las fuentes antropogénicas de CO 2 atmosférico han aumentado desde la Revolución Industrial, los océanos han ido absorbiendo una cantidad cada vez mayor de CO 2, y los investigadores han documentado una disminución en el pH de los océanos de aproximadamente 8.2 a 8.1 en el siglo pasado. Esto puede no parecer un gran cambio, pero recuerde que dado que el pH está en una escala logarítmica, esta disminución representa un incremento de 30% en la acidez. Cabe señalar que incluso a un pH de 8.1 el océano en realidad no es ácido; el término “acidificación” se refiere a que el pH es cada vez más bajo, es decir, el agua se está moviendo hacia condiciones más ácidas.
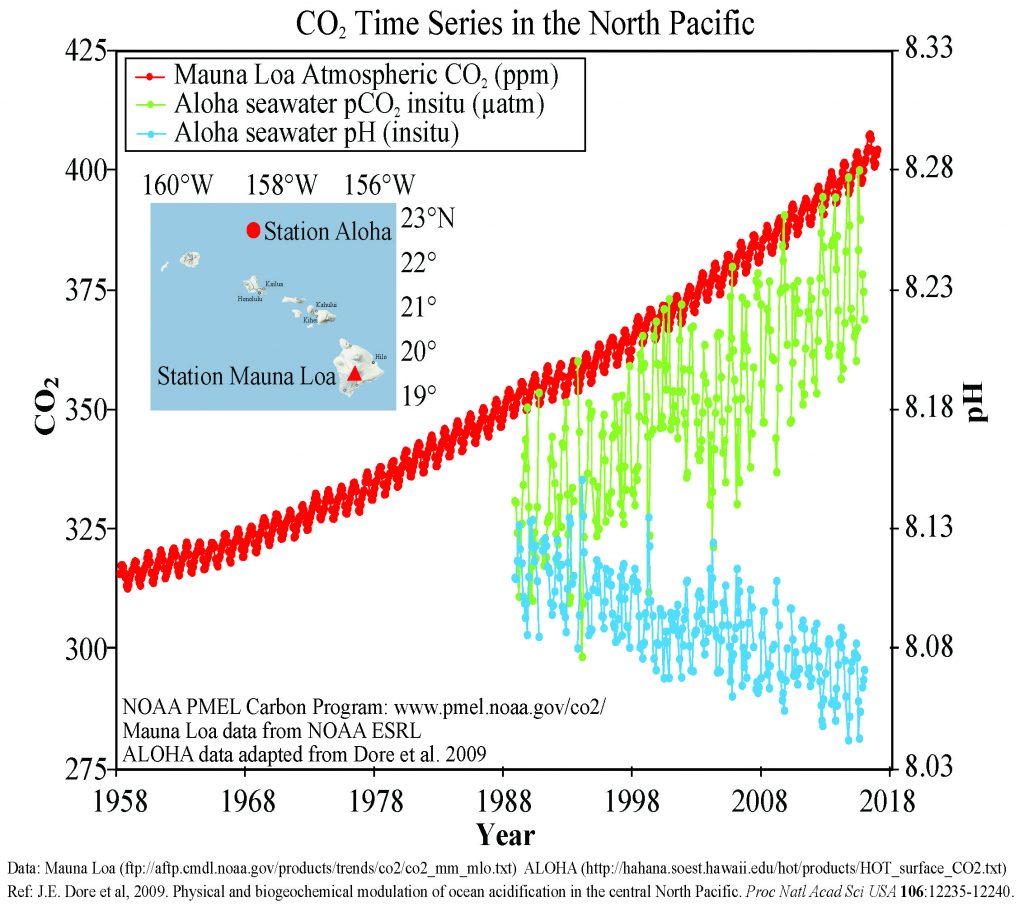
La figura\(\PageIndex{3}\) presenta datos de estaciones de observación en y alrededor de las islas hawaianas. A medida que los niveles atmosféricos de CO 2 han aumentado, el contenido de CO 2 del agua del océano también ha aumentado, lo que lleva a una reducción en el pH del agua de mar. Algunos modelos sugieren que a la tasa actual de adición de CO 2 a la atmósfera, para 2100 el pH del océano podría reducirse aún más a alrededor de 7.8, lo que representaría un aumento de más de 120% en la acidez del océano desde la Revolución Industrial.
¿Por qué es importante esto? La disminución del pH puede afectar a muchos sistemas biológicos. De particular preocupación son los organismos que secretan conchas o esqueletos de carbonato de calcio, como corales, mariscos y organismos planctónicos. A niveles de pH más bajos, el carbonato de calcio se disuelve, erosionando las conchas y esqueletos de estos organismos (Figura\(\PageIndex{4}\)).

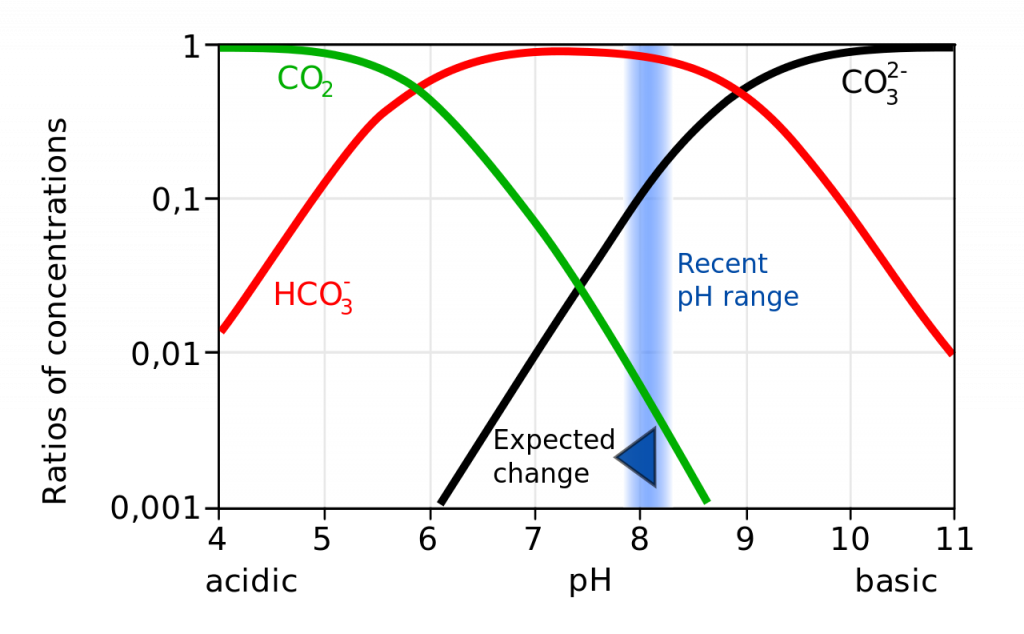
Un pH decreciente no solo conduce a mayores tasas de disolución del carbonato de calcio, sino que también disminuye la cantidad de iones carbonato libres en el agua. Las proporciones relativas de los diferentes compuestos de carbono en el agua de mar dependen del pH (Figura\(\PageIndex{6}\)). A medida que disminuye el pH, la cantidad de carbonato disminuye, por lo que hay menos disponible para que los organismos se incorporen a sus conchas y esqueletos. Por lo tanto, la acidificación oceánica disuelve las conchas existentes y hace que sea más difícil que ocurra la formación de conchas.
Enlaces adicionales para más información:


