7.1: Propiedades de Agua de Mar
- Page ID
- 89677
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Propiedades de Seawater
¡El agua de mar es el recurso más abundante de la Tierra! El agua de mar ha evolucionado a lo que es durante los miles de millones de años que los océanos han existido en la Tierra. Este capítulo examina las propiedades físicas y químicas del agua y del agua de mar.
Componentes del agua de mar
El agua de mar está compuesta por:
• Agua • Materia disuelta: sólidos y gas (como iones)
• Materia suspendida (polvo y residuos orgánicos)
Iones en agua de mar
• Cl - 55%
• Na - 30.4%
• SO 4 - 7.6%
• Mg - 3.9%
• Ca - 1.2%
• K - 1.1%
• todos los demás componentes disueltos - <1%
Propiedades del Agua
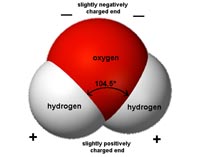
El agua es una sustancia polar. Cada molécula de agua tiene una carga negativa asociada a su oxígeno, y una carga positiva con él hidrógeno (Figura 7.3). Este carácter polar es responsable de sus propiedades de cohesión y adhesión.
• Cohesión: el agua tiene una alta tensión superficial porque las moléculas de agua se pegan
• Adhesión: el agua se “pega” a las cosas.
• Alta acción capilar: Las propiedades de cohesión y adhesión del agua permiten que el agua se mueva hacia arriba contra la gravedad en pequeños espacios confinados. Cuanto más pequeño sea el tubo, más alto se elevará el agua. La acción capilar ayuda a las plantas a mover el agua hacia arriba desde sus raíces hasta sus hojas.
• El agua es un poderoso solvente: Un solvente es una sustancia que disuelve un soluto (un líquido, sólido o gas químicamente diferente), resultando en una solución. El carácter polar de la molécula de agua le permite formar enlaces débiles con otras moléculas polares. La sustancia unida con enlaces iónicos se disolverá fácilmente en agua. Sin embargo, la solubilidad de los compuestos químicos en agua es altamente variable. La solubilidad de un compuesto químico en agua se define como la cantidad máxima del químico que se disolverá en agua pura a una temperatura especificada.
El agua de mar es una solución.
¿Por qué no se mezclan aceite y agua?
Los compuestos orgánicos que contienen solo carbono e hidrógeno (hidrocarburo) son no polares y se disolverán en disolventes no polares (como el aceite). Sin embargo, muchos compuestos orgánicos tienen “grupos funcionales con elementos muy electronegativos” (es decir, oxígeno), haciendo que toda la molécula sea polar, permitiendo que se disuelvan en agua (por ejemplo, el azúcar y el almidón pueden disolverse en agua). Los compuestos de jabón (llamados surfactantes) tienen moléculas que son ambas; tienen porciones que se comportan como extremos polares y no polares. Un extremo se adherirá a los hidrocarburos y otras sustancias no polares mientras que el otro se adherirá al agua y otras moléculas polares. Esto permite que los compuestos orgánicos polares se dispersen en agua.
 |
 |
| Figura 7.7. El petróleo es una sustancia no polar. El agua es polar. | Figura 7.8. Limpieza de buques después de un derrame de petróleo. |
Propiedades del Agua
pH (acidez y alcalinidad)
El pH es una medida de la acidez o alcalinidad de una solución expresada en una escala logarítmica en la que 7 es neutro, los valores más bajos son más ácidos y los valores más altos son más alcalinos. El pH es una medida importante en el agua de mar. El agua neutra es un pH de 7.
Solución amortiguadora de bicarbonato de agua de mar
Un sistema de amortiguación natural con la interacción del agua de mar con el dióxido de carbono. El agua de mar generalmente está siempre dentro de un rango de pH de 7.5 a 8.5. Las interacciones de los componentes disueltos mantienen el agua del océano en un rango estable. Los organismos que viven en o cerca del agua de mar tienen una tolerancia limitada a las variaciones en el pH y otros factores. Por ejemplo, la calcita (como en el material de la cubierta) es estable dentro de este rango, pero se disolverá si se expone a condiciones ácidas. El amortiguamiento de carbonato mantiene el pH estable por precipitación (aumento de pH) o disolución (disminución del pH) de carbonato de calcio - CaCo 3.