1.1: Los fundamentos químicos de la vida
- Page ID
- 81125
Al finalizar esta sección, los alumnos podrán:
- Describir, a nivel introductorio, los fundamentos químicos y biológicos básicos de la vida en la Tierra
- Definir el medio ambiente, los ecosistemas y las ciencias ambientales
- Dar ejemplos de la naturaleza interdisciplinaria de la ciencia ambiental
- Definir sustentabilidad y desarrollo sustentable
- Explicar la compleja relación entre los sistemas naturales y humanos, en relación con el impacto ambiental, el principio de precaución y las justificaciones ambientales
- Comprender el enfoque científico y comenzar a aplicar el método científico
Los fundamentos químicos y biológicos de la vida
Los elementos en diversas combinaciones comprenden toda la materia en la Tierra, incluyendo los seres vivos. Algunos de los elementos más abundantes en los organismos vivos incluyen carbono, hidrógeno, nitrógeno, oxígeno, azufre y fósforo. Estos forman los ácidos nucleicos, proteínas, carbohidratos y lípidos que son los componentes fundamentales de la materia viva. Los biólogos deben entender estos importantes bloques de construcción y las estructuras únicas de los átomos que componen las moléculas, permitiendo la formación de células, tejidos, sistemas de órganos y organismos enteros.
En su nivel más fundamental, la vida está conformada por la materia. La materia es cualquier sustancia que ocupa espacio y tiene masa. Los elementos son formas únicas de materia con propiedades químicas y físicas específicas que no se pueden descomponer en sustancias más pequeñas mediante reacciones químicas ordinarias. Hay 118 elementos, pero sólo 92 ocurren de forma natural. Los elementos restantes se sintetizan en laboratorios y son inestables. Los cinco elementos comunes a todos los organismos vivos son oxígeno (O), carbono (C), hidrógeno (H) y nitrógeno (N) y fósforo (P). En el mundo no vivo, los elementos se encuentran en diferentes proporciones, y algunos elementos comunes a los organismos vivos son relativamente raros en el conjunto de la tierra (Tabla\(\PageIndex{1}\)). Por ejemplo, la atmósfera es rica en nitrógeno y oxígeno pero contiene poco carbono e hidrógeno, mientras que la corteza terrestre, aunque contiene oxígeno y una pequeña cantidad de hidrógeno, tiene poco nitrógeno y carbono. A pesar de sus diferencias en abundancia, todos los elementos y las reacciones químicas entre ellos obedecen las mismas leyes químicas y físicas independientemente de que formen parte del mundo vivo o no vivo.
| Biosfera | Atmósfera | Litosfera | |
|---|---|---|---|
| Oxígeno (O) | 65% | 21% | 46% |
| Carbono (C) | 18% | trazar | trazar |
| Hidrógeno (H) | 10% | trazar | trazar |
| Nitrógeno (N) | 3% | 78% | trazar |
| Fósforo (P) | trazar | trazar | > 30% |
La estructura del átomo
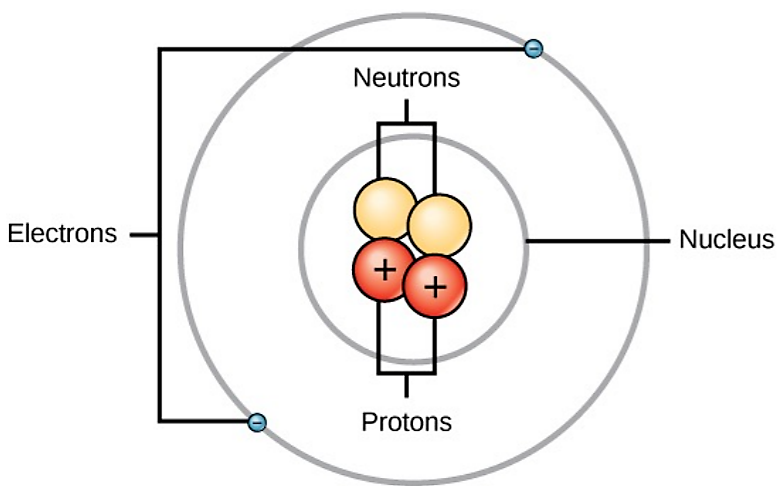
Un átomo es la unidad de materia más pequeña que conserva todas las propiedades químicas de un elemento. Por ejemplo, un átomo de oro tiene todas las propiedades del oro en que es un metal sólido a temperatura ambiente. Una moneda de oro es simplemente un número muy grande de átomos de oro moldeados en forma de moneda y que contienen pequeñas cantidades de otros elementos conocidos como impurezas. Los átomos de oro no se pueden descomponer en nada más pequeño sin dejar de conservar las propiedades del oro. Un átomo está compuesto por dos regiones: el núcleo, que está en el centro del átomo y contiene protones y neutrones, y la región más externa del átomo que mantiene sus electrones en órbita alrededor del núcleo, como se ilustra en la Figura Los\(\PageIndex{1}\) átomos contienen protones, electrones y neutrones, entre otras partículas subatómicas. La única excepción es el hidrógeno (H), que está hecho de un protón y un electrón sin neutrones.
.png)
Los protones y neutrones tienen aproximadamente la misma masa, aproximadamente 1.67 × 10 -24 gramos. Los científicos definen arbitrariamente esta cantidad de masa como una unidad de masa atómica (amu) (Tabla\(\PageIndex{2}\)). Aunque similares en masa, los protones y neutrones difieren en su carga eléctrica. Un protón está cargado positivamente mientras que un neutrón está sin carga. Por lo tanto, el número de neutrones en un átomo contribuye significativamente a su masa, pero no a su carga.
| Cargar | Masa (amu) | Ubicación en atom | |
|---|---|---|---|
| Protón | +1 | 1 | Núcleo |
| Neutrón | 0 | 1 | Núcleo |
| Electron | -1 | 0 | Orbitales |
Los electrones son mucho más pequeños en masa que los protones, pesan solo 9.11 × 10-28 gramos, o aproximadamente 1/1800 de una unidad de masa atómica. De ahí que no contribuyan mucho a la masa atómica general de un elemento. Aunque no contribuyen significativamente a la masa, los electrones sí contribuyen en gran medida a la carga del átomo, ya que cada electrón tiene una carga negativa igual a la carga positiva de un protón. En los átomos neutros no cargados, el número de electrones que orbitan el núcleo es igual al número de protones dentro del núcleo. En estos átomos, las cargas positivas y negativas se cancelan entre sí, conduciendo a un átomo sin carga neta. Contabilizando los tamaños de protones, neutrones y electrones, la mayor parte del volumen de un átomo, mayor del 99 por ciento, es, de hecho, espacio vacío. Con todo este espacio vacío, uno podría preguntarse por qué los llamados objetos sólidos no se limitan a atravesar unos a otros. La razón por la que no lo hacen es que los electrones que rodean a todos los átomos están cargados negativamente y las cargas negativas se repelen entre sí. Cuando un átomo gana o pierde un electrón, se forma un ion. Los iones son formas cargadas de átomos. Un ion cargado positivamente, como el sodio (Na +), ha perdido uno o más electrones. Un ion cargado negativamente, como el cloruro (Cl -), ha ganado uno o más electrones.
Moléculas
Las moléculas se forman cuando dos o más átomos se unen a través de enlaces químicos para formar una unidad de materia. A lo largo de su estudio de la ciencia ambiental, encontrará muchas moléculas, incluido el gas dióxido de carbono. Su fórmula química es CO 2, lo que indica que esta molécula está compuesta por un átomo de carbono y dos átomos de oxígeno. Algunas moléculas se cargan debido a los iones que contienen. Este es el caso del nitrato (NO 3 -), una fuente común de nitrógeno a las plantas. Contiene un átomo de nitrógeno y tres átomos de oxígeno, y tiene una carga general de uno negativo.
Isótopos
Los isótopos son formas diferentes de un elemento que tienen el mismo número de protones pero un número diferente de neutrones. Algunos elementos, como el carbono, el potasio y el uranio, tienen isótopos naturales. El carbono-12 contiene seis protones, seis neutrones y seis electrones; por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones). El carbono-14 contiene seis protones, ocho neutrones y seis electrones; su masa atómica es 14 (seis protones y ocho electrones). Estas dos formas alternas de carbono son isótopos. Algunos isótopos pueden emitir neutrones, protones y electrones, y alcanzar una configuración atómica más estable (menor nivel de energía potencial); estos son isótopos radiactivos, o radioisótopos. La desintegración radiactiva describe la pérdida de energía que ocurre cuando el núcleo de un átomo inestable libera radiación, por ejemplo, carbono-14 perdiendo neutrones para finalmente convertirse en carbono-12.
Carbono
La unidad funcional básica de la vida es una célula y todos los organismos están formados por una o más células. Las células están hechas de muchas moléculas complejas llamadas macromoléculas, como proteínas, ácidos nucleicos (ARN y ADN), carbohidratos y lípidos. Las macromoléculas son un subconjunto de moléculas orgánicas que son especialmente importantes para la vida. El componente fundamental para todas estas macromoléculas es el carbono. El átomo de carbono tiene propiedades únicas que le permiten formar enlaces covalentes con hasta cuatro átomos diferentes, lo que hace que este elemento versátil sea ideal para servir como el componente estructural básico, o “cadena principal”, de las macromoléculas.
Hidrocarburos
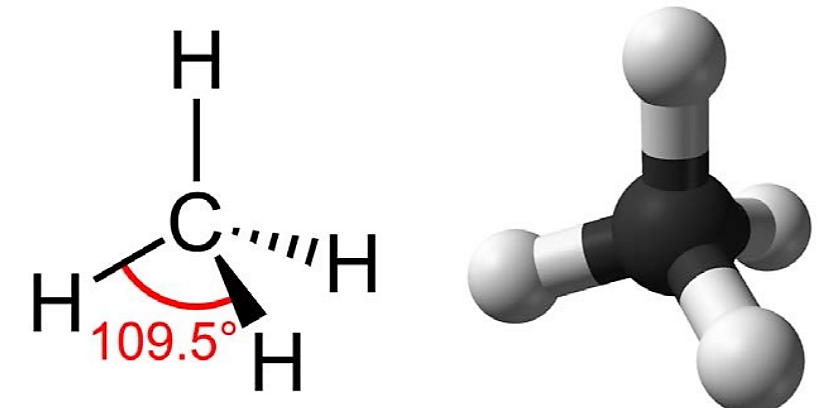
Los hidrocarburos son moléculas orgánicas que constan enteramente de carbono e hidrógeno, como el metano (CH 4). A menudo usamos hidrocarburos en nuestra vida diaria como combustible, como el propano en una parrilla de gas o el butano en un encendedor. Los muchos enlaces covalentes entre los átomos en los hidrocarburos almacenan una gran cantidad de energía, que se libera cuando estas moléculas se queman (oxidan). El metano, un excelente combustible, es la molécula de hidrocarburo más simple, con un átomo de carbono central unido a cuatro átomos de hidrógeno diferentes, como se ilustra en la Figura\(\PageIndex{2}\).
.png)
Como columna vertebral de las grandes moléculas de los seres vivos, los hidrocarburos pueden existir como cadenas lineales de carbono, anillos de carbono o combinaciones de ambos. Esta forma tridimensional o conformación de las grandes moléculas de la vida (macromoléculas) es fundamental para su funcionamiento.

